- Introduction : Réaction de la lactate déshydrogénase
- La navette malate-aspartate
- Glycolyse (an)aérobie conventionnelle
- Le concept de navette du lactate
- Cloisonnement intracellulaire de la LDH : leçons de la navette phosphocréatine
- Cloisonnement intercellulaire du métabolisme du lactate : la navette du lactate astrocyte-neuron
- Régénération du NAD+ cytosolique
- Nutation des protons et transport mitochondrial des substrats
- Considérations méthodologiques
- Résumé
- Déclaration de conflit d’intérêts
- Remerciements
Introduction : Réaction de la lactate déshydrogénase
La réduction du pyruvate en lactate, catalysée par la lactate déshydrogénase (LDH ; Pyruvate + NADH + H+ ⇌ Lactate + NAD+) dans le cytosol de nombreuses cellules, a été considérée comme un » cul-de-sac » métabolique (Luft, 2001 ; Quistorff et Grunnet, 2011a), ou peut-être plus justement, un cul de sac métabolique (Barros, 2013), car le lactate ne peut rejoindre le réseau métabolique que via le pyruvate. Chez les mammifères, la réaction de la LDH est également considérée comme étant « proche de l’équilibre » (Spriet et al., 2000 ; Quistorff et Grunnet, 2011a,b), ce qui signifie que la réaction est régulée principalement par les concentrations de ses réactifs et produits, plutôt que par des moyens plus sophistiqués de régulation allostérique ou de modification covalente (Crabtree et Newsholme, 1978). Étant donné que l’équilibre de la réaction de la LDH se situe loin vers la droite (c’est-à-dire que la formation de lactate est favorisée) (Williamson et al., 1967), quelle que soit l’isoforme de la LDH (Quistorff et Grunnet, 2011a,b), on pourrait en déduire que la LDH favorise rarement la réaction inverse (c’est-à-dire l’oxydation du lactate) in vivo. En effet, le rapport d’action de masse (/) nécessaire pour une oxydation appréciable du lactate devrait dépasser la constante d’équilibre de la LDH. Cependant, les preuves expérimentales démentent de plus en plus l’idée que la LDH fonctionne de manière unidirectionnelle in vivo, et soutiennent que le lactate sert de carburant métabolique important pour de nombreux tissus, y compris le squelette (Brooks et al., 1991 ; Bergman et al, 1999 ; Donovan et Pagliassotti, 2000) et le muscle cardiaque (Gertz et al., 1988 ; Chatham et al., 2001), le foie (Skilleter et Kun, 1972 ; Kline et al., 1986) et le cerveau (Schurr et al., 1988 ; Bouzier-Sore et al., 2006 ; Wyss et al., 2011 ; Funfschilling et al., 2012 ; revu dans Barros, 2013). L’objectif de la présente Perspective est de proposer un modèle dans lequel le lactate joue un rôle central dans le transfert de substrat énergétique entre le cytosol (glycolyse) et la mitochondrie (phosphorylation oxydative). Les composantes d’un tel concept ont été démontrées dans le cœur (Safer et al., 1971) et le muscle squelettique (Schantz, 1986), puis étendues à une perspective de navette du lactate (Stainsby et Brooks, 1990 ; Brooks et al., 1999) et revues de manière exhaustive (Gladden, 2004) et à nouveau commentées (Gladden, 2007). Le concept est particulièrement soutenu par des recherches récentes sur les cellules neuronales (Gellerich et al., 2012, 2013 ; Rueda et al., 2014). Bien que le concept décrit dans la présente Perspective ne soit pas nouveau en soi (Safer et al, 1971), un manque apparent de reconnaissance conventionnelle ou d’acceptation de ses fondements théoriques, justifie une attention supplémentaire.
En raison de l’imperméabilité de la membrane mitochondriale interne au NAD+ et au NADH, le NADH généré par la glycolyse dans des conditions aérobies dépend du transfert indirect d’équivalents réducteurs dans les mitochondries via la navette malate-aspartate (MAS) et la navette glycérol-phosphate. On pense également que ces navettes régénèrent le NAD+ cytosolique nécessaire pour soutenir le flux glycolytique lors de la réaction de la glycéraldéhyde 3-phosphate déshydrogénase qui nécessite du NAD+. Il a été démontré que le MAS est le moyen prédominant par lequel cela se produit dans la plupart des tissus oxydés, et il semble constituer la principale navette de NADH dans les neurones matures (Kauppinen et al., 1987 ; Ramos et al., 2003 ; Contreras et Satrustegui, 2009 ; Gellerich et al., 2012). Il est également bien établi que dans des conditions d’augmentation de la demande d’énergie cellulaire et/ou du flux glycolytique (par exemple, lors d’un exercice intense), ainsi qu’en cas d’hypoxie, la concentration de lactate augmente car la réaction LDH facilite l’augmentation des taux de régénération du NAD+ cytosolique (Robergs et al., 2004). Dans le cerveau, cependant, l’augmentation de la concentration de lactate dans la circulation (par exemple, comme pendant l’exercice) entraîne une augmentation de l’élimination du lactate dans le cerveau (Quistorff et al., 2008 ; van Hall et al., 2009 ; Boumezbeur et al., 2010 ; Dienel, 2012). Il a également été suggéré que l’augmentation de l’activité de la LDH (et, à son tour, la production de lactate) compense simplement l’incapacité de la MAS à suivre le rythme de la demande cytosolique en NAD+ (Schantz, 1986). Dans les neurones, l’activation par le Ca+2 du MAS et du cycle TCA est compétitive, de sorte que de faibles niveaux de Ca+2 stimulent l’activité du MAS en activant le transporteur glutamate/aspartate (Contreras et Satrustegui, 2009), tandis que des concentrations plus élevées de Ca+2 activent l’α-cétoglutarate déshydrogénase dans la matrice mitochondriale, limitant l’α-cétoglutarate disponible pour le MAS (Contreras et Satrustegui, 2009). Il est également possible que le lactate soit formé en continu dans le cytosol, indépendamment de l’état métabolique, et que le lactate oxydé au niveau des mitochondries soit couplé au MAS. Dans les mitochondries cardiaques isolées, par exemple, le MAS présente une capacité excédentaire, ce qui suggère que l’activité du MAS est suffisante pour maintenir la régénération du NAD+ cytosolique (Digerness et Reddy, 1976). Pourquoi, alors, au repos et dans des conditions totalement aérobies, du lactate serait-il produit pendant la glycolyse, si tout le pyruvate devrait aller vers les mitochondries pour la phosphorylation oxydative, et si le MAS devrait régénérer suffisamment de NAD+ ?
Glycolyse (an)aérobie conventionnelle
L’apparition et la disparition du lactate pendant des états métaboliques variables a été un sujet de beaucoup de conjectures historiques, de controverses et d’intrigues. Il y a eu de nombreuses revues de la littérature examinant le métabolisme du lactate, vers lesquelles les lecteurs peuvent être dirigés. Parmi les plus récentes, citons (Cruz et al., 2012 ; Dienel, 2012 ; Kitaoka et al., 2012 ; Doherty et Cleveland, 2013 ; Newington et al., 2013 ; Brooks, 2014 ; Schurr, 2014 ; Todd, 2014). Malheureusement, de nombreux manuels contemporains utilisent encore le sort métabolique du pyruvate pour distinguer deux types de glycolyse : aérobie (c’est-à-dire nécessitant de l’oxygène) et anaérobie (c’est-à-dire sans oxygène). En présence d’oxygène, on a dit que le pyruvate se dirigeait vers les mitochondries pour y mourir métaboliquement par phosphorylation oxydative, le résultat net étant la resynthèse mitochondriale d’ATP et la consommation d’oxygène (c’est-à-dire la respiration) (Voet et al., 2011). À l’inverse, lorsque l’oxygène est limité, le pyruvate est réduit en lactate dans le cytosol par la LDH, oxydant son cofacteur NADH au cours du processus (Voet et al., 2011). Un problème avec cette construction traditionnelle est qu’elle ne se concilie pas bien avec certaines observations scientifiques récurrentes. Par exemple, il est bien établi que le lactate est produit, et consommé, dans des conditions totalement aérobies. En effet, chez des individus normoxiques en bonne santé, au repos dans un état postabsorptif, on peut s’attendre à ce qu’environ 50 μmol-min-1 de lactate soient libérés par le cerveau seul (van Hall et al., 2009 ; van Hall, 2010). Il est clair que le lactate est plus qu’un métabolite de déchets sans issue de la glycolyse anaérobie ; plutôt, la navette du lactate dans tout l’organisme fournit une perspective utile pour interpréter l’observation expérimentale.
Deux concepts de navette du lactate ont été avancés qui décrivent le mouvement et l’utilisation du lactate dans et entre les cellules (Brooks, 1998). L’hypothèse de la navette intracellulaire du lactate postule que le lactate formé pendant la glycolyse peut être continuellement utilisé comme source d’énergie à l’intérieur de la même cellule (Brooks, 1998). La navette intercellulaire ou cellule-cellule du lactate implique que le lactate généré et exporté d’une cellule est pris et utilisé par une autre cellule (Brooks, 1998). La navette lactate cellule-cellule est généralement acceptée, mais les détails plus fins de la navette lactate intracellulaire continuent d’être étudiés. Récemment, nous avons démontré une association à la fois physique et fonctionnelle de la LDH avec les mitochondries dans le muscle squelettique (Elustondo et al., 2013). En utilisant la microscopie confocale à balayage laser, nous avons confirmé la colocalisation de la LDH avec les protéines de la membrane mitochondriale dans le muscle squelettique du rat. Nous avons constaté que les mitochondries des fibres musculaires squelettiques de rats perméabilisées à la saponine oxydaient le lactate en présence de NAD+, de malate et d’ADP (Elustondo et al., 2013) ; un autre groupe a fait le même constat sur des fibres humaines (Jacobs et al., 2013). Le pyruvate est ensuite transporté dans les mitochondries où il est encore oxydé par la pyruvate déshydrogénase (PDH), puis par le cycle TCA, les équivalents réducteurs stimulant la respiration (Elustondo et al., 2013 ; Jacobs et al., 2013). Nous avons été en mesure d’inhiber la respiration avec seulement 5μM d’alpha-cyano-hydroxycinnamate, un inhibiteur du transport mitochondrial du pyruvate, ce qui confirme que le pyruvate, mais pas le lactate, est transporté dans la matrice mitochondriale. Ces résultats confirment que la LDH est stratégiquement positionnée pour interagir fonctionnellement avec les mitochondries, et suggèrent que l’oxydation du lactate se produit près de la surface externe de la membrane mitochondriale interne. Comment une navette intracellulaire de lactate pourrait-elle fonctionner dans une cellule intacte ? Revenons au MAS.
En vivo, le NAD+ cytosolique pourrait, en théorie, être régénéré par la malate déshydrogénase en dehors de la matrice mitochondriale, dans le cadre du MAS. La littérature donne un aperçu des différents tissus et de leurs activités de navette mitochondriale. Dans le cerveau, le MAS a été considéré comme le système de navette le plus important pour amener le NADH cytosolique dans les mitochondries (McKenna et al., 2006, et références) ; inversement, la navette glycérol-phosphate semble être de moindre importance (Nguyen et al., 2003). En effet, l’association intime du MAS et de la biosynthèse du glutamate, un neurotransmetteur, a été signalée (Palaiologos et al., 1988). Les activités publiées du MAS mesurées dans des mitochondries isolées du cerveau de rat sont de l’ordre de 26,7 nmol-min-1-mg-1 (Pardo et al., 2006). Dans les synaptosomes, l’inhibition pharmacologique du MAS entraîne une diminution prononcée (i.e. 50%) de l’oxydation du lactate (McKenna et al., 1993), soutenant le modèle illustré dans la Figure 1. La production intracérébrale de lactate à partir de glucose marqué au 13C soutient en outre l’idée que le lactate est un carburant important pour les neurones (Sampol et al., 2013).
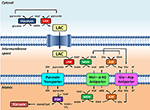
Figure 1. Représentation schématique du lien entre la glycolyse et l’oxydation du lactate au niveau de la mitochondrie exposée dans cette Perspective. Globalement, la glycolyse produit du pyruvate et du NADH, en plus de l’ATP. Le NAD+ peut être régénéré pour la glycolyse par la réduction du pyruvate en lactate (LAC) par la lactate déshydrogénase (LDH). Le LAC peut se diffuser vers les mitochondries où il est oxydé en pyruvate par la LDH. Le NAD+ est régénéré par la malate déshydrogénase (MDH) extra-matricielle de la navette malate-aspartate. Le pyruvate est ensuite transporté à travers la membrane mitochondriale interne vers la matrice, où il est ensuite oxydé par la pyruvate déshydrogénase (PDH) en acétyl CoA. Abréviations : α-KG, alpha-cétoglutarate ; Glu, glutamate ; AAT, aspartate-aminotransférase ; OAA, oxaloacétate ; Mal, malate.
Il faut noter que le MAS peut avoir ses limites. À des charges de travail cardiaques élevées, il a été démontré que le transporteur α-cétoglutarate/malate de la membrane mitochondriale interne ne peut pas rivaliser avec l’α-cétoglutarate déshydrogénase matricielle pour leur substrat partagé, l’α-cétoglutarate (O’Donnell et al., 2004). Il en résulte un effet limitant pour la MAS et son transfert de NADH dans les mitochondries. L’effet net de cette limitation du MAS serait une augmentation de la concentration de lactate cytosolique car la régénération du NAD+ par la réaction LDH aiderait à préserver le NAD+/NADH homéostatique, même en présence d’oxygène adéquat. En effet, c’est le phénomène classique observé lors d’un exercice particulièrement intense où le lactate peut s’accumuler dans le sang, malgré une disponibilité adéquate d’oxygène.
La notion de navette de composés entre la mitochondrie et le cytosol pour répondre aux demandes énergétiques de la cellule en utilisant des enzymes proches de l’équilibre n’est certainement pas nouvelle. La navette phosphocréatine (PCr) fait appel à des isoformes distinctes de créatine kinase (CK) mitochondriale et cytosolique pour transporter essentiellement le phosphate « haute énergie » de la mitochondrie au cytosol. Comme la réaction de la LDH, la réaction de la CK (phosphocréatine + ADP + H+ ⇌ créatine + ATP), est considérée comme étant « proche de l’équilibre », favorisant la resynthèse de l’ATP. Cependant, des preuves expérimentales démontrent que dans les cellules myocardiques, seule la CK cytosolique est réellement à l’équilibre, ou presque (revue dans Joubert et al., 2004). En revanche, la CK mitochondriale, localisée dans l’espace intermembranaire, n’est pas à l’équilibre, ce qui favorise la resynthèse nette de PCr. Par analogie, on pense que deux populations distinctes de LDH sont impliquées dans la navette intracellulaire du lactate : cytosolique et mitochondriale. La LDH cytosolique serait à l’équilibre ou proche de l’équilibre, tandis que la LDH mitochondriale serait déplacée de l’équilibre. La LDH cytosolique favoriserait la production nette de lactate, tandis que la LDH mitochondriale favoriserait l’oxydation du lactate. Et tout comme l’adénine nucléotide translocase (ANT), qui transporte l’ADP dans la matrice à travers la membrane mitochondriale interne en échange d’ATP, facilite le déplacement de l’équilibre pour le CK mitochondrial dans l’espace intermembranaire, le transporteur de pyruvate transporterait continuellement le pyruvate, déplaçant la réaction LDH mitochondriale de l’équilibre (Figure 1). Une telle navette de lactate bénéficierait de la localisation de la LDH dans l’espace intermembranaire près de la membrane mitochondriale interne, liée à l’extérieur de la membrane mitochondriale externe aux sites de contact de la membrane mitochondriale externe et interne, ou les deux. Si l’oxydation intracellulaire du lactate doit se produire au niveau des mitochondries par compartimentation, comme pour la navette PCr, la localisation cellulaire de la LDH dans, sur ou autour des mitochondries serait une caractéristique saillante.
Un corpus riche et croissant de recherches neuroénergétiques soutient également l’existence d’un métabolisme du lactate compartimenté entre les cellules cérébrales voisines – à savoir, les astrocytes et les neurones (revue dans Pellerin et Magistretti, 2012). Une variante de la navette intercellulaire de lactate généralement (Brooks, 2009), la navette de lactate astrocyte-neurone (Pellerin et Magistretti, 2012) est basée sur l’idée que les astrocytes sont principalement glycolytiques, tandis que les neurones sont plus oxydatifs (Bouzier-Sore et Pellerin, 2013 et références). En utilisant une approche de modélisation métabolique, il a été soutenu qu’un flux métabolique plus important à travers la PDH et les navettes NADH mitochondriales dans les neurones par rapport aux astrocytes dicte nécessairement la libération nette de lactate par les astrocytes et l’oxydation par les neurones (Neves et al.2012), soutenant de nombreuses observations expérimentales (revues dans Bouzier-Sore et Pellerin, 2013). Comme mentionné précédemment, le MAS constitue la principale navette mitochondriale du NADH dans les neurones matures (Kauppinen et al., 1987 ; Ramos et al., 2003 ; Contreras et Satrustegui, 2009 ; Gellerich et al., 2012). Par conséquent, une caractéristique importante du neurone consommateur de lactate pourrait bien être son activité MAS élevée (Neves et al., 2012). L’heure est-elle venue d’une navette lactate-malate-aspartate ? Y a-t-il un soutien théorique supplémentaire pour un tel modèle dans lequel le lactate sert d’équivalent réducteur ?
Régénération du NAD+ cytosolique
L’oxydation du lactate au niveau de la mitochondrie donne encore plus de sens à la glycolyse aérobie en permettant la régénération du NAD+ cytosolique par la LDH cytosolique. En effet, les données recueillies sur des cellules en culture indiquent que le rapport lactate/pyruvate est très labile et qu’il varie pour préserver le rapport homéostatique NAD+/NADH (Sun et al., 2012). Cela serait avantageux pour la cellule pour un certain nombre de raisons. Premièrement, cela fournirait un moyen immédiat de régénérer le NAD+ localement (c’est-à-dire dans le cytosol, où se produit la glycolyse) ; la plus grande diffusabilité relative du lactate (poids moléculaire = 89,07 g/mol) par rapport au NAD+ (poids moléculaire = 663,43 g/mol) signifie que le lactate peut facilement diffuser hors de la cellule dans des conditions de flux glycolytique accru (par exemple, exercice intense, stress hypoxique), tout en étant dirigé vers les mitochondries. Pendant les périodes de demande d’énergie cellulaire réduite, la production continue de lactate pendant des taux beaucoup plus faibles de flux glycolytique serait encore utilisée pour maintenir le NAD+/NADH homéostatique à l’intérieur de la cellule, ainsi que pour le couplage continu de la navette de lactate intracellulaire au MAS.
Nutation des protons et transport mitochondrial des substrats
L’oxydation du lactate au niveau de la mitochondrie donne un sens à la glycolyse aérobie car la production de lactate dans le cytosol consomme effectivement un proton (Robergs et al, 2004), ce qui contribuerait à atténuer l’acidose métabolique associée à un renouvellement accru de l’ATP et à des taux élevés de glycolyse (Robergs et al., 2004). La concentration cytosolique de lactate dépasse généralement celle du pyruvate d’au moins 10 fois, ce qui signifie que le lactate, et non le pyruvate, est le monocarboxylate prédominant qui entre dans l’espace intermembranaire des mitochondries (Brooks et al., 1999). En oxydant le lactate dans l’espace intermembranaire mitochondrial, des protons seraient libérés où ils pourraient contribuer à la composante ΔpH de la force motrice protonique mitochondriale à travers la membrane interne (Santo-Domingo et Demaurex, 2012), et/ou être transportés indirectement dans la mitochondrie par le MAS. Comme pour le transport du phosphate inorganique et de certains autres substrats et ions (Santo-Domingo et Demaurex, 2012), le transport du pyruvate par les transporteurs à travers la membrane mitochondriale interne dans les mitochondries de foie de rat semble être directement couplé à un symport de protons (ou antiport OH-) (Papa et al., 1971 ; Halestrap, 1975). L’oxydation du lactate près de la surface externe de la membrane mitochondriale interne, qui libère un proton, contribuerait au ΔpH, et à son tour, au transport du pyruvate dans la matrice. Au voisinage de la membrane mitochondriale interne, le rapport d’action de masse de la LDH (c’est-à-dire les concentrations de produits/concentrations de réactions) pourrait être largement facilité par la « purge » du pyruvate lors de son transport continu à travers la membrane mitochondriale interne imperméable au lactate, ainsi que par une régénération généreuse de NAD+ par la malate déshydrogénase extra-matrice du MAS. Dans ce modèle, le transport du pyruvate à travers la membrane mitochondriale interne influencerait directement le taux d’oxydation du lactate juste à l’extérieur de la matrice. On s’attendrait donc à ce que l’oxydation du lactate au niveau des mitochondries soit régulée indirectement au niveau de la réaction PDH dans la matrice. Cela serait avantageux car, contrairement à la LDH, la PDH est fortement régulée par l’allostérie et la modification covalente. Comme mentionné, la modélisation prédit qu’une activité PDH élevée dicte la consommation de lactate neuronale in vivo (Neves et al., 2012) ; et une activité PDH élevée caractérise également les neurones consommateurs de lactate en culture (Halim et al…, 2010).
Considérations méthodologiques
Si l’oxydation mitochondriale du lactate est fonctionnellement liée à l’activité de la MAS, il serait alors important d’inclure des composants de la MAS dans les analyses in vitro de l’oxydation mitochondriale du lactate, comme le malate lui-même ou l’oxaloacétate. Le malate est le choix probable, car il est couramment inclus pour stimuler la respiration in vitro, où il est transporté dans la matrice et oxydé par la malate déshydrogénase mitochondriale en oxaloacétate. Cet oxaloacétate peut ensuite se condenser avec l’acétyl coA formé, par exemple, lorsque du pyruvate est ajouté. L’inclusion du glutamate en plus du malate, permet le fonctionnement complet du MAS au niveau de la respiration mitochondriale. Un aspect important, mais parfois négligé, de l’évaluation appropriée de l’oxydation mitochondriale du lactate est l’inclusion de NAD+ comme cofacteur requis pour la réaction LDH, et d’ADP comme accepteur de phosphate pour stimuler la phosphorylation oxydative (c’est-à-dire la respiration d’état 3). En outre, la composante extra-matricielle du MAS implique la réaction de la malate déshydrogénase : oxaloacétate + NADH + H+ ⇌ malate + NAD+. Les protocoles expérimentaux examinant la consommation d’oxygène respiratoire dans les mitochondries isolées du muscle en utilisant des concentrations élevées de malate (par exemple, 4 mM ; Rasmussen et al., 2002), peuvent favoriser la réaction de la malate déshydrogénase dans le sens inverse (c’est-à-dire l’oxydation du malate et la production de NADH + H+) lorsqu’elle est ajoutée à l’échantillon mitochondrial en combinaison avec du NAD+. En effet, la réversibilité de la MAS a été observée dans des hépatocytes isolés (Berry, 1971) et des mitochondries avec une MAS reconstituée (Kunz et Davis, 1991). L’effet net de cette inversion du MAS sur la respiration serait de réduire l’entrée du malate dans la mitochondrie, formant ainsi de l’oxaloacétate. Plus important encore, l’inversion empêcherait l’oxydation du lactate en pyruvate, puis le transport et l’oxydation du pyruvate dans la matrice. Les solutions à ces barrières méthodologiques pour observer l’oxydation mitochondriale du lactate in vitro impliquent d’inclure au moins un composant du MAS. Si l’on ajoute du malate, la concentration appropriée doit être déterminée expérimentalement. L’inclusion d’ADP et de NAD+ ou de NADH (rappelons que le MAS générera du NAD+ pour la réaction LDH) est également nécessaire pour observer une oxydation mitochondriale appréciable du lactate.
Résumé
Un lactate-MAS est l’interaction entre les navettes lactate et malate-aspartate pour transloquer le pouvoir réducteur vers les mitochondries, en particulier au sein des cellules oxydatives et métaboliquement actives.
Déclaration de conflit d’intérêts
L’auteur déclare que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Moyens remerciements au Dr Erich Gnaiger (Université médicale d’Innsbruck), et au Dr George Brooks (Université de Californie, Berkeley) pour avoir chacun critiqué des versions antérieures de ce travail.
Barros, L. F. (2013). Signalisation métabolique par le lactate dans le cerveau. Trends Neurosci. 36, 396-404. doi : 10.1016/j.tins.2013.04.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bergman, B. C., Wolfel, E. E., Butterfield, G. E., Lopaschuk, G. D., Casazza, G. A., Horning, M. A., et al. (1999). Active muscle and whole body lactate kinetics after endurance training in men. J. Appl. Physiol. (1985) 87, 1684-1696.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Berry, M. N. (1971). Réduction énergétiquement dépendante du pyruvate en lactate par les cellules parenchymateuses isolées intactes du foie de rat. Biochem. Biophys. Res. Commun. 44, 1449-1456. doi : 10.1016/S0006-291X(71)80248-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Boumezbeur, F., Petersen, K. F., Cline, G. W., Mason, G. F., Behar, K. L., Shulman, G. I., et al. (2010). The contribution of blood lactate to brain energy metabolism in humans measured by dynamic 13C nuclear magnetic resonance spectroscopy. J. Neurosci. 30, 13983-13991. doi : 10.1523/JNEUROSCI.2040-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., et Pellerin, L. (2013). Dévoiler la nature métabolique complexe des astrocytes. Front. Cell. Neurosci. 7:179. doi : 10.3389/fncel.2013.00179
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., Voisin, P., Bouchaud, V., Bezancon, E., Franconi, J. M., et Pellerin, L. (2006). Competition between glucose and lactate as oxidative energy substrates in both neurons and astrocytes : a comparative NMR study. Eur. J. Neurosci. 24, 1687-1694. doi : 10.1111/j.1460-9568.2006.05056.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (1998). Utilisation du carburant des mammifères pendant un exercice soutenu. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 120, 89-107. doi : 10.1016/S0305-0491(98)00025-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2009). Les navettes cellule-cellule et intracellulaire du lactate. J. Physiol. 587, 5591-5600. doi : 10.1113/jphysiol.2009.178350
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2014). » Systèmes métaboliques : la formation et l’utilisation du lactate « , dans History of Exercise Physiology. Human Kinetics, ed C. M. Tipton (Champaign, IL : Human Kinetics), 447-475.
Google Scholar
Brooks, G. A., Butterfield, G. E., Wolfe, R. R., Groves, B. M., Mazzeo, R. S., Sutton, J. R., et al. (1991). Decreased reliance on lactate during exercise after acclimatization to 4,300 m. J. Appl. Physiol. (1985). 71, 333-341.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Brooks, G. A., Dubouchaud, H., Brown, M., Sicurello, J. P., et Butz, C. E. (1999). Rôle de la lactate déshydrogénase mitochondriale et de l’oxydation du lactate dans la navette intracellulaire du lactate. Proc. Natl. Acad. Sci. U.S.A. 96, 1129-1134. doi : 10.1073/pnas.96.3.1129
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Chatham, J. C., Des Rosiers, C., et Forder, J. R. (2001). Preuve de voies distinctes pour l’absorption et la libération du lactate par le cœur de rat perfusé. Am. J. Physiol. Endocrinol. Metab. 281, E794-E802.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Contreras, L., et Satrustegui, J. (2009). La signalisation du calcium dans les mitochondries du cerveau : interaction des voies de la navette malate aspartate NADH et de l’uniporteur de calcium / déshydrogénase mitochondriale. J. Biol. Chem. 284, 7091-7099. doi : 10.1074/jbc.M808066200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Crabtree, B., et Newsholme, E. A. (1978). Sensibilité d’une réaction proche de l’équilibre dans une voie métabolique aux changements de concentration du substrat. Eur. J. Biochem. 89, 19-22. doi : 10.1111/j.1432-1033.1978.tb20891.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Cruz, R. S., de Aguiar, R. A., Turnes, T., Penteado Dos Santos, R., de Oliveira, M. F., et Caputo, F. (2012). La navette intracellulaire : le métabolisme aérobie du lactate. ScientificWorldJournal 2012:420984. doi : 10.1100/2012/420984
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Dienel, G. A. (2012). Le métabolisme du lactate cérébral : les découvertes et les controverses. J. Cereb. Blood Flow Metab. 32, 1107-1138. doi : 10.1038/jcbfm.2011.175
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Digerness, S. B., et Reddy, W. J. (1976). La navette malate-aspartate dans les mitochondries du cœur. J. Mol. Cell. Cardiol. 8, 779-785. doi : 10.1016/0022-2828(76)90084-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Doherty, J. R., et Cleveland, J. L. (2013). Cibler le métabolisme du lactate pour la thérapeutique du cancer. J. Clin. Invest. 123, 3685-3692. doi : 10.1172/JCI69741
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Donovan, C. M., et Pagliassotti, M. J. (2000). Évaluation quantitative des voies d’élimination du lactate dans les types de fibres musculaires squelettiques. Med. Sci. Sports Exerc. 32, 772-777. doi : 10.1097/00005768-200004000-00009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Elustondo, P. A., White, A. E., Hughes, M. E., Brebner, K., Pavlov, E., et Kane, D. A. (2013). Association physique et fonctionnelle de la lactate déshydrogénase (LDH) avec les mitochondries des muscles squelettiques. J. Biol. Chem. 288, 25309-25317. doi : 10.1074/jbc.M113.476648
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Funfschilling, U., Supplie, L. M., Mahad, D., Boretius, S., Saab, A. S., Edgar, J., et al. (2012). Les oligodendrocytes glycolytiques maintiennent la myéline et l’intégrité axonale à long terme. Nature 485, 517-521. doi : 10.1038/nature11007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Gainutdinov, T., Muth, K., Seppet, E., Orynbayeva, Z., et al. (2013). Le contrôle de l’énergisation mitochondriale du cerveau par le calcium cytosolique : la pédale d’accélération mitochondriale. IUBMB Life 65, 180-190. doi : 10.1002/iub.1131
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Trumbekaite, S., Korzeniewski, B., Gaynutdinov, T., Seppet, E., et al. (2012). Le Ca2+ cytosolique régule l’énergisation des mitochondries isolées du cerveau par la formation de pyruvate par la navette malate-aspartate. Biochem. J. 443, 747-755. doi : 10.1042/BJ20110765
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gertz, E. W., Wisneski, J. A., Stanley, W. C., et Neese, R. A. (1988). Utilisation du substrat myocardique pendant l’exercice chez l’homme. Dual carbon-labeled carbohydrate isotope experiments. J. Clin. Invest. 82, 2017-2025. doi : 10.1172/JCI113822
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2004). Le métabolisme du lactate : un nouveau paradigme pour le troisième millénaire. J. Physiol. 558, 5-30. doi : 10.1113/jphysiol.2003.058701
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2007). Existe-t-il une navette intracellulaire du lactate dans le muscle squelettique ? J. Physiol. 582, 899. doi : 10.1113/jphysiol.2007.138487
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Halestrap, A. P. (1975). Le transporteur de pyruvate mitochondrial. Cinétique et spécificité pour les substrats et les inhibiteurs. Biochem. J. 148, 85-96.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Halim, N. D., McFate, T., Mohyeldin, A., Okagaki, P., Korotchkina, L. G., Patel, M. S., et al. (2010). Le statut de phosphorylation de la pyruvate déshydrogénase distingue les phénotypes métaboliques des astrocytes et des neurones du cerveau de rat en culture. Glia 58, 1168-1176. doi : 10.1002/glia.20996
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Jacobs, R. A., Meinild, A. K., Nordsborg, N. B., et Lundby, C. (2013). L’oxydation du lactate dans les mitochondries des muscles squelettiques humains. Am. J. Physiol. Endocrinol. Metab. 304, E686-E689. doi : 10.1152/ajpendo.00476.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Joubert, F., Mateo, P., Gillet, B., Beloeil, J. C., Mazet, J. L., et Hoerter, J. A. (2004). CK flux or direct ATP transfer : versatility of energy transfer pathways evidenced by NMR in the perfused heart. Mol. Cell. Biochem. 256-257, 43-58. doi : 10.1023/B:MCBI.0000009858.41434.fc
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kauppinen, R. A., Sihra, T. S., et Nicholls, D. G. (1987). L’acide amino-oxyacétique inhibe la navette malate-aspartate dans les terminaux nerveux isolés et empêche les mitochondries d’utiliser les substrats glycolytiques. Biochim. Biophys. Acta 930, 173-178. doi : 10.1016/0167-4889(87)90029-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kitaoka, Y., Hoshino, D., et Hatta, H. (2012). Transporteur de monocarboxylate et métabolisme du lactate. J. Phys. Fitness Sports Med. 1, 247-252. doi : 10.7600/jpfsm.1.247
CrossRef Full Text | Google Scholar
Kline, E. S., Brandt, R. B., Laux, J. E., Spainhour, S. E., Higgins, E. S., Rogers, K. S., et al. (1986). Localisation de la L-lactate déshydrogénase dans les mitochondries. Arch. Biochem. Biophys. 246, 673-680. doi : 10.1016/0003-9861(86)90323-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kunz, W. S., et Davis, E. J. (1991). Contrôle du transfert intracellulaire réversible du potentiel réducteur. Arch. Biochem. Biophys. 284, 40-46. doi : 10.1016/0003-9861(91)90260-P
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Luft, F. C. (2001). Mise à jour sur l’acidose lactique pour les cliniciens en soins intensifs. J. Am. Soc. Nephrol. 12 Suppl 17 : S15-S19.
Pubmed Abstract | Pubmed Full Text | Google Scholar
McKenna, M. C., Tildon, J. T., Stevenson, J. H., Boatright, R., and Huang, S. (1993). Régulation du métabolisme énergétique dans les terminaux synaptiques et les astrocytes du cerveau de rat en culture : différences révélées par l’aminooxyacétate. Dev. Neurosci. 15, 320-329. doi : 10.1159/000111351
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
McKenna, M. C., Waagepetersen, H. S., Schousboe, A., et Sonnewald, U. (2006). Mécanismes de navette neuronale et astrocytaire pour le transfert cytosolique-mitochondrial des équivalents réducteurs : preuves actuelles et outils pharmacologiques. Biochem. Pharmacol. 71, 399-407. doi : 10.1016/j.bcp.2005.10.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Neves, A., Costalat, R., et Pellerin, L. (2012). Déterminants des phénotypes métaboliques des cellules du cerveau et de l’utilisation des substrats énergétiques démêlés par une approche de modélisation. PLoS Comput. Biol. 8:e1002686. doi : 10.1371/journal.pcbi.1002686
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Newington, J. T., Harris, R. A., et Cumming, R. C. (2013). Réévaluation du métabolisme dans la maladie d’alzheimer du point de vue du modèle de navette lactate astrocyte-neurone. J. Neurodegener. Dis. 2013, 13. doi : 10.1155/2013/234572
CrossRef Full Text | Google Scholar
Nguyen, N. H., Brathe, A., et Hassel, B. (2003). Absorption et métabolisme neuronaux du glycérol et expression neuronale de la glycérol-3-phosphate déshydrogénase mitochondriale. J. Neurochem. 85, 831-842. doi : 10.1046/j.1471-4159.2003.01762.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
O’Donnell, J. M., Kudej, R. K., LaNoue, K. F., Vatner, S. F., and Lewandowski, E. D. (2004). Limited transfer of cytosolic NADH into mitochondria at high cardiac workload. Am. J. Physiol. Heart Circ. Physiol. 286, H2237-H2242. doi : 10.1152/ajpheart.01113.2003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Palaiologos, G., Hertz, L., et Schousboe, A. (1988). Preuve que l’activité aspartate aminotransférase et la fonction de transporteur de cétodicarboxylate sont essentielles pour la biosynthèse du glutamate transmetteur. J. Neurochem. 51, 317-320. doi : 10.1111/j.1471-4159.1988.tb04872.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Papa, S., Francavilla, A., Paradies, G., et Meduri, B. (1971). Le transport du pyruvate dans les mitochondries du foie de rat. FEBS Lett. 12, 285-288. doi : 10.1016/0014-5793(71)80200-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pardo, B., Contreras, L., Serrano, A., Ramos, M., Kobayashi, K., Iijima, M., et al. (2006). Essential role of aralar in the transduction of small Ca2+ signals to neuronal mitochondria. J. Biol. Chem. 281, 1039-1047. doi : 10.1074/jbc.M507270200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pellerin, L., et Magistretti, P. J. (2012). Sweet sixteen for ANLS. J. Cereb. Blood Flow Metab. 32, 1152-1166. doi : 10.1038/jcbfm.2011.149
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., et Grunnet, N. (2011a). Un lactate cérébral élevé n’est pas causé par un décalage du rapport lactate déshydrogénase A/B. Proc. Natl. Acad. Sci. U.S.A. 108, E21. réponse de l’auteur : E22. doi : 10.1073/pnas.1017750108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., et Grunnet, N. (2011b). Le schéma isoenzyme de la LDH ne joue pas un rôle physiologique ; sauf peut-être lors de transitions rapides du métabolisme énergétique. Aging (Albany, NY) 3, 457-460.
Google Scholar
Quistorff, B., Secher, N. H., et Van Lieshout, J. J. (2008). Le lactate alimente le cerveau humain pendant l’exercice. FASEB J. 22, 3443-3449. doi : 10.1096/fj.08-106104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Ramos, M., del Arco, A., Pardo, B., Martinez-Serrano, A., Martinez-Morales, J. R., Kobayashi, K., et al. (2003). Developmental changes in the Ca2+-regulated mitochondrial aspartate-glutamate carrier aralar1 in brain and prominent expression in the spinal cord. Brain Res. Dev. Brain Res. 143, 33-46. doi : 10.1016/S0165-3806(03)00097-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rasmussen, H. N., van Hall, G., et Rasmussen, U. F. (2002). Lactate déshydrogénase n’est pas une enzyme mitochondriale dans le muscle vaste latéral de l’homme et de la souris. J. Physiol. 541, 575-580. doi : 10.1113/jphysiol.2002.019216
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Robergs, R. A., Ghiasvand, F., et Parker, D. (2004). Biochimie de l’acidose métabolique induite par l’exercice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 287, R502-R516. doi : 10.1152/ajpregu.00114.2004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rueda, C. B., Llorente-Folch, I., Amigo, I., Contreras, L., Gonzalez-Sanchez, P., Martinez-Valero, P., et al. (2014). Régulation par le Ca2+ de la fonction mitochondriale dans les neurones. Biochim. Biophys. Acta 1837, 1617-1624. doi : 10.1016/j.bbabio.2014.04.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Safer, B., Smith, C. M., et Williamson, J. R. (1971). Contrôle du transport des équivalents réducteurs à travers la membrane mitochondriale dans le cœur de rat perfusé. J. Mol. Cell. Cardiol. 2, 111-124. doi : 10.1016/0022-2828(71)90065-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sampol, D., Ostrofet, E., Jobin, M. L., Raffard, G., Sanchez, S., Bouchaud, V., et al. (2013). Le métabolisme du glucose et du lactate chez le rat éveillé et stimulé : une étude par (13)C-RMN. Front. Neuroenergetics 5:5. doi : 10.3389/fnene.2013.00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Santo-Domingo, J., et Demaurex, N. (2012). Perspectives sur : Symposium de la SGP sur la physiologie mitochondriale et la médecine : la renaissance du pH mitochondrial. J. Gen. Physiol. 139, 415-423. doi : 10.1085/jgp.201110767
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Schantz, P. G. (1986). Plasticité du muscle squelettique humain avec une référence particulière aux effets de l’entraînement physique sur les niveaux d’enzymes des navettes NADH et l’expression phénotypique des protéines myofibrillaires lentes et rapides. Acta Physiol. Scand. Suppl. 558, 1-62.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Schurr, A. (2014). Glycolyse cérébrale : un siècle de malentendus et d’idées fausses persistantes. Front. Neurosci. 8:360. doi : 10.3389/fnins.2014.00360
CrossRef Full Text | Google Scholar
Schurr, A., West, C. A., et Rigor, B. M. (1988). Fonction synaptique soutenue par le lactate dans la préparation de la tranche d’hippocampe de rat. Science 240, 1326-1328. doi : 10.1126/science.3375817
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Skilleter, D. N., et Kun, E. (1972). L’oxydation du L-lactate par les mitochondries du foie. Arch. Biochem. Biophys. 152, 92-104. doi : 10.1016/0003-9861(72)90197-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Spriet, L. L., Howlett, R. A., and Heigenhauser, G. J. (2000). Une approche enzymatique de la production de lactate dans le muscle squelettique humain pendant l’exercice. Med. Sci. Sports Exerc. 32, 756-763. doi : 10.1097/00005768-200004000-00007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Stainsby, W. N., and Brooks, G. A. (1990). Contrôle du métabolisme de l’acide lactique dans les muscles contractants et pendant l’exercice. Exerc. Sport Sci. Rev. 18, 29-63. doi : 10.1249/00003677-199001000-00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sun, F., Dai, C., Xie, J., et Hu, X. (2012). Questions biochimiques dans l’estimation du rapport NAD/NADH libre cytosolique. PLoS ONE 7:e34525. doi : 10.1371/journal.pone.0034525
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Todd, J. J. (2014). Le lactate : précieux pour la performance physique et le maintien de la fonction cérébrale pendant l’exercice. Biosci. Horiz. 7, 1-7. doi : 10.1093/biohorizons/hzu001
CrossRef Full Text | Google Scholar
van Hall, G. (2010). Cinétique du lactate dans les tissus humains au repos et pendant l’exercice. Acta Physiol. (Oxf.) 199, 499-508. doi : 10.1111/j.1748-1716.2010.02122.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
van Hall, G., Stromstad, M., Rasmussen, P., Jans, O., Zaar, M., Gam, C., et al. (2009). Le lactate sanguin est une source d’énergie importante pour le cerveau humain. J. Cereb. Blood Flow Metab. 29, 1121-1129. doi : 10.1038/jcbfm.2009.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Voet, D., Voet, J. G., et Pratt, C. W. (2011). Principes fondamentaux de la biochimie : La vie au niveau moléculaire. Hoboken, NJ : Wiley.
Google Scholar
Williamson, D. H., Lund, P., et Krebs, H. A. (1967). L’état redox du nicotinamide-adénine dinucléotide libre dans le cytoplasme et les mitochondries du foie de rat. Biochem. J. 103, 514-527.
Pubmed Abstract | Pubmed Full Text | Google Scholar
.