- Einführung: Laktat-Dehydrogenase-Reaktion
- Das Malat-Aspartat-Shuttle
- Konventionelle (an)aerobe Glykolyse
- Das Laktat-Shuttle-Konzept
- Intrazelluläre Kompartmentalisierung der LDH: Lehren aus dem Phosphokreatin-Shuttle
- Interzelluläre Kompartmentalisierung des Laktatstoffwechsels: das Astrozyten-Neuronen-Laktat-Shuttle
- Regeneration von zytosolischem NAD+
- Protonen-Shuttling und mitochondrialer Substrattransport
- Methodische Überlegungen
- Zusammenfassung
- Erklärung zu Interessenkonflikten
- Danksagung
Einführung: Laktat-Dehydrogenase-Reaktion
Die Reduktion von Pyruvat zu Laktat, katalysiert durch Laktat-Dehydrogenase (LDH; Pyruvat + NADH + H+ ⇌ Laktat + NAD+) im Zytosol vieler Zellen, wurde als metabolische „Sackgasse“ angesehen (Luft, 2001; Quistorff und Grunnet, 2011a), oder vielleicht noch treffender, eine metabolische Sackgasse (Barros, 2013), da Laktat nur über Pyruvat wieder in das metabolische Netzwerk eintreten kann. Bei Säugetieren gilt die LDH-Reaktion auch als „nahezu gleichgewichtig“ (Spriet et al., 2000; Quistorff und Grunnet, 2011a,b), was bedeutet, dass die Reaktion hauptsächlich durch die Konzentrationen ihrer Reaktanten und Produkte reguliert wird und nicht durch ausgefeiltere Mittel der allosterischen Regulation oder kovalenten Modifikation (Crabtree und Newsholme, 1978). Da das Gleichgewicht für die LDH-Reaktion weit rechts liegt (d. h. die Laktatbildung wird begünstigt) (Williamson et al., 1967), unabhängig von der LDH-Isoform (Quistorff und Grunnet, 2011a,b), könnte dies bedeuten, dass LDH in vivo selten die umgekehrte Reaktion (d. h. die Laktatoxidation) begünstigt. In der Tat müsste das für eine nennenswerte Laktatoxidation erforderliche Massenwirkungsverhältnis (/) die Gleichgewichtskonstante für LDH übersteigen. Experimentelle Belege widerlegen jedoch zunehmend die Annahme, dass LDH in vivo nur in eine Richtung funktioniert, und belegen, dass Laktat als wichtiger Stoffwechselbrennstoff für viele Gewebe, einschließlich des Skeletts, dient (Brooks et al., 1991; Bergman et al., 1999; Donovan und Pagliassotti, 2000) und Herzmuskel (Gertz et al., 1988; Chatham et al., 2001), Leber (Skilleter und Kun, 1972; Kline et al., 1986) und Gehirn (Schurr et al., 1988; Bouzier-Sore et al., 2006; Wyss et al., 2011; Funfschilling et al., 2012; zusammengefasst in Barros, 2013). In der vorliegenden Perspektive soll ein Modell vorgestellt werden, in dem Laktat eine zentrale Rolle bei der Verlagerung von energetischen Substraten zwischen dem Zytosol (Glykolyse) und den Mitochondrien (oxidative Phosphorylierung) spielt. Bestandteile eines solchen Konzepts wurden am Herzen (Safer et al., 1971) und an der Skelettmuskulatur (Schantz, 1986) nachgewiesen, später zu einer Laktat-Shuttle-Perspektive erweitert (Stainsby und Brooks, 1990; Brooks et al., 1999) und umfassend überprüft (Gladden, 2004) und erneut kommentiert (Gladden, 2007). Das Konzept wird insbesondere durch neuere Forschungen an neuronalen Zellen unterstützt (Gellerich et al., 2012, 2013; Rueda et al., 2014). Das in der vorliegenden Perspektive skizzierte Konzept ist zwar nicht per se neu (Safer et al., 1971), aber der offensichtliche Mangel an konventioneller Anerkennung oder Akzeptanz seiner theoretischen Grundlagen verdient weitere Aufmerksamkeit.
Das Malat-Aspartat-Shuttle
Da die innere Mitochondrienmembran für NAD+ und NADH undurchlässig ist, hängt das durch Glykolyse unter aeroben Bedingungen erzeugte NADH vom indirekten Transfer reduzierender Äquivalente in die Mitochondrien über das Malat-Aspartat-Shuttle (MAS) und das Glycerin-Phosphat-Shuttle ab. Es wird angenommen, dass diese Shuttles auch das zytosolische NAD+ regenerieren, das zur Unterstützung des glykolytischen Flusses bei der NAD+-fordernden Glyceraldehyd-3-Phosphat-Dehydrogenase-Reaktion erforderlich ist. Die MAS ist nachweislich das vorherrschende Mittel, mit dem dies in den meisten oxidativen Geweben geschieht, und scheint das wichtigste NADH-Shuttle in reifen Neuronen zu sein (Kauppinen et al., 1987; Ramos et al., 2003; Contreras und Satrustegui, 2009; Gellerich et al., 2012). Es ist auch bekannt, dass unter Bedingungen mit erhöhtem zellulärem Energiebedarf und/oder erhöhtem glykolytischem Fluss (z. B. bei anstrengender körperlicher Betätigung) sowie bei Hypoxie die Laktatkonzentration ansteigt, da die LDH-Reaktion erhöhte Raten der zytosolischen NAD+-Regeneration ermöglicht (Robergs et al., 2004). Im Gehirn führt eine Erhöhung der Laktatkonzentration im Blutkreislauf (z. B. bei sportlicher Betätigung) jedoch zu einer Steigerung der Laktatentsorgung im Gehirn (Quistorff et al., 2008; van Hall et al., 2009; Boumezbeur et al., 2010; Dienel, 2012). Es wurde auch vermutet, dass die erhöhte LDH-Aktivität (und damit die Laktatproduktion) einfach die Unfähigkeit der MAS kompensiert, mit dem zytosolischen NAD+-Bedarf Schritt zu halten (Schantz, 1986). In Neuronen sind die Ca+2-Aktivierung der MAS und des TCA-Zyklus konkurrierend, so dass niedrigere Ca+2-Konzentrationen die MAS-Aktivität durch Aktivierung des Glutamat/Aspartat-Trägers stimulieren (Contreras und Satrustegui, 2009), während höhere Ca+2-Konzentrationen die α-Ketoglutarat-Dehydrogenase in der mitochondrialen Matrix aktivieren und damit das für die MAS verfügbare α-Ketoglutarat begrenzen (Contreras und Satrustegui, 2009). Es ist auch möglich, dass Laktat kontinuierlich im Zytosol gebildet wird, unabhängig vom Stoffwechselzustand, und dass das in den Mitochondrien oxidierte Laktat an die MAS gekoppelt ist. In isolierten Herzmitochondrien beispielsweise weist die MAS eine Überkapazität auf, was darauf schließen lässt, dass die MAS-Aktivität allein ausreicht, um die zytosolische NAD+-Regeneration aufrechtzuerhalten (Digerness und Reddy, 1976). Warum sollte dann in Ruhe und unter vollständig aeroben Bedingungen während der Glykolyse Laktat gebildet werden, wenn das gesamte Pyruvat zur oxidativen Phosphorylierung in die Mitochondrien gelangt und die MAS ausreichend NAD+ regeneriert?
Konventionelle (an)aerobe Glykolyse
Das Auftreten und Verschwinden von Laktat während unterschiedlicher Stoffwechselzustände ist ein Thema, das in der Vergangenheit häufig Gegenstand von Vermutungen, Kontroversen und Intrigen war. Es gibt zahlreiche Literaturübersichten über den Laktatstoffwechsel, auf die der Leser verwiesen werden kann. Einige der neueren Arbeiten sind (Cruz et al., 2012; Dienel, 2012; Kitaoka et al., 2012; Doherty und Cleveland, 2013; Newington et al., 2013; Brooks, 2014; Schurr, 2014; Todd, 2014). Leider wird in vielen zeitgenössischen Lehrbüchern immer noch das metabolische Schicksal von Pyruvat verwendet, um zwei Arten der Glykolyse zu unterscheiden: aerob (d. h. mit Sauerstoff) und anaerob (d. h. ohne Sauerstoff). Bei Vorhandensein von Sauerstoff wird Pyruvat zu den Mitochondrien transportiert, um dort durch oxidative Phosphorylierung sein metabolisches Ende zu finden, was zu einer mitochondrialen ATP-Resynthese und Sauerstoffverbrauch (d. h. Atmung) führt (Voet et al., 2011). Umgekehrt wird bei Sauerstoffmangel das Pyruvat im Zytosol durch LDH zu Laktat reduziert, wobei sein Kofaktor NADH oxidiert wird (Voet et al., 2011). Ein Problem mit diesem traditionellen Konstrukt ist, dass es sich nicht gut mit einigen wiederkehrenden wissenschaftlichen Beobachtungen vereinbaren lässt. So ist beispielsweise hinlänglich bekannt, dass Laktat unter vollständig aeroben Bedingungen produziert und verbraucht wird. In der Tat kann bei gesunden, normoxischen Personen in Ruhe im postabsorptiven Zustand davon ausgegangen werden, dass etwa 50 μmol-min-1 Laktat allein aus dem Gehirn freigesetzt werden (van Hall et al., 2009; van Hall, 2010). Es ist klar, dass Laktat mehr ist als ein totes Abfallprodukt der anaeroben Glykolyse; vielmehr bietet das Shuttling von Laktat durch den gesamten Organismus eine nützliche Perspektive, um experimentelle Beobachtungen zu interpretieren.
Das Laktat-Shuttle-Konzept
Zwei Laktat-Shuttle-Konzepte wurden vorgeschlagen, die die Bewegung und Nutzung von Laktat innerhalb und zwischen Zellen beschreiben (Brooks, 1998). Die Hypothese des intrazellulären Laktat-Shuttles besagt, dass Laktat, das während der Glykolyse gebildet wird, kontinuierlich als Energiequelle innerhalb derselben Zelle genutzt werden kann (Brooks, 1998). Beim interzellulären oder Zell-Zell-Laktat-Shuttle wird Laktat erzeugt und aus einer Zelle exportiert, um von einer anderen Zelle aufgenommen und genutzt zu werden (Brooks, 1998). Der Zell-Zell-Laktat-Shuttle hat sich allgemein durchgesetzt; die genaueren Einzelheiten des intrazellulären Laktat-Shuttles müssen jedoch noch untersucht werden. Kürzlich haben wir sowohl eine physikalische als auch eine funktionelle Verbindung von LDH mit Mitochondrien in Skelettmuskeln nachgewiesen (Elustondo et al., 2013). Mithilfe der konfokalen Laser-Scanning-Mikroskopie bestätigten wir die Kolokalisierung von LDH mit mitochondrialen Membranproteinen im Ratten-Skelettmuskel. Wir fanden heraus, dass Mitochondrien in mit Saponin permeabilisierten Skelettmuskelfasern von Ratten Laktat in Gegenwart von NAD+, Malat und ADP oxidierten (Elustondo et al., 2013); eine andere Gruppe fand Ähnliches in menschlichen Fasern (Jacobs et al., 2013). Das Pyruvat wurde dann in die Mitochondrien transportiert, wo es durch Pyruvat-Dehydrogenase (PDH) und anschließend durch den TCA-Zyklus weiter oxidiert wurde, wobei reduzierende Äquivalente die Atmung anregten (Elustondo et al., 2013; Jacobs et al., 2013). Wir waren in der Lage, die Atmung mit nur 5μM Alpha-Cyano-Hydroxycinnamat, einem Inhibitor des mitochondrialen Pyruvattransports, zu hemmen, was ein weiterer Beleg dafür ist, dass Pyruvat, aber nicht Laktat in die mitochondriale Matrix transportiert wird. Diese Ergebnisse belegen, dass LDH strategisch positioniert ist, um funktionell mit Mitochondrien zu interagieren, und legen nahe, dass die Laktatoxidation nahe der äußeren Oberfläche der inneren Mitochondrienmembran stattfindet. Wie könnte ein intrazelluläres Laktat-Shuttle in einer intakten Zelle funktionieren? Kehren wir zur MAS zurück.
In vivo könnte zytosolisches NAD+ theoretisch durch Malatdehydrogenase außerhalb der Mitochondrienmatrix als Teil der MAS regeneriert werden. Die Literatur gibt einige Einblicke in verschiedene Gewebe und deren mitochondriale Shuttle-Aktivitäten. Im Gehirn gilt die MAS als das wichtigste Shuttle-System für den Transport von zytosolischem NADH in die Mitochondrien (McKenna et al., 2006, und Verweise darin); umgekehrt scheint das Glycerin-Phosphat-Shuttle von geringerer Bedeutung zu sein (Nguyen et al., 2003). In der Tat wurde über die enge Verbindung zwischen der MAS und der Biosynthese des Neurotransmitters Glutamat berichtet (Palaiologos et al., 1988). Die veröffentlichten Aktivitäten der MAS, die in aus Rattenhirn isolierten Mitochondrien gemessen wurden, liegen in der Größenordnung von 26,7 nmol-min-1-mg-1 (Pardo et al., 2006). In Synaptosomen führt eine pharmakologische Hemmung der MAS zu einem deutlichen (d. h. 50 %) Rückgang der Laktatoxidation (McKenna et al., 1993), was das in Abbildung 1 dargestellte Modell unterstützt. Die intrazerebrale Produktion von Laktat aus 13C-markierter Glukose unterstützt die Vorstellung, dass Laktat ein wichtiger Brennstoff für Neuronen ist (Sampol et al., 2013).
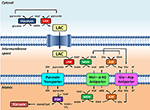
Abbildung 1. Schematische Darstellung der Verbindung zwischen Glykolyse und Laktatoxidation in den Mitochondrien, die in dieser Perspektive skizziert wird. Insgesamt werden bei der Glykolyse neben ATP auch Pyruvat und NADH gewonnen. NAD+ kann für die Glykolyse durch die Reduktion von Pyruvat zu Laktat (LAC) durch Laktatdehydrogenase (LDH) regeneriert werden. LAC kann in die Mitochondrien diffundieren, wo es durch LDH zu Pyruvat oxidiert wird. NAD+ wird durch die Extra-Matrix-Malat-Dehydrogenase (MDH) des Malat-Aspartat-Shuttles regeneriert. Pyruvat wird anschließend durch die innere Mitochondrienmembran in die Matrix transportiert, wo es dann von der Pyruvatdehydrogenase (PDH) zu Acetyl-CoA oxidiert wird. Abkürzungen: α-KG, Alpha-Ketoglutarat; Glu, Glutamat; AAT, Aspartat-Aminotransferase; OAA, Oxalacetat; Mal, Malat.
Es ist zu beachten, dass die MAS ihre Grenzen haben kann. Bei hoher kardialer Arbeitsbelastung wurde gezeigt, dass der α-Ketoglutarat/Malat-Transporter der inneren Mitochondrienmembran nicht mit der Matrix-α-Ketoglutarat-Dehydrogenase um ihr gemeinsames Substrat, α-Ketoglutarat, konkurrieren kann (O’Donnell et al., 2004). Dies führt zu einer Begrenzung der MAS und ihres Shuttles von NADH in die Mitochondrien. Der Nettoeffekt dieser Begrenzung der MAS wäre ein Anstieg der zytosolischen Laktatkonzentration, da die NAD+-Regeneration über die LDH-Reaktion dazu beitragen würde, den homöostatischen NAD+/NADH-Wert zu erhalten, selbst in Gegenwart von ausreichend Sauerstoff. Dies ist in der Tat das klassische Phänomen, das bei besonders anstrengender körperlicher Betätigung beobachtet wird, bei der sich trotz ausreichender Sauerstoffverfügbarkeit Laktat im Blut ansammeln kann.
Intrazelluläre Kompartmentalisierung der LDH: Lehren aus dem Phosphokreatin-Shuttle
Der Gedanke, Verbindungen zwischen den Mitochondrien und dem Zytosol hin- und herzuschieben, um den Energiebedarf der Zelle mit Hilfe von Enzymen zu decken, die nahezu im Gleichgewicht sind, ist sicherlich nicht neu. Am Phosphokreatin-Shuttle (PCr) sind verschiedene Isoformen der mitochondrialen und zytosolischen Kreatinkinase (CK) beteiligt, die im Wesentlichen „energiereiches“ Phosphat von den Mitochondrien zum Zytosol transportieren. Wie die LDH-Reaktion gilt auch die CK-Reaktion (Phosphokreatin + ADP + H+ ⇌ Kreatin + ATP) als „nahezu gleichgewichtig“ und begünstigt die ATP-Resynthese. Experimentelle Belege zeigen jedoch, dass sich in Herzmuskelzellen nur die zytosolische CK tatsächlich im oder nahe am Gleichgewicht befindet (Übersicht in Joubert et al., 2004). Die mitochondriale CK hingegen, die im Intermembranraum lokalisiert ist, ist aus dem Gleichgewicht gebracht und begünstigt die Netto-Resynthese von PCr. In Analogie dazu geht man davon aus, dass zwei verschiedene LDH-Populationen am intrazellulären Laktat-Shuttle beteiligt sind: die zytosolische und die mitochondriale. Die zytosolische LDH würde sich im oder nahe dem Gleichgewicht befinden, während die mitochondriale LDH aus dem Gleichgewicht gebracht würde. Die zytosolische LDH würde die Nettolaktatproduktion begünstigen, während die mitochondriale LDH die Laktatoxidation begünstigen würde. Und ähnlich wie die Adenin-Nukleotid-Translokase (ANT), die ADP im Austausch gegen ATP durch die innere Mitochondrienmembran in die Matrix transportiert, die Verschiebung des Gleichgewichts für mitochondriale CK im Intermembranraum erleichtert, würde auch der Pyruvat-Transporter kontinuierlich Pyruvat transportieren und die mitochondriale LDH-Reaktion aus dem Gleichgewicht bringen (Abbildung 1). Ein solches Laktat-Shuttle würde von der Lokalisierung von LDH im Intermembranraum in der Nähe der inneren Mitochondrienmembran oder an der Außenseite der äußeren Mitochondrienmembran an den Kontaktstellen zwischen äußerer und innerer Mitochondrienmembran oder beidem profitieren. Wenn die intrazelluläre Laktatoxidation in den Mitochondrien durch Kompartimentierung stattfindet, wie beim PCr-Shuttle, wäre die zelluläre Lokalisierung von LDH in, an oder um die Mitochondrien ein wichtiges Merkmal.
Interzelluläre Kompartmentalisierung des Laktatstoffwechsels: das Astrozyten-Neuronen-Laktat-Shuttle
Eine umfangreiche und wachsende Anzahl neuroenergetischer Forschungsarbeiten unterstützt ebenfalls die Existenz eines kompartmentalisierten Laktatstoffwechsels zwischen benachbarten Gehirnzellen, nämlich Astrozyten und Neuronen (Übersicht in Pellerin und Magistretti, 2012). Der Astrozyten-Neuronen-Laktat-Shuttle (Pellerin und Magistretti, 2012), eine Variante des interzellulären Laktat-Shuttles im Allgemeinen (Brooks, 2009), basiert auf der Idee, dass Astrozyten überwiegend glykolytisch sind, während Neuronen eher oxidativ arbeiten (Bouzier-Sore und Pellerin, 2013 und Referenzen darin). Unter Verwendung eines metabolischen Modellierungsansatzes wurde argumentiert, dass ein größerer metabolischer Fluss durch PDH und die mitochondrialen NADH-Shuttles in Neuronen im Vergleich zu Astrozyten zwangsläufig die Netto-Laktatfreisetzung durch Astrozyten und die Oxidation durch Neuronen diktiert (Neves et al.(2012), was viele experimentelle Beobachtungen bestätigt (siehe Bouzier-Sore und Pellerin, 2013). Wie bereits erwähnt, stellt die MAS die wichtigste mitochondriale NADH-Zufuhr in reifen Neuronen dar (Kauppinen et al., 1987; Ramos et al., 2003; Contreras und Satrustegui, 2009; Gellerich et al., 2012). Ein wichtiges Merkmal des Laktat verbrauchenden Neurons könnte daher seine hohe MAS-Aktivität sein (Neves et al., 2012). Ist es Zeit für ein Laktat-Malat-Aspartat-Shuttle? Gibt es zusätzliche theoretische Unterstützung für ein solches Modell, in dem Laktat als reduzierendes Äquivalent dient?
Regeneration von zytosolischem NAD+
Die Laktatoxidation im Mitochondrium macht die aerobe Glykolyse noch sinnvoller, indem sie die Regeneration von zytosolischem NAD+ durch zytosolische LDH ermöglicht. Tatsächlich deuten Hinweise in kultivierten Zellen auf ein sehr labiles Laktat/Pyruvat-Verhältnis hin, das sich ändert, um das homöostatische NAD+/NADH-Verhältnis zu erhalten (Sun et al., 2012). Dies wäre für die Zelle aus einer Reihe von Gründen von Vorteil. Erstens würde es eine unmittelbare Möglichkeit bieten, NAD+ lokal zu regenerieren (d. h. im Zytosol, wo die Glykolyse stattfindet); die größere relative Diffusionsfähigkeit von Laktat (Molekulargewicht = 89,07 g/mol) im Vergleich zu NAD+ (Molekulargewicht = 663,43 g/mol) bedeutet, dass Laktat unter Bedingungen mit erhöhtem glykolytischem Fluss (z. B. intensives Training, hypoxischer Stress) leicht aus der Zelle diffundieren kann, während es gleichzeitig zu den Mitochondrien geleitet wird. In Zeiten reduzierten zellulären Energiebedarfs würde die fortgesetzte Laktatproduktion bei viel niedrigeren glykolytischen Flussraten immer noch zur Aufrechterhaltung des homöostatischen NAD+/NADH-Gleichgewichts in der Zelle sowie zur fortgesetzten Kopplung des intrazellulären Laktat-Shuttlings an die MAS verwendet.
Protonen-Shuttling und mitochondrialer Substrattransport
Die Laktatoxidation in den Mitochondrien ist für die aerobe Glykolyse sinnvoll, da die Laktatproduktion im Zytosol effektiv ein Proton verbraucht (Robergs et al., 2004), was vermutlich dazu beiträgt, die mit erhöhtem ATP-Umsatz und hohen Glykolyse-Raten einhergehende metabolische Azidose zu mildern (Robergs et al., 2004). Die zytosolische Laktatkonzentration übersteigt die von Pyruvat in der Regel um mindestens das Zehnfache, was bedeutet, dass Laktat und nicht Pyruvat das vorherrschende Monocarboxylat ist, das in den Intermembranraum der Mitochondrien gelangt (Brooks et al., 1999). Durch die Oxidation von Laktat im mitochondrialen Intermembranraum würden Protonen freigesetzt, die zur ΔpH-Komponente der mitochondrialen Protonenmotivkraft über die innere Membran beitragen könnten (Santo-Domingo und Demaurex, 2012) und/oder indirekt durch die MAS in die Mitochondrien transportiert würden. Wie beim Transport von anorganischem Phosphat und einigen anderen Substraten und Ionen (Santo-Domingo und Demaurex, 2012) scheint der Carrier-vermittelte Transport von Pyruvat durch die innere Mitochondrienmembran in Rattenleber-Mitochondrien direkt an den Protonensymport (oder OH-Antiport) gekoppelt zu sein (Papa et al., 1971; Halestrap, 1975). Die Oxidation von Laktat nahe der äußeren Oberfläche der inneren Mitochondrienmembran, bei der ein Proton freigesetzt wird, würde zum ΔpH-Wert und damit zum Pyruvattransport in die Matrix beitragen. In der Nähe der inneren Mitochondrienmembran könnte das LDH-Massenwirkungsverhältnis (d. h. Konzentrationen von Produkten/Konzentrationen von Reaktionen) durch das „Ausbluten“ von Pyruvat, das kontinuierlich durch die laktatundurchlässige innere Mitochondrienmembran transportiert wird, sowie durch eine großzügige Regeneration von NAD+ durch die Extra-Matrix-Malatdehydrogenase der MAS weitgehend erleichtert werden. In diesem Modell würde der Transport von Pyruvat durch die innere Mitochondrienmembran die Rate der Laktatoxidation außerhalb der Matrix direkt beeinflussen. Die Laktatoxidation in den Mitochondrien würde daher voraussichtlich indirekt durch die PDH-Reaktion in der Matrix reguliert werden. Dies wäre vorteilhaft, da PDH im Gegensatz zu LDH durch Allosterie und kovalente Modifikation stark reguliert wird. Wie bereits erwähnt, sagen Modellierungen voraus, dass eine hohe PDH-Aktivität den neuronalen Laktatverbrauch in vivo bestimmt (Neves et al., 2012); und eine hohe PDH-Aktivität kennzeichnet auch laktatverbrauchende Neuronen in Kultur (Halim et al., 2010).
Methodische Überlegungen
Wenn die mitochondriale Laktatoxidation funktionell mit der Aktivität der MAS verbunden ist, wäre es wichtig, Komponenten der MAS in In-vitro-Analysen der mitochondrialen Laktatoxidation einzubeziehen, wie Malat selbst oder Oxalacetat. Malat ist die wahrscheinliche Wahl, da es routinemäßig zur Stimulierung der Atmung in vitro eingesetzt wird, wo es in die Matrix transportiert und von der mitochondrialen Malatdehydrogenase zu Oxalacetat oxidiert wird. Dieses Oxalacetat kann dann mit Acetyl-CoA kondensieren, das z. B. bei der Zugabe von Pyruvat entsteht. Die Einbeziehung von Glutamat zusätzlich zu Malat ermöglicht den vollen Betrieb der MAS auf der Ebene der mitochondrialen Atmung. Ein wichtiger, aber manchmal übersehener Aspekt einer angemessenen Bewertung der mitochondrialen Laktatoxidation ist die Einbeziehung von NAD+ als notwendigem Cofaktor für die LDH-Reaktion und von ADP als Phosphatakzeptor zur Stimulierung der oxidativen Phosphorylierung (d. h. der Atmung im Stadium 3). Auch die Extra-Matrix-Komponente der MAS beinhaltet die Malat-Dehydrogenase-Reaktion: Oxalacetat + NADH + H+ ⇌ Malat + NAD+. Experimentelle Protokolle zur Untersuchung des respiratorischen Sauerstoffverbrauchs in isolierten Muskelmitochondrien unter Verwendung hoher Malatkonzentrationen (z. B. 4 mM; Rasmussen et al., 2002) können die Malat-Dehydrogenase-Reaktion in umgekehrter Richtung begünstigen (d. h. Malat-Oxidation und NADH + H+-Produktion), wenn sie der Mitochondrienprobe in Kombination mit NAD+ zugesetzt werden. Tatsächlich wurde die Umkehrbarkeit der MAS in isolierten Hepatozyten (Berry, 1971) und Mitochondrien mit rekonstituierter MAS (Kunz und Davis, 1991) beobachtet. Der Nettoeffekt dieser MAS-Umkehrung auf die Atmung würde darin bestehen, dass Malat nicht in die Mitochondrien gelangt und Oxalacetat bildet. Noch wichtiger ist, dass die Umkehrung die Oxidation von Laktat zu Pyruvat und den anschließenden Transport und die Oxidation des Pyruvats in der Matrix verhindern würde. Die Lösung für diese methodischen Hindernisse bei der Beobachtung der mitochondrialen Laktatoxidation in vitro besteht darin, mindestens eine Komponente der MAS hinzuzufügen. Bei Zugabe von Malat sollte die geeignete Konzentration experimentell bestimmt werden. Die Zugabe von ADP und NAD+ oder NADH (es sei daran erinnert, dass die MAS NAD+ für die LDH-Reaktion erzeugt) ist ebenfalls erforderlich, um eine nennenswerte mitochondriale Laktatoxidation zu beobachten.
Zusammenfassung
Eine Laktat-MAS ist die Interaktion zwischen den Laktat- und Malat-Aspartat-Shuttles, um reduzierende Energie in die Mitochondrien zu verlagern, insbesondere in oxidativen, metabolisch aktiven Zellen.
Erklärung zu Interessenkonflikten
Der Autor erklärt, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Vielen Dank an Dr. Erich Gnaiger (Medizinische Universität Innsbruck) und Dr. George Brooks (University of California, Berkeley) für die Kritik an früheren Entwürfen dieser Arbeit.
Barros, L. F. (2013). Metabolic signaling by lactate in the brain. Trends Neurosci. 36, 396-404. doi: 10.1016/j.tins.2013.04.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bergman, B. C., Wolfel, E. E., Butterfield, G. E., Lopaschuk, G. D., Casazza, G. A., Horning, M. A., et al. (1999). Aktive Muskel- und Ganzkörper-Laktatkinetik nach Ausdauertraining bei Männern. J. Appl. Physiol. (1985) 87, 1684-1696.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Berry, M. N. (1971). Energy-dependent reduction of pyruvate to lactate by intact isolated parenchymal cells from rat liver. Biochem. Biophys. Res. Commun. 44, 1449-1456. doi: 10.1016/S0006-291X(71)80248-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Boumezbeur, F., Petersen, K. F., Cline, G. W., Mason, G. F., Behar, K. L., Shulman, G. I., et al. (2010). Der Beitrag von Blutlaktat zum Energiestoffwechsel des Gehirns beim Menschen, gemessen mit dynamischer 13C-Kernresonanzspektroskopie. J. Neurosci. 30, 13983-13991. doi: 10.1523/JNEUROSCI.2040-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., and Pellerin, L. (2013). Unraveling the complex metabolic nature of astrocytes. Front. Cell. Neurosci. 7:179. doi: 10.3389/fncel.2013.00179
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., Voisin, P., Bouchaud, V., Bezancon, E., Franconi, J. M., and Pellerin, L. (2006). Konkurrenz zwischen Glukose und Laktat als oxidative Energiesubstrate in Neuronen und Astrozyten: eine vergleichende NMR-Studie. Eur. J. Neurosci. 24, 1687-1694. doi: 10.1111/j.1460-9568.2006.05056.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (1998). Mammalian fuel utilization during sustained exercise. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 120, 89-107. doi: 10.1016/S0305-0491(98)00025-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2009). Cell-cell and intracellular lactate shuttles. J. Physiol. 587, 5591-5600. doi: 10.1113/jphysiol.2009.178350
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2014). „Metabolic systems: the formation and utilization of lactate“, in History of Exercise Physiology. Human Kinetics, ed C. M. Tipton (Champaign, IL: Human Kinetics), 447-475.
Google Scholar
Brooks, G. A., Butterfield, G. E., Wolfe, R. R., Groves, B. M., Mazzeo, R. S., Sutton, J. R., et al. (1991). Geringere Abhängigkeit von Laktat während des Trainings nach Akklimatisierung auf 4.300 m. J. Appl. Physiol. (1985). 71, 333-341.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Brooks, G. A., Dubouchaud, H., Brown, M., Sicurello, J. P., and Butz, C. E. (1999). Die Rolle der mitochondrialen Laktatdehydrogenase und der Laktatoxidation im intrazellulären Laktat-Shuttle. Proc. Natl. Acad. Sci. U.S.A. 96, 1129-1134. doi: 10.1073/pnas.96.3.1129
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Chatham, J. C., Des Rosiers, C., und Forder, J. R. (2001). Nachweis getrennter Wege für die Laktataufnahme und -abgabe durch das perfundierte Rattenherz. Am. J. Physiol. Endocrinol. Metab. 281, E794-E802.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Contreras, L., and Satrustegui, J. (2009). Calcium-Signalübertragung in Gehirnmitochondrien: Zusammenspiel von Malat-Aspartat-NADH-Shuttle und Calcium-Uniporter/mitochondrialer Dehydrogenase-Weg. J. Biol. Chem. 284, 7091-7099. doi: 10.1074/jbc.M808066200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Crabtree, B., and Newsholme, E. A. (1978). Sensitivität einer gleichgewichtsnahen Reaktion in einem Stoffwechselweg auf Änderungen der Substratkonzentration. Eur. J. Biochem. 89, 19-22. doi: 10.1111/j.1432-1033.1978.tb20891.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Cruz, R. S., de Aguiar, R. A., Turnes, T., Penteado Dos Santos, R., de Oliveira, M. F., and Caputo, F. (2012). Intrazellulärer Shuttle: der aerobe Laktatstoffwechsel. ScientificWorldJournal 2012:420984. doi: 10.1100/2012/420984
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Dienel, G. A. (2012). Der Laktatstoffwechsel des Gehirns: Entdeckungen und Kontroversen. J. Cereb. Blood Flow Metab. 32, 1107-1138. doi: 10.1038/jcbfm.2011.175
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Digerness, S. B., and Reddy, W. J. (1976). The malate-aspartate shuttle in heart mitochondria. J. Mol. Cell. Cardiol. 8, 779-785. doi: 10.1016/0022-2828(76)90084-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Doherty, J. R., and Cleveland, J. L. (2013). Targeting lactate metabolism for cancer therapeutics. J. Clin. Invest. 123, 3685-3692. doi: 10.1172/JCI69741
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Donovan, C. M., and Pagliassotti, M. J. (2000). Quantitative Bewertung der Wege der Laktatentsorgung in Skelettmuskelfasertypen. Med. Sci. Sports Exerc. 32, 772-777. doi: 10.1097/00005768-200004000-00009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Elustondo, P. A., White, A. E., Hughes, M. E., Brebner, K., Pavlov, E., and Kane, D. A. (2013). Physikalische und funktionelle Verbindung von Laktatdehydrogenase (LDH) mit Skelettmuskelmitochondrien. J. Biol. Chem. 288, 25309-25317. doi: 10.1074/jbc.M113.476648
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Funfschilling, U., Supplie, L. M., Mahad, D., Boretius, S., Saab, A. S., Edgar, J., et al. (2012). Glykolytische Oligodendrozyten erhalten Myelin und langfristige axonale Integrität. Nature 485, 517-521. doi: 10.1038/nature11007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Gainutdinov, T., Muth, K., Seppet, E., Orynbayeva, Z., et al. (2013). Die Steuerung der mitochondrialen Energieversorgung des Gehirns durch zytosolisches Kalzium: das mitochondriale Gaspedal. IUBMB Life 65, 180-190. doi: 10.1002/iub.1131
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Trumbekaite, S., Korzeniewski, B., Gaynutdinov, T., Seppet, E., et al. (2012). Zytosolisches Ca2+ reguliert die Energieversorgung isolierter Hirnmitochondrien durch Bildung von Pyruvat über das Malat-Aspartat-Shuttle. Biochem. J. 443, 747-755. doi: 10.1042/BJ20110765
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gertz, E. W., Wisneski, J. A., Stanley, W. C., and Neese, R. A. (1988). Myokardiale Substratverwertung während der Belastung beim Menschen. Dual carbon-labeled carbohydrate isotope experiments. J. Clin. Invest. 82, 2017-2025. doi: 10.1172/JCI113822
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2004). Laktatstoffwechsel: ein neues Paradigma für das dritte Jahrtausend. J. Physiol. 558, 5-30. doi: 10.1113/jphysiol.2003.058701
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2007). Gibt es ein intrazelluläres Laktat-Shuttle im Skelettmuskel? J. Physiol. 582, 899. doi: 10.1113/jphysiol.2007.138487
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Halestrap, A. P. (1975). The mitochondrial pyruvate carrier. Kinetik und Spezifität für Substrate und Inhibitoren. Biochem. J. 148, 85-96.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Halim, N. D., McFate, T., Mohyeldin, A., Okagaki, P., Korotchkina, L. G., Patel, M. S., et al. (2010). Der Phosphorylierungsstatus der Pyruvatdehydrogenase unterscheidet metabolische Phänotypen von kultivierten Astrozyten und Neuronen des Rattenhirns. Glia 58, 1168-1176. doi: 10.1002/glia.20996
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Jacobs, R. A., Meinild, A. K., Nordsborg, N. B., and Lundby, C. (2013). Laktatoxidation in den Mitochondrien der menschlichen Skelettmuskulatur. Am. J. Physiol. Endocrinol. Metab. 304, E686-E689. doi: 10.1152/ajpendo.00476.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Joubert, F., Mateo, P., Gillet, B., Beloeil, J. C., Mazet, J. L., and Hoerter, J. A. (2004). CK-Fluss oder direkter ATP-Transfer: Vielseitigkeit der Energieübertragungswege, nachgewiesen durch NMR im perfundierten Herzen. Mol. Cell. Biochem. 256-257, 43-58. doi: 10.1023/B:MCBI.0000009858.41434.fc
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kauppinen, R. A., Sihra, T. S., und Nicholls, D. G. (1987). Aminooxyessigsäure hemmt den Malat-Aspartat-Shuttle in isolierten Nervenendigungen und hindert die Mitochondrien daran, glykolytische Substrate zu verwerten. Biochim. Biophys. Acta 930, 173-178. doi: 10.1016/0167-4889(87)90029-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kitaoka, Y., Hoshino, D., and Hatta, H. (2012). Monocarboxylat-Transporter und Laktat-Stoffwechsel. J. Phys. Fitness Sports Med. 1, 247-252. doi: 10.7600/jpfsm.1.247
CrossRef Full Text | Google Scholar
Kline, E. S., Brandt, R. B., Laux, J. E., Spainhour, S. E., Higgins, E. S., Rogers, K. S., et al. (1986). Lokalisierung von L-Laktat-Dehydrogenase in Mitochondrien. Arch. Biochem. Biophys. 246, 673-680. doi: 10.1016/0003-9861(86)90323-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kunz, W. S., and Davis, E. J. (1991). Kontrolle des reversiblen intrazellulären Transfers von reduzierendem Potential. Arch. Biochem. Biophys. 284, 40-46. doi: 10.1016/0003-9861(91)90260-P
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Luft, F. C. (2001). Lactic acidosis update for critical care clinicians. J. Am. Soc. Nephrol. 12 Suppl 17: S15-S19.
Pubmed Abstract | Pubmed Full Text | Google Scholar
McKenna, M. C., Tildon, J. T., Stevenson, J. H., Boatright, R., and Huang, S. (1993). Regulation des Energiestoffwechsels in synaptischen Terminals und kultivierten Astrozyten des Rattenhirns: Unterschiede, die mit Aminooxyacetat nachgewiesen wurden. Dev. Neurosci. 15, 320-329. doi: 10.1159/000111351
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
McKenna, M. C., Waagepetersen, H. S., Schousboe, A., and Sonnewald, U. (2006). Neuronale und astrozytäre Shuttle-Mechanismen für den zytosolisch-mitochondrialen Transfer von reduzierenden Äquivalenten: aktuelle Erkenntnisse und pharmakologische Werkzeuge. Biochem. Pharmacol. 71, 399-407. doi: 10.1016/j.bcp.2005.10.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Neves, A., Costalat, R., and Pellerin, L. (2012). Determinanten des metabolischen Phänotyps von Gehirnzellen und der Nutzung von Energiesubstraten durch einen Modellierungsansatz entschlüsselt. PLoS Comput. Biol. 8:e1002686. doi: 10.1371/journal.pcbi.1002686
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Newington, J. T., Harris, R. A., and Cumming, R. C. (2013). Neubewertung des Stoffwechsels bei der Alzheimer-Krankheit aus der Perspektive des Astrozyten-Neuron-Laktat-Shuttle-Modells. J. Neurodegener. Dis. 2013, 13. doi: 10.1155/2013/234572
CrossRef Full Text | Google Scholar
Nguyen, N. H., Brathe, A., and Hassel, B. (2003). Neuronale Aufnahme und Metabolismus von Glycerin und die neuronale Expression von mitochondrialer Glycerin-3-phosphat-Dehydrogenase. J. Neurochem. 85, 831-842. doi: 10.1046/j.1471-4159.2003.01762.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
O’Donnell, J. M., Kudej, R. K., LaNoue, K. F., Vatner, S. F., und Lewandowski, E. D. (2004). Begrenzter Transfer von zytosolischem NADH in die Mitochondrien bei hoher kardialer Arbeitsbelastung. Am. J. Physiol. Heart Circ. Physiol. 286, H2237-H2242. doi: 10.1152/ajpheart.01113.2003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Palaiologos, G., Hertz, L., und Schousboe, A. (1988). Evidence that aspartate aminotransferase activity and ketodicarboxylate carrier function are essential for biosynthesis of transmitter glutamate. J. Neurochem. 51, 317-320. doi: 10.1111/j.1471-4159.1988.tb04872.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Papa, S., Francavilla, A., Paradies, G., and Meduri, B. (1971). Der Transport von Pyruvat in den Mitochondrien der Rattenleber. FEBS Lett. 12, 285-288. doi: 10.1016/0014-5793(71)80200-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pardo, B., Contreras, L., Serrano, A., Ramos, M., Kobayashi, K., Iijima, M., et al. (2006). Wesentliche Rolle von Aralar bei der Weiterleitung kleiner Ca2+-Signale an neuronale Mitochondrien. J. Biol. Chem. 281, 1039-1047. doi: 10.1074/jbc.M507270200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pellerin, L., and Magistretti, P. J. (2012). Sweet sixteen for ANLS. J. Cereb. Blood Flow Metab. 32, 1152-1166. doi: 10.1038/jcbfm.2011.149
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., and Grunnet, N. (2011a). Hohes Hirnlaktat wird nicht durch eine Verschiebung des Laktatdehydrogenase A/B-Verhältnisses verursacht. Proc. Natl. Acad. Sci. U.S.A. 108, E21. author reply: E22. doi: 10.1073/pnas.1017750108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., and Grunnet, N. (2011b). Das Isoenzym-Muster von LDH spielt keine physiologische Rolle; außer vielleicht bei schnellen Übergängen im Energiestoffwechsel. Aging (Albany, NY) 3, 457-460.
Google Scholar
Quistorff, B., Secher, N. H., and Van Lieshout, J. J. (2008). Laktat ist der Treibstoff für das menschliche Gehirn während des Trainings. FASEB J. 22, 3443-3449. doi: 10.1096/fj.08-106104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Ramos, M., del Arco, A., Pardo, B., Martinez-Serrano, A., Martinez-Morales, J. R., Kobayashi, K., et al. (2003). Entwicklungsbedingte Veränderungen des Ca2+-regulierten mitochondrialen Aspartat-Glutamat-Carriers aralar1 im Gehirn und auffällige Expression im Rückenmark. Brain Res. Dev. Brain Res. 143, 33-46. doi: 10.1016/S0165-3806(03)00097-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rasmussen, H. N., van Hall, G., und Rasmussen, U. F. (2002). Lactat-Dehydrogenase ist kein mitochondriales Enzym im Vastus lateralis-Muskel von Mensch und Maus. J. Physiol. 541, 575-580. doi: 10.1113/jphysiol.2002.019216
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Robergs, R. A., Ghiasvand, F., und Parker, D. (2004). Biochemie der trainingsinduzierten metabolischen Azidose. Am. J. Physiol. Regul. Integr. Comp. Physiol. 287, R502-R516. doi: 10.1152/ajpregu.00114.2004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rueda, C. B., Llorente-Folch, I., Amigo, I., Contreras, L., Gonzalez-Sanchez, P., Martinez-Valero, P., et al. (2014). Ca2+-Regulierung der mitochondrialen Funktion in Neuronen. Biochim. Biophys. Acta 1837, 1617-1624. doi: 10.1016/j.bbabio.2014.04.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Safer, B., Smith, C. M., and Williamson, J. R. (1971). Kontrolle des Transports von reduzierenden Äquivalenten durch die mitochondriale Membran im perfundierten Rattenherz. J. Mol. Cell. Cardiol. 2, 111-124. doi: 10.1016/0022-2828(71)90065-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sampol, D., Ostrofet, E., Jobin, M. L., Raffard, G., Sanchez, S., Bouchaud, V., et al. (2013). Glukose- und Laktatstoffwechsel bei der wachen und stimulierten Ratte: eine (13)C-NMR-Studie. Front. Neuroenergetics 5:5. doi: 10.3389/fnene.2013.00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Santo-Domingo, J., and Demaurex, N. (2012). Perspectives on: SGP-Symposium zur mitochondrialen Physiologie und Medizin: Die Renaissance des mitochondrialen pH-Wertes. J. Gen. Physiol. 139, 415-423. doi: 10.1085/jgp.201110767
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Schantz, P. G. (1986). Plastizität des menschlichen Skelettmuskels unter besonderer Berücksichtigung der Auswirkungen von körperlichem Training auf den Enzymgehalt der NADH-Shuttles und die phänotypische Expression von langsamen und schnellen myofibrillären Proteinen. Acta Physiol. Scand. Suppl. 558, 1-62.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Schurr, A. (2014). Zerebrale Glykolyse: ein Jahrhundert anhaltender Missverständnisse und Missverständnisse. Front. Neurosci. 8:360. doi: 10.3389/fnins.2014.00360
CrossRef Full Text | Google Scholar
Schurr, A., West, C. A., and Rigor, B. M. (1988). Lactat-unterstützte synaptische Funktion im Ratten-Hippocampus-Scheibenpräparat. Science 240, 1326-1328. doi: 10.1126/science.3375817
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Skilleter, D. N., and Kun, E. (1972). Die Oxidation von L-Laktat durch Lebermitochondrien. Arch. Biochem. Biophys. 152, 92-104. doi: 10.1016/0003-9861(72)90197-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Spriet, L. L., Howlett, R. A., and Heigenhauser, G. J. (2000). Ein enzymatischer Ansatz zur Laktatproduktion in der menschlichen Skelettmuskulatur während des Trainings. Med. Sci. Sports Exerc. 32, 756-763. doi: 10.1097/00005768-200004000-00007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Stainsby, W. N., and Brooks, G. A. (1990). Kontrolle des Milchsäurestoffwechsels in kontrahierenden Muskeln und während des Trainings. Exerc. Sport Sci. Rev. 18, 29-63. doi: 10.1249/00003677-199001000-00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sun, F., Dai, C., Xie, J., and Hu, X. (2012). Biochemische Probleme bei der Schätzung des Verhältnisses von freiem NAD/NADH im Zytosol. PLoS ONE 7:e34525. doi: 10.1371/journal.pone.0034525
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Todd, J. J. (2014). Laktat: wertvoll für die körperliche Leistung und die Aufrechterhaltung der Gehirnfunktion während des Trainings. Biosci. Horiz. 7, 1-7. doi: 10.1093/biohorizons/hzu001
CrossRef Full Text | Google Scholar
van Hall, G. (2010). Laktatkinetik in menschlichen Geweben in Ruhe und während der Belastung. Acta Physiol. (Oxf.) 199, 499-508. doi: 10.1111/j.1748-1716.2010.02122.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
van Hall, G., Stromstad, M., Rasmussen, P., Jans, O., Zaar, M., Gam, C., et al. (2009). Blutlaktat ist eine wichtige Energiequelle für das menschliche Gehirn. J. Cereb. Blood Flow Metab. 29, 1121-1129. doi: 10.1038/jcbfm.2009.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Voet, D., Voet, J. G., and Pratt, C. W. (2011). Fundamentals of Biochemistry: Life at the Molecular Level. Hoboken, NJ: Wiley.
Google Scholar
Williamson, D. H., Lund, P., and Krebs, H. A. (1967). Der Redoxzustand des freien Nikotinamid-Adenin-Dinukleotids im Zytoplasma und in den Mitochondrien der Rattenleber. Biochem. J. 103, 514-527.
Pubmed Abstract | Pubmed Full Text | Google Scholar