- Wprowadzenie: Reakcja Dehydrogenazy Mleczanowej
- Czółenko jabłczanowo-asparaginianowe
- Glikoliza konwencjonalna (an)tlenowa
- Koncepcja wahadła mleczanowego
- Intracellular Compartmentalization of LDH: Lessons from the Phosphocreatine Shuttle
- Intercellular Compartmentalization of Lactate Metabolism: the Astrocyte-Neuron Lactate Shuttle
- Regeneracja cytozolowego NAD+
- Proton Shuttling and Mitochondrial Substrate Transport
- Rozważania metodologiczne
- Podsumowanie
- Oświadczenie o konflikcie interesów
- Podziękowania
Wprowadzenie: Reakcja Dehydrogenazy Mleczanowej
Redukcja pirogronianu do mleczanu, katalizowana przez dehydrogenazę mleczanową (LDH; Pirogronian + NADH + H+ ⇌ Mleczan + NAD+) w cytozolu wielu komórek, była uważana za metaboliczny „ślepy zaułek” (Luft, 2001; Quistorff i Grunnet, 2011a), lub może bardziej trafnie, metaboliczny cul de sac (Barros, 2013), ponieważ mleczan może ponownie dołączyć do sieci metabolicznej tylko poprzez pirogronian. U ssaków, reakcja LDH jest również uważana za „prawie równowagową” (Spriet i in., 2000; Quistorff i Grunnet, 2011a,b), co oznacza, że reakcja jest regulowana głównie przez stężenia jej reagentów i produktów, a nie przez bardziej wyrafinowane środki regulacji allosterycznej lub kowalencyjnej modyfikacji (Crabtree i Newsholme, 1978). Ponieważ równowaga dla reakcji LDH leży daleko na prawo (tj. preferowane jest tworzenie mleczanu) (Williamson i in., 1967), niezależnie od izoformy LDH (Quistorff i Grunnet, 2011a,b), można by wnioskować, że LDH rzadko preferuje reakcję odwrotną (tj. utlenianie mleczanu) in vivo. Rzeczywiście, stosunek działania masy (/) niezbędny do odczuwalnego utleniania mleczanu musiałby przekraczać stałą równowagi dla LDH. Jednak dowody doświadczalne coraz bardziej zaprzeczają jakiejkolwiek koncepcji, że LDH działa jednokierunkowo in vivo, i wspierają, że mleczan służy jako ważne paliwo metaboliczne dla wielu tkanek, w tym szkieletowych (Brooks i in., 1991; Bergman i in…, 1999; Donovan i Pagliassotti, 2000) i mięśnia sercowego (Gertz i in., 1988; Chatham i in., 2001), wątroby (Skilleter i Kun, 1972; Kline i in., 1986) i mózgu (Schurr i in., 1988; Bouzier-Sore i in., 2006; Wyss i in., 2011; Funfschilling i in., 2012; przegląd w Barros, 2013). Celem niniejszej pracy jest przedstawienie modelu, w którym mleczan odgrywa centralną rolę w procesie przemieszczania substratów energetycznych pomiędzy cytosolem (glikoliza) a mitochondriami (fosforylacja oksydacyjna). Elementy takiej koncepcji zostały zademonstrowane w sercu (Safer i in., 1971) i mięśniach szkieletowych (Schantz, 1986), a następnie rozszerzone do perspektywy wahadła mleczanowego (Stainsby i Brooks, 1990; Brooks i in., 1999) i kompleksowo omówione (Gladden, 2004) oraz ponownie skomentowane (Gladden, 2007). Koncepcja ta jest szczególnie wspierana przez ostatnie badania w komórkach neuronalnych (Gellerich i in., 2012, 2013; Rueda i in., 2014). Chociaż koncepcja zarysowana w obecnej Perspektywie nie jest nowa, per se (Safer i in., 1971), wyraźny brak konwencjonalnego uznania lub akceptacji jej teoretycznych podstaw uzasadnia dalszą uwagę.
Czółenko jabłczanowo-asparaginianowe
Dzięki nieprzepuszczalności wewnętrznej błony mitochondrialnej dla NAD+ i NADH, NADH generowany przez glikolizę w warunkach tlenowych zależy od pośredniego transferu równoważników redukujących do mitochondriów poprzez czółenko jabłczanowo-asparaginianowe (MAS) i czółenko glicerolowo-fosforanowe. Uważa się również, że czółenka te regenerują cytozolowy NAD+ niezbędny do podtrzymania strumienia glikolitycznego w reakcji dehydrogenazy 3-fosforanu gliceraldehydu wymagającej NAD+. Wykazano, że MAS jest głównym sposobem, w jaki odbywa się to w większości tkanek oksydacyjnych i wydaje się stanowić główny transporter NADH w dojrzałych neuronach (Kauppinen i in., 1987; Ramos i in., 2003; Contreras i Satrustegui, 2009; Gellerich i in., 2012). Wiadomo również, że w warunkach zwiększonego zapotrzebowania energetycznego komórki i/lub zwiększonego strumienia glikolitycznego (np. podczas intensywnego wysiłku fizycznego), a także hipoksji, stężenie mleczanu będzie wzrastać, ponieważ reakcja LDH ułatwia zwiększone tempo regeneracji cytozolowego NAD+ (Robergs i in., 2004). Natomiast w mózgu zwiększenie stężenia mleczanu w krążeniu (np. podczas wysiłku) powoduje zwiększenie utylizacji mleczanu w mózgu (Quistorff i in., 2008; van Hall i in., 2009; Boumezbeur i in., 2010; Dienel, 2012). Sugeruje się również, że zwiększona aktywność LDH (i, w konsekwencji, produkcja mleczanów) po prostu kompensuje niezdolność MAS do nadążania za cytozolowym zapotrzebowaniem na NAD+ (Schantz, 1986). W neuronach, Ca+2 aktywacja MAS i cyklu TCA są konkurencyjne, tak że niższe poziomy Ca+2 stymulują aktywność MAS poprzez aktywację transportera glutaminian/asparaginian (Contreras i Satrustegui, 2009), podczas gdy wyższe stężenia Ca+2 aktywują dehydrogenazę α-ketoglutaranu w macierzy mitochondrialnej, ograniczając ilość α-ketoglutaranu dostępnego dla MAS (Contreras i Satrustegui, 2009). Możliwe jest również, że mleczan powstaje w sposób ciągły w cytozolu, niezależnie od stanu metabolicznego, i że mleczan utleniony w mitochondriach jest sprzężony z MAS. Na przykład w izolowanych mitochondriach serca, MAS wykazuje nadmiarową pojemność, co sugeruje, że sama aktywność MAS jest wystarczająca do utrzymania cytozolowej regeneracji NAD+ (Digerness i Reddy, 1976). Dlaczego więc, w spoczynku i w warunkach całkowicie tlenowych, mleczan byłby wytwarzany podczas glikolizy, skoro cały pirogronian powinien trafiać do mitochondriów w celu fosforylacji oksydacyjnej, a MAS powinien regenerować wystarczającą ilość NAD+?
Glikoliza konwencjonalna (an)tlenowa
Występowanie i znikanie mleczanu podczas różnych stanów metabolicznych było tematem wielu historycznych domysłów, kontrowersji i intryg. Było wiele przeglądów literatury badającej metabolizm mleczanu, do których czytelnicy mogą być kierowani. Niektóre z bardziej aktualnych obejmują (Cruz et al., 2012; Dienel, 2012; Kitaoka et al., 2012; Doherty i Cleveland, 2013; Newington et al., 2013; Brooks, 2014; Schurr, 2014; Todd, 2014). Niestety, wiele współczesnych podręczników nadal używa metabolicznego losu pirogronianu do rozróżnienia dwóch typów glikolizy: tlenowej (tj. wymagającej tlenu) i beztlenowej (tj. bez tlenu). Mówi się, że w obecności tlenu pirogronian przechodzi do mitochondriów, gdzie spotyka się z metabolicznym upadkiem poprzez fosforylację oksydacyjną, której wynikiem netto jest resynteza mitochondrialnego ATP i zużycie tlenu (tj. oddychanie) (Voet i in., 2011). I odwrotnie, gdy tlen jest ograniczony, pirogronian jest redukowany do mleczanu w cytozolu przez LDH, utleniając w tym procesie swój kofaktor NADH (Voet i in., 2011). Problem z tą tradycyjną konstrukcją polega na tym, że nie jest ona zgodna z niektórymi powtarzającymi się obserwacjami naukowymi. Na przykład, dobrze wiadomo, że mleczan jest wytwarzany i zużywany w warunkach w pełni tlenowych. Rzeczywiście, u zdrowych, normoksycznych osób w spoczynku w stanie poabsorpcyjnym, można się spodziewać, że około 50 μmol-min-1 mleczanu jest uwalniane z samego mózgu (van Hall i in., 2009; van Hall, 2010). Wyraźnie widać, że mleczan jest czymś więcej niż tylko martwym metabolitem odpadowym glikolizy beztlenowej; przemieszczanie mleczanu w całym organizmie zapewnia użyteczną perspektywę, w której można interpretować obserwacje eksperymentalne.
Koncepcja wahadła mleczanowego
Przedstawiono dwie koncepcje wahadła mleczanowego, które opisują przemieszczanie i wykorzystanie mleczanu w komórkach i pomiędzy nimi (Brooks, 1998). Hipoteza wewnątrzkomórkowego wahadła mleczanowego zakłada, że mleczan powstały podczas glikolizy może być stale wykorzystywany jako źródło energii w obrębie tej samej komórki (Brooks, 1998). Międzykomórkowe lub komórkowo-mleczanowe wahadło obejmuje mleczan wytwarzany i eksportowany z komórki, który ma być pobrany i wykorzystany przez inną komórkę (Brooks, 1998). Komórkowo-mleczanowy transporter zyskał powszechną akceptację; niemniej jednak, drobniejsze szczegóły wewnątrzkomórkowego transportera mleczanowego nadal pozostają przedmiotem badań. Ostatnio wykazaliśmy zarówno fizyczną, jak i funkcjonalną asocjację LDH z mitochondriami w mięśniach szkieletowych (Elustondo i in., 2013). Wykorzystując laserową skaningową mikroskopię konfokalną, potwierdziliśmy kolokalizację LDH z mitochondrialnymi białkami błonowymi w mięśniu szkieletowym szczura. Stwierdziliśmy, że mitochondria w saponinowo-permeabilizowanych włóknach mięśni szkieletowych szczurów utleniają mleczan w obecności NAD+, jabłczanu i ADP (Elustondo i in., 2013); podobnie wykazała inna grupa w ludzkich włóknach (Jacobs i in., 2013). Pirogronian był następnie transportowany do mitochondriów, gdzie był dalej utleniany przez dehydrogenazę pirogronianową (PDH), a następnie cykl TCA, z równoważnikami redukującymi stymulującymi oddychanie (Elustondo i in., 2013; Jacobs i in., 2013). Byliśmy w stanie zahamować oddychanie przy użyciu zaledwie 5μM alfa-cyjano-hydroksycynamonu, inhibitora mitochondrialnego transportu pirogronianu, co dodatkowo potwierdza, że pirogronian, ale nie mleczan, jest transportowany do macierzy mitochondrialnej. Wyniki te potwierdzają, że LDH jest strategicznie umiejscowiona, aby funkcjonalnie współdziałać z mitochondriami i sugerują, że utlenianie mleczanu zachodzi w pobliżu zewnętrznej powierzchni wewnętrznej błony mitochondrialnej. Jak może działać wewnątrzkomórkowy transporter mleczanu w nienaruszonej komórce? Wróćmy do MAS.
In vivo, cytozolowy NAD+ mógłby, w teorii, być regenerowany przez dehydrogenazę jabłczanową poza macierzą mitochondrialną, jako część MAS. Literatura daje pewien wgląd w różne tkanki i ich mitochondrialne aktywności wahadłowe. W mózgu, MAS jest uważany za najważniejszy system wahadłowy dla dostarczania cytozolowego NADH do mitochondriów (McKenna i in., 2006, i odnośniki); odwrotnie, wahadło glicerolowo-fosforanowe wydaje się mieć mniejsze znaczenie (Nguyen i in., 2003). Istotnie, odnotowano ścisły związek MAS z biosyntezą neuroprzekaźnika glutaminianu (Palaiologos i in., 1988). Opublikowane aktywności MAS mierzone w mitochondriach izolowanych z mózgu szczura są rzędu 26,7 nmol-min-1-mg-1 (Pardo i in., 2006). W synaptosomach farmakologiczne zahamowanie MAS powoduje wyraźny (tj. 50%) spadek utleniania mleczanu (McKenna i in., 1993), co potwierdza model przedstawiony na rycinie 1. Wewnątrzmózgowa produkcja mleczanu z glukozy znakowanej 13C dodatkowo wspiera pogląd, że mleczan jest ważnym paliwem dla neuronów (Sampol i in., 2013).
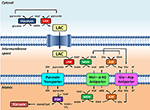
Rysunek 1. Schematyczne przedstawienie związku między glikolizą a utlenianiem mleczanu w mitochondriach, przedstawione w niniejszej Perspektywie. Ogólnie rzecz biorąc, glikoliza daje pirogronian i NADH, oprócz ATP. NAD+ może być regenerowany dla glikolizy poprzez redukcję pirogronianu do mleczanu (LAC) przez dehydrogenazę mleczanową (LDH). LAC może dyfundować do mitochondriów, gdzie jest utleniany do pirogronianu przez LDH. NAD+ jest regenerowany przez pozamatrycową dehydrogenazę jabłczanową (MDH) z transportera jabłczanowo-asparaginianowego. Pirogronian jest następnie transportowany przez wewnętrzną błonę mitochondrialną do macierzy, gdzie jest utleniany przez dehydrogenazę pirogronianową (PDH) do acetylo-CoA. Skróty: α-KG, alfa-ketoglutaran; Glu, glutaminian; AAT, asparaginian-aminotransferaza; OAA, oksalooctan; Mal, jabłczan.
Należy zauważyć, że MAS może mieć swoje ograniczenia. Przy dużym obciążeniu pracą serca wykazano, że transporter α-ketoglutaranu/malonianu wewnętrznej błony mitochondrialnej nie może konkurować z dehydrogenazą macierzy α-ketoglutaranu o ich wspólny substrat, α-ketoglutaran (O’Donnell i in., 2004). Skutkuje to ograniczeniem działania MAS i jej transportem NADH do mitochondriów. Efektem netto tego ograniczenia MAS byłby wzrost cytozolowego stężenia mleczanu, ponieważ regeneracja NAD+ poprzez reakcję LDH pomogłaby zachować homeostatyczne stężenie NAD+/NADH, nawet w obecności odpowiedniej ilości tlenu. Rzeczywiście, jest to klasyczne zjawisko obserwowane podczas szczególnie forsownych ćwiczeń, gdzie mleczan może gromadzić się we krwi, pomimo odpowiedniej dostępności tlenu.
Intracellular Compartmentalization of LDH: Lessons from the Phosphocreatine Shuttle
Pomysł przemieszczania związków między mitochondriami i cytosolem w celu zaspokojenia energetycznych potrzeb komórki przy użyciu enzymów bliskich równowadze z pewnością nie jest nowy. Transfer fosfokreatyny (PCr) obejmuje różne mitochondrialne i cytozolowe izoformy kinazy kreatynowej (CK), aby zasadniczo przenieść „wysokoenergetyczny” fosforan z mitochondriów do cytozolu. Podobnie jak reakcja LDH, reakcja CK (fosfokreatyna + ADP + H+ ⇌ kreatyna + ATP) uważana jest za „prawie równowagową”, sprzyjającą resyntezie ATP. Jednakże dowody doświadczalne wykazują, że w komórkach mięśnia sercowego tylko CK cytozolowa znajduje się w stanie równowagi lub jest do niej zbliżona (Reviewed in Joubert et al., 2004). Z kolei CK mitochondrialna, zlokalizowana w przestrzeni międzybłonowej, jest wytrącona z równowagi, co sprzyja resyntezie netto PCr. Analogicznie, uważa się, że w wewnątrzkomórkowej wymianie mleczanu biorą udział dwie odrębne populacje LDH: cytozolowa i mitochondrialna. Cytozolowe LDH byłoby w stanie równowagi lub w jej pobliżu, podczas gdy mitochondrialne LDH byłoby przesunięte z równowagi. Cytozolowa LDH sprzyjałaby produkcji mleczanu netto, podczas gdy mitochondrialna LDH sprzyjałaby utlenianiu mleczanu. Podobnie jak translokaza nukleotydów adeninowych (ANT), która transportuje ADP do macierzy przez wewnętrzną błonę mitochondrialną w zamian za ATP, ułatwia wypieranie z równowagi mitochondrialnej CK w przestrzeni międzybłonowej, tak samo transporter pirogronianu stale transportowałby pirogronian, wypierając z równowagi mitochondrialną reakcję LDH (Rysunek 1). Taki transporter mleczanu skorzystałby z lokalizacji LDH w przestrzeni międzybłonowej w pobliżu wewnętrznej błony mitochondrialnej, związanej z zewnętrzną błoną mitochondrialną w miejscach kontaktu zewnętrznej i wewnętrznej błony mitochondrialnej, lub z obu tych miejsc. Jeśli wewnątrzkomórkowe utlenianie mleczanu ma zachodzić w mitochondriach poprzez kompartmentalizację, tak jak w przypadku transportera PCr, komórkowa lokalizacja LDH w, przy lub wokół mitochondriów byłaby istotną cechą.
Intercellular Compartmentalization of Lactate Metabolism: the Astrocyte-Neuron Lactate Shuttle
Bogate i rosnące ciało neuroenergetycznych badań również wspiera istnienie przedziałowego metabolizmu mleczanu wśród sąsiadujących komórek mózgu – mianowicie, astrocytów i neuronów (Reviewed w Pellerin i Magistretti, 2012). Wariant międzykomórkowego wahadła mleczanowego ogólnie (Brooks, 2009), wahadło mleczanowe astrocyty-neurony (Pellerin i Magistretti, 2012) opiera się na założeniu, że astrocyty są w przeważającej mierze glikolityczne, podczas gdy neurony są bardziej utleniające (Bouzier-Sore i Pellerin, 2013 i referencje tamże). Wykorzystując podejście modelowania metabolicznego, argumentowano, że większy strumień metaboliczny przez PDH i mitochondrialne czółenka NADH w neuronach w porównaniu z astrocytami z konieczności dyktuje uwalnianie mleczanu netto przez astrocyty i utlenianie przez neurony (Neves i in.2012), co potwierdza wiele obserwacji eksperymentalnych (przegląd w Bouzier-Sore i Pellerin, 2013). Jak wspomniano wcześniej, MAS stanowi główny mitochondrialny transporter NADH w dojrzałych neuronach (Kauppinen i in., 1987; Ramos i in., 2003; Contreras i Satrustegui, 2009; Gellerich i in., 2012). Dlatego też ważną cechą neuronu zużywającego mleczan może być jego wysoka aktywność MAS (Neves i in., 2012). Czy nadszedł czas na wahadło mleczanowo-malanowo-asparaginianowe? Czy istnieje dodatkowe wsparcie teoretyczne dla takiego modelu, w którym mleczan służy jako równoważnik redukujący?
Regeneracja cytozolowego NAD+
Utlenianie mleczanu w mitochondrium dodatkowo nadaje sens glikolizie tlenowej, umożliwiając regenerację cytozolowego NAD+ przez cytozolowe LDH. Rzeczywiście, dowody w hodowanych komórkach wskazują na wysoce labilny stosunek mleczan/pirogronian, który zmienia się w celu zachowania homeostazy NAD+/NADH (Sun et al., 2012). Byłoby to korzystne dla komórki z kilku powodów. Po pierwsze, zapewniłoby to natychmiastowy sposób regeneracji NAD+ lokalnie (tj. w cytozolu, gdzie zachodzi glikoliza); większa względna dyfuzyjność mleczanu (masa cząsteczkowa = 89,07 g/mol) w porównaniu z NAD+ (masa cząsteczkowa = 663,43 g/mol) oznacza, że mleczan może łatwo dyfundować z komórki w warunkach zwiększonego strumienia glikolitycznego (np. intensywny wysiłek fizyczny, stres hipoksyjny), jednocześnie kierując się w stronę mitochondriów. W okresach zmniejszonego zapotrzebowania na energię komórkową, ciągłe wytwarzanie mleczanu podczas znacznie niższych wskaźników strumienia glikolitycznego byłoby nadal wykorzystywane do utrzymania homeostazy NAD+/NADH w komórce, jak również do ciągłego sprzęgania wewnątrzkomórkowego przenoszenia mleczanu do MAS.
Proton Shuttling and Mitochondrial Substrate Transport
Oksydacja mleczanu w mitochondriach ma sens glikolizy tlenowej, ponieważ produkcja mleczanu w cytozolu skutecznie zużywa proton (Robergs i in., 2004), co, jak się uważa, pomaga złagodzić kwasicę metaboliczną związaną ze zwiększonym obrotem ATP i wysokim tempem glikolizy (Robergs i in., 2004). Cytozolowe stężenie mleczanu zwykle przewyższa stężenie pirogronianu co najmniej 10-krotnie, co oznacza, że to mleczan, a nie pirogronian jest dominującym monokarboksylanem wchodzącym do przestrzeni międzybłonowej mitochondriów (Brooks i in., 1999). Utleniając mleczan w przestrzeni międzybłonowej mitochondriów, protony byłyby uwalniane, gdzie mogłyby przyczyniać się do składowej ΔpH mitochondrialnej siły napędowej protonów przez błonę wewnętrzną (Santo-Domingo i Demaurex, 2012) i/lub być transportowane pośrednio do mitochondriów przez MAS. Podobnie jak w przypadku transportu fosforanu nieorganicznego oraz niektórych innych substratów i jonów (Santo-Domingo i Demaurex, 2012), transport pirogronianu przez wewnętrzną błonę mitochondrialną w mitochondriach wątroby szczura za pośrednictwem nośnika wydaje się być bezpośrednio sprzężony z symportem protonowym (lub antyportem OH-) (Papa i in., 1971; Halestrap, 1975). Utlenianie mleczanu w pobliżu zewnętrznej powierzchni wewnętrznej błony mitochondrialnej, które uwalnia proton, przyczyniłoby się do wzrostu ΔpH, a w konsekwencji do transportu pirogronianu do macierzy. Przylegając do wewnętrznej błony mitochondrialnej, stosunek działania masowego LDH (tj. stężenie produktów/stężenie reakcji) mógłby być w dużym stopniu ułatwiony przez „odpływ” pirogronianu, ponieważ jest on stale transportowany przez nieprzepuszczalną dla mleczanu wewnętrzną błonę mitochondrialną, jak również obfitą regenerację NAD+ przez pozamacierzową dehydrogenazę jabłczanową MAS. W tym modelu, transport pirogronianu przez wewnętrzną błonę mitochondrialną miałby bezpośredni wpływ na tempo utleniania mleczanu tuż poza macierzą. Oczekiwałoby się zatem, że utlenianie mleczanu w mitochondriach będzie regulowane pośrednio przez reakcję PDH w macierzy. Byłoby to korzystne, ponieważ w przeciwieństwie do LDH, PDH jest silnie regulowana poprzez allosteryzację i kowalencyjne modyfikacje. Jak wspomniano, modelowanie przewiduje, że wysoka aktywność PDH dyktuje neuronalne zużycie mleczanu in vivo (Neves i in., 2012); a wysoka aktywność PDH również charakteryzuje neurony zużywające mleczan w kulturze (Halim i in., 2010).
Rozważania metodologiczne
Jeśli mitochondrialne utlenianie mleczanu jest funkcjonalnie związane z aktywnością MAS, wówczas ważne byłoby uwzględnienie składników MAS w analizach in vitro dotyczących mitochondrialnego utleniania mleczanu, takich jak sam jabłczan lub oksalooctan. Prawdopodobnym wyborem jest jabłczan, ponieważ jest on rutynowo włączany do stymulacji oddychania in vitro, gdzie jest transportowany do macierzy i utleniany przez mitochondrialną dehydrogenazę jabłczanową do oksalooctanu. Ten oksalooctan może następnie kondensować z acetylo-CoA powstałym na przykład po dodaniu pirogronianu. Włączenie glutaminianu oprócz jabłczanu, pozwala na pełne działanie MAS na poziomie oddychania mitochondrialnego. Ważnym, ale czasami pomijanym aspektem właściwej oceny mitochondrialnego utleniania mleczanu jest włączenie NAD+ jako niezbędnego kofaktora dla reakcji LDH oraz ADP jako akceptora fosforanu w celu pobudzenia fosforylacji oksydacyjnej (tj. stan 3 oddychania). Ponadto, pozamacierzowy składnik MAS obejmuje reakcję dehydrogenazy jabłczanowej: oksalooctan + NADH + H+ ⇌ jabłczan + NAD+. Protokoły eksperymentalne badające respiracyjne zużycie tlenu w izolowanych mitochondriach z mięśni, wykorzystujące wysokie stężenia jabłczanu (np. 4 mM; Rasmussen i in., 2002), mogą sprzyjać reakcji dehydrogenazy jabłczanowej w odwrotnym kierunku (tj. utlenianiu jabłczanu i wytwarzaniu NADH + H+), gdy są dodawane do próbki mitochondrialnej w połączeniu z NAD+. Rzeczywiście, odwracalność MAS została zaobserwowana w izolowanych hepatocytach (Berry, 1971) i mitochondriach z odtworzonym MAS (Kunz i Davis, 1991). Efektem netto tego odwrócenia MAS na oddychanie byłaby redukcja malonianu z wejścia do mitochondriów, tworząc oxaloacetate. Co ważniejsze, odwrócenie to zapobiegłoby utlenianiu mleczanu do pirogronianu, a następnie transportowi i utlenianiu pirogronianu w macierzy. Rozwiązania tych metodologicznych barier w obserwowaniu mitochondrialnego utleniania mleczanu in vitro wymagają włączenia przynajmniej jednego składnika MAS. W przypadku dodania jabłczanu, odpowiednie stężenie powinno być ustalone doświadczalnie. Włączenie ADP i NAD+ lub NADH (przypomnijmy, MAS będzie generował NAD+ dla reakcji LDH) jest również konieczne do zaobserwowania znaczącego utleniania mleczanu w mitochondriach.
Podsumowanie
MAS mleczanu jest interakcją pomiędzy czółenkami mleczanu i jabłczanu-asparaginianu w celu przeniesienia mocy redukującej do mitochondriów, szczególnie w obrębie utleniających, metabolicznie aktywnych komórek.
Oświadczenie o konflikcie interesów
Autor oświadcza, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Wielkie podziękowania dla Dr. Ericha Gnaigera (Medical University of Innsbruck), oraz Dr. George’a Brooksa (University of California, Berkeley) za każdą krytykę wcześniejszych szkiców tej pracy.
Barros, L. F. (2013). Metaboliczna sygnalizacja przez mleczan w mózgu. Trends Neurosci. 36, 396-404. doi: 10.1016/j.tins.2013.04.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bergman, B. C., Wolfel, E. E., Butterfield, G. E., Lopaschuk, G. D., Casazza, G. A., Horning, M. A., et al. (1999). Active muscle and whole body lactate kinetics after endurance training in men. J. Appl. Physiol. (1985) 87, 1684-1696.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Berry, M. N. (1971). Energy-dependent reduction of pyruvate to lactate by intact isolated parenchymal cells from rat liver. Biochem. Biophys. Res. Commun. 44, 1449-1456. doi: 10.1016/S0006-291X(71)80248-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Boumezbeur, F., Petersen, K. F., Cline, G. W., Mason, G. F., Behar, K. L., Shulman, G. I., et al. (2010). The contribution of blood lactate to brain energy metabolism in humans measured by dynamic 13C nuclear magnetic resonance spectroscopy. J. Neurosci. 30, 13983-13991. doi: 10.1523/JNEUROSCI.2040-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., and Pellerin, L. (2013). Unraveling the complex metabolic nature of astrocytes. Front. Cell. Neurosci. 7:179. doi: 10.3389/fncel.2013.00179
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., Voisin, P., Bouchaud, V., Bezancon, E., Franconi, J. M., and Pellerin, L. (2006). Competition between glucose and lactate as oxidative energy substrates in both neurons and astrocytes: a comparative NMR study. Eur. J. Neurosci. 24, 1687-1694. doi: 10.1111/j.1460-9568.2006.05056.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (1998). Mammalian fuel utilization during sustained exercise. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 120, 89-107. doi: 10.1016/S0305-0491(98)00025-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2009). Komórkowo-komórkowe i wewnątrzkomórkowe wahadła mleczanowe. J. Physiol. 587, 5591-5600. doi: 10.1113/jphysiol.2009.178350
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2014). „Systemy metaboliczne: powstawanie i wykorzystanie mleczanu”, w Historia fizjologii wysiłku fizycznego. Human Kinetics, ed C. M. Tipton (Champaign, IL: Human Kinetics), 447-475.
Google Scholar
Brooks, G. A., Butterfield, G. E., Wolfe, R. R., Groves, B. M., Mazzeo, R. S., Sutton, J. R., et al. (1991). Decreased reliance on lactate during exercise after acclimatization to 4,300 m. J. Appl. Physiol. (1985). 71, 333-341.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Brooks, G. A., Dubouchaud, H., Brown, M., Sicurello, J. P., and Butz, C. E. (1999). Role of mitochondrial lactate dehydrogenase and lactate oxidation in the intracellular lactate shuttle. Proc. Natl. Acad. Sci. U.S.A. 96, 1129-1134. doi: 10.1073/pnas.96.3.1129
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Chatham, J. C., Des Rosiers, C., and Forder, J. R. (2001). Dowody na istnienie oddzielnych ścieżek wychwytu i uwalniania mleczanu przez perfundowane serce szczura. Am. J. Physiol. Endocrinol. Metab. 281, E794-E802.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Contreras, L., and Satrustegui, J. (2009). Calcium signaling in brain mitochondria: interplay of malate aspartate NADH shuttle and calcium uniporter/mitochondrial dehydrogenase pathways. J. Biol. Chem. 284, 7091-7099. doi: 10.1074/jbc.M808066200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Crabtree, B., and Newsholme, E. A. (1978). Sensitivity of a near-equilibrium reaction in a metabolic pathway to changes in substrate concentration. Eur. J. Biochem. 89, 19-22. doi: 10.1111/j.1432-1033.1978.tb20891.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Cruz, R. S., de Aguiar, R. A., Turnes, T., Penteado Dos Santos, R., de Oliveira, M. F., and Caputo, F. (2012). Intracellular shuttle: the lactate aerobic metabolism. ScientificWorldJournal 2012:420984. doi: 10.1100/2012/420984
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Dienel, G. A. (2012). Brain lactate metabolism: the discoveries and the controversies. J. Cereb. Blood Flow Metab. 32, 1107-1138. doi: 10.1038/jcbfm.2011.175
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Digerness, S. B., and Reddy, W. J. (1976). The malate-aspartate shuttle in heart mitochondria. J. Mol. Cell. Cardiol. 8, 779-785. doi: 10.1016/0022-2828(76)90084-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Doherty, J. R., and Cleveland, J. L. (2013). Targeting lactate metabolism for cancer therapeutics. J. Clin. Invest. 123, 3685-3692. doi: 10.1172/JCI69741
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Donovan, C. M., and Pagliassotti, M. J. (2000). Quantitative assessment of pathways for lactate disposal in skeletal muscle fiber types. Med. Sci. Sports Exerc. 32, 772-777. doi: 10.1097/00005768-200004000-00009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Elustondo, P. A., White, A. E., Hughes, M. E., Brebner, K., Pavlov, E., and Kane, D. A. (2013). Physical and functional association of lactate dehydrogenase (LDH) with skeletal muscle mitochondria. J. Biol. Chem. 288, 25309-25317. doi: 10.1074/jbc.M113.476648
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Funfschilling, U., Supplie, L. M., Mahad, D., Boretius, S., Saab, A. S., Edgar, J., et al. (2012). Glikolityczne oligodendrocyty utrzymują mielinę i długotrwałą integralność aksonalną. Nature 485, 517-521. doi: 10.1038/nature11007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Gainutdinov, T., Muth, K., Seppet, E., Orynbayeva, Z., et al. (2013). The control of brain mitochondrial energization by cytosolic calcium: the mitochondrial gas pedal. IUBMB Life 65, 180-190. doi: 10.1002/iub.1131
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Trumbekaite, S., Korzeniewski, B., Gaynutdinov, T., Seppet, E., et al. (2012). Cytosolic Ca2+ reguluje energetyzację izolowanych mitochondriów mózgowych poprzez tworzenie pirogronianu za pośrednictwem transportera jabłczan-asparaginian. Biochem. J. 443, 747-755. doi: 10.1042/BJ20110765
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gertz, E. W., Wisneski, J. A., Stanley, W. C., and Neese, R. A. (1988). Myocardial substrate utilization during exercise in humans. Dual carbon-labeled carbohydrate isotope experiments. J. Clin. Invest. 82, 2017-2025. doi: 10.1172/JCI113822
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2004). Metabolizm mleczanu: nowy paradygmat dla trzeciego tysiąclecia. J. Physiol. 558, 5-30. doi: 10.1113/jphysiol.2003.058701
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2007). Czy istnieje wewnątrzkomórkowy transfer mleczanu w mięśniach szkieletowych? J. Physiol. 582, 899. doi: 10.1113/jphysiol.2007.138487
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Halestrap, A. P. (1975). Mitochondrialny transporter pirogronianu. Kinetyka i specyficzność dla substratów i inhibitorów. Biochem. J. 148, 85-96.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Halim, N. D., McFate, T., Mohyeldin, A., Okagaki, P., Korotchkina, L. G., Patel, M. S., et al. (2010). Phosphorylation status of pyruvate dehydrogenase distinguishes metabolic phenotypes of cultured rat brain astrocytes and neurons. Glia 58, 1168-1176. doi: 10.1002/glia.20996
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Jacobs, R. A., Meinild, A. K., Nordsborg, N. B., and Lundby, C. (2013). Lactate oxidation in human skeletal muscle mitochondria. Am. J. Physiol. Endocrinol. Metab. 304, E686-E689. doi: 10.1152/ajpendo.00476.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Joubert, F., Mateo, P., Gillet, B., Beloeil, J. C., Mazet, J. L., and Hoerter, J. A. (2004). CK flux or direct ATP transfer: versatility of energy transfer pathways evidenced by NMR in the perfused heart. Mol. Cell. Biochem. 256-257, 43-58. doi: 10.1023/B:MCBI.0000009858.41434.fc
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kauppinen, R. A., Sihra, T. S., and Nicholls, D. G. (1987). Aminooxyacetic acid hamuje malate-aspartate shuttle w izolowanych terminali nerwowych i zapobiega mitochondria od wykorzystania substratów glikolitycznych. Biochim. Biophys. Acta 930, 173-178. doi: 10.1016/0167-4889(87)90029-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kitaoka, Y., Hoshino, D., and Hatta, H. (2012). Monocarboxylate transporter and lactate metabolism. J. Phys. Fitness Sports Med. 1, 247-252. doi: 10.7600/jpfsm.1.247
CrossRef Full Text | Google Scholar
Kline, E. S., Brandt, R. B., Laux, J. E., Spainhour, S. E., Higgins, E. S., Rogers, K. S., et al. (1986). Localization of L-lactate dehydrogenase in mitochondria. Arch. Biochem. Biophys. 246, 673-680. doi: 10.1016/0003-9861(86)90323-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kunz, W. S., and Davis, E. J. (1991). Control of reversible intracellular transfer of reducing potential. Arch. Biochem. Biophys. 284, 40-46. doi: 10.1016/0003-9861(91)90260-P
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Luft, F. C. (2001). Aktualizacja dotycząca kwasicy mleczanowej dla klinicystów opieki krytycznej. J. Am. Soc. Nephrol. 12 Suppl 17: S15-S19.
Pubmed Abstract | Pubmed Full Text | Google Scholar
McKenna, M. C., Tildon, J. T., Stevenson, J. H., Boatright, R., and Huang, S. (1993). Regulation of energy metabolism in synaptic terminals and cultured rat brain astrocytes: differences revealed using aminooxyacetate. Dev. Neurosci. 15, 320-329. doi: 10.1159/000111351
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
McKenna, M. C., Waagepetersen, H. S., Schousboe, A., and Sonnewald, U. (2006). Neuronal and astrocytic shuttle mechanisms for cytosolic-mitochondrial transfer of reducing equivalents: current evidence and pharmacological tools. Biochem. Pharmacol. 71, 399-407. doi: 10.1016/j.bcp.2005.10.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Neves, A., Costalat, R., and Pellerin, L. (2012). Determinants of brain cell metabolic phenotypes and energy substrate utilization unraveled with a modeling approach. PLoS Comput. Biol. 8:e1002686. doi: 10.1371/journal.pcbi.1002686
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Newington, J. T., Harris, R. A., and Cumming, R. C. (2013). Reevaluating metabolism in alzheimer’s disease from the perspective of the astrocyte-neuron lactate shuttle model. J. Neurodegener. Dis. 2013, 13. doi: 10.1155/2013/234572
CrossRef Full Text | Google Scholar
Nguyen, N. H., Brathe, A., and Hassel, B. (2003). Neuronal uptake and metabolism of glycerol and the neuronal expression of mitochondrial glycerol-3-phosphate dehydrogenase. J. Neurochem. 85, 831-842. doi: 10.1046/j.1471-4159.2003.01762.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
O’Donnell, J. M., Kudej, R. K., LaNoue, K. F., Vatner, S. F., and Lewandowski, E. D. (2004). Limited transfer of cytosolic NADH into mitochondria at high cardiac workload. Am. J. Physiol. Heart Circ. Physiol. 286, H2237-H2242. doi: 10.1152/ajpheart.01113.2003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Palaiologos, G., Hertz, L., and Schousboe, A. (1988). Evidence that aspartate aminotransferase activity and ketodicarboxylate carrier function are essential for biosynthesis of transmitter glutamate. J. Neurochem. 51, 317-320. doi: 10.1111/j.1471-4159.1988.tb04872.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Papa, S., Francavilla, A., Paradies, G., and Meduri, B. (1971). Transport pirogronianu w mitochondriach wątroby szczura. FEBS Lett. 12, 285-288. doi: 10.1016/0014-5793(71)80200-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pardo, B., Contreras, L., Serrano, A., Ramos, M., Kobayashi, K., Iijima, M., et al. (2006). Essential role of aralar in the transduction of small Ca2+ signals to neuronal mitochondria. J. Biol. Chem. 281, 1039-1047. doi: 10.1074/jbc.M507270200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pellerin, L., and Magistretti, P. J. (2012). Słodka szesnastka dla ANLS. J. Cereb. Blood Flow Metab. 32, 1152-1166. doi: 10.1038/jcbfm.2011.149
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., and Grunnet, N. (2011a). High brain lactate is not caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U.S.A. 108, E21. odpowiedź autora: E22. doi: 10.1073/pnas.1017750108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., and Grunnet, N. (2011b). The isoenzyme pattern of LDH does not play a physiological role; except perhaps during fast transitions in energy metabolism. Aging (Albany, NY) 3, 457-460.
Google Scholar
Quistorff, B., Secher, N. H., and Van Lieshout, J. J. (2008). Lactate fuels the human brain during exercise. FASEB J. 22, 3443-3449. doi: 10.1096/fj.08-106104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Ramos, M., del Arco, A., Pardo, B., Martinez-Serrano, A., Martinez-Morales, J. R., Kobayashi, K., et al. (2003). Developmental changes in the Ca2+-regulated mitochondrial aspartate-glutamate carrier aralar1 in brain and prominent expression in the spinal cord. Brain Res. Dev. Brain Res. 143, 33-46. doi: 10.1016/S0165-3806(03)00097-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rasmussen, H. N., van Hall, G., and Rasmussen, U. F. (2002). Dehydrogenaza mleczanowa nie jest enzymem mitochondrialnym w ludzkim i mysim mięśniu vastus lateralis. J. Physiol. 541, 575-580. doi: 10.1113/jphysiol.2002.019216
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Robergs, R. A., Ghiasvand, F., and Parker, D. (2004). Biochemia kwasicy metabolicznej indukowanej wysiłkiem fizycznym. Am. J. Physiol. Regul. Integr. Comp. Physiol. 287, R502-R516. doi: 10.1152/ajpregu.00114.2004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rueda, C. B., Llorente-Folch, I., Amigo, I., Contreras, L., Gonzalez-Sanchez, P., Martinez-Valero, P., et al. (2014). Ca2+ regulation of mitochondrial function in neurons. Biochim. Biophys. Acta 1837, 1617-1624. doi: 10.1016/j.bbabio.2014.04.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Safer, B., Smith, C. M., and Williamson, J. R. (1971). Control of the transport of reducing equivalents across the mitochondrial membrane in perfused rat heart. J. Mol. Cell. Cardiol. 2, 111-124. doi: 10.1016/0022-2828(71)90065-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sampol, D., Ostrofet, E., Jobin, M. L., Raffard, G., Sanchez, S., Bouchaud, V., et al. (2013). Glucose and lactate metabolism in the awake and stimulated rat: a (13)C-NMR study. Front. Neuroenergetics 5:5. doi: 10.3389/fnene.2013.00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Santo-Domingo, J., and Demaurex, N. (2012). Perspectives on: SGP symposium on mitochondrial physiology and medicine: the renaissance of mitochondrial pH. J. Gen. Physiol. 139, 415-423. doi: 10.1085/jgp.201110767
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Schantz, P. G. (1986). Plastyczność ludzkich mięśni szkieletowych ze szczególnym uwzględnieniem wpływu treningu fizycznego na poziom enzymów czółenek NADH oraz fenotypową ekspresję wolnych i szybkich białek miofibrylarnych. Acta Physiol. Scand. Suppl. 558, 1-62.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Schurr, A. (2014). Mózgowa glikoliza: wiek uporczywego niezrozumienia i błędnego rozumowania. Front. Neurosci. 8:360. doi: 10.3389/fnins.2014.00360
CrossRef Full Text | Google Scholar
Schurr, A., West, C. A., and Rigor, B. M. (1988). Lactate-supported synaptic function in the rat hippocampal slice preparation. Science 240, 1326-1328. doi: 10.1126/science.3375817
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Skilleter, D. N., and Kun, E. (1972). The oxidation of L-lactate by liver mitochondria. Arch. Biochem. Biophys. 152, 92-104. doi: 10.1016/0003-9861(72)90197-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Spriet, L. L., Howlett, R. A., and Heigenhauser, G. J. (2000). An enzymatic approach to lactate production in human skeletal muscle during exercise. Med. Sci. Sports Exerc. 32, 756-763. doi: 10.1097/00005768-200004000-00007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Stainsby, W. N., and Brooks, G. A. (1990). Control of lactic acid metabolism in contracting muscles and during exercise. Exerc. Sport Sci. Rev. 18, 29-63. doi: 10.1249/00003677-199001000-00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sun, F., Dai, C., Xie, J., and Hu, X. (2012). Biochemiczne problemy w szacowaniu stosunku cytozolowego wolnego NAD/NADH. PLoS ONE 7:e34525. doi: 10.1371/journal.pone.0034525
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Todd, J. J. (2014). Mleczan: cenny dla wydajności fizycznej i utrzymania funkcji mózgu podczas ćwiczeń. Biosci. Horiz. 7, 1-7. doi: 10.1093/biohorizons/hzu001
CrossRef Full Text | Google Scholar
van Hall, G. (2010). Kinetyka mleczanu w tkankach ludzkich w spoczynku i podczas wysiłku. Acta Physiol. (Oxf.) 199, 499-508. doi: 10.1111/j.1748-1716.2010.02122.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
van Hall, G., Stromstad, M., Rasmussen, P., Jans, O., Zaar, M., Gam, C., et al. (2009). Blood lactate is an important energy source for the human brain. J. Cereb. Blood Flow Metab. 29, 1121-1129. doi: 10.1038/jcbfm.2009.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Voet, D., Voet, J. G., and Pratt, C. W. (2011). Podstawy biochemii: Life at the Molecular Level. Hoboken, NJ: Wiley.
Google Scholar
Williamson, D. H., Lund, P., and Krebs, H. A. (1967). The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver. Biochem. J. 103, 514-527.
Pubmed Abstract | Pubmed Full Text | Google Scholar
.