- Introducción: La reacción de la lactato deshidrogenasa
- La lanzadera de malato-aspartato
- La glucólisis (an)aeróbica convencional
- El concepto de transporte de lactato
- Compartimentación intracelular de la LDH: lecciones del transporte de fosfocreatina
- Compartimentación intercelular del metabolismo del lactato: la lanzadera de lactato entre astrocitos y neuronas
- Regeneración del NAD+ citosólico
- Desplazamiento de protones y transporte de sustrato mitocondrial
- Consideraciones metodológicas
- Resumen
- Declaración de conflicto de intereses
- Agradecimientos
Introducción: La reacción de la lactato deshidrogenasa
La reducción de piruvato a lactato, catalizada por la lactato deshidrogenasa (LDH; Piruvato + NADH + H+ ⇌ Lactato + NAD+) en el citosol de muchas células, se ha considerado un «callejón sin salida» metabólico (Luft, 2001; Quistorff y Grunnet, 2011a), o quizás más apropiadamente, un cul de sac metabólico (Barros, 2013), porque el lactato sólo puede reincorporarse a la red metabólica a través del piruvato. En los mamíferos, la reacción de la LDH también se considera que está «cerca del equilibrio» (Spriet et al., 2000; Quistorff y Grunnet, 2011a,b), lo que significa que la reacción está regulada principalmente por las concentraciones de sus reactivos y productos, en lugar de por medios más sofisticados de regulación alostérica o modificación covalente (Crabtree y Newsholme, 1978). Debido a que el equilibrio para la reacción de la LDH se encuentra muy a la derecha (es decir, se favorece la formación de lactato) (Williamson et al., 1967), independientemente de la isoforma de la LDH (Quistorff y Grunnet, 2011a,b), la implicación podría ser que la LDH rara vez favorece la reacción inversa (es decir, la oxidación del lactato) in vivo. De hecho, la relación de acción de masas (/) necesaria para una oxidación apreciable del lactato tendría que superar la constante de equilibrio de la LDH. Sin embargo, las pruebas experimentales desmienten cada vez más la idea de que la LDH funciona de forma unidireccional in vivo, y apoyan que el lactato sirve como un importante combustible metabólico para muchos tejidos, incluido el esquelético (Brooks et al., 1991; Bergman et al., 1999; Donovan y Pagliassotti, 2000) y el músculo cardíaco (Gertz et al., 1988; Chatham et al., 2001), el hígado (Skilleter y Kun, 1972; Kline et al., 1986) y el cerebro (Schurr et al., 1988; Bouzier-Sore et al., 2006; Wyss et al., 2011; Funfschilling et al., 2012; revisado en Barros, 2013). El propósito de la presente Perspectiva es presentar un modelo en el que el lactato es fundamental para el traslado de sustrato energético entre el citosol (glucólisis) y la mitocondria (fosforilación oxidativa). Los componentes de este concepto se han demostrado en el corazón (Safer et al., 1971) y en el músculo esquelético (Schantz, 1986), se ampliaron posteriormente a una perspectiva de transporte de lactato (Stainsby y Brooks, 1990; Brooks et al., 1999) y se revisaron exhaustivamente (Gladden, 2004) y se volvieron a comentar (Gladden, 2007). El concepto está especialmente respaldado por investigaciones recientes en células neuronales (Gellerich et al., 2012, 2013; Rueda et al., 2014). Aunque el concepto esbozado en la presente Perspectiva no es nuevo, per se (Safer et al, 1971), la aparente falta de reconocimiento convencional o de aceptación de sus fundamentos teóricos, justifica una mayor atención.
La lanzadera de malato-aspartato
Debido a la impermeabilidad de la membrana mitocondrial interna al NAD+ y al NADH, el NADH generado por la glucólisis en condiciones aeróbicas depende de la transferencia indirecta de equivalentes reductores a la mitocondria a través de la lanzadera de malato-aspartato (MAS) y de la lanzadera de glicerol-fosfato. Se cree que estas lanzaderas también regeneran el NAD+ citosólico necesario para apoyar el flujo glicolítico en la reacción de la gliceraldehído 3-fosfato deshidrogenasa que requiere NAD+. Se ha demostrado que el MAS es el medio predominante por el que esto ocurre en la mayoría de los tejidos oxidativos, y parece constituir el principal transportador de NADH en las neuronas maduras (Kauppinen et al., 1987; Ramos et al., 2003; Contreras y Satrustegui, 2009; Gellerich et al., 2012). También está bien establecido que durante condiciones de aumento de la demanda de energía celular y/o aumento del flujo glucolítico (por ejemplo, durante el ejercicio extenuante), así como la hipoxia, que la concentración de lactato se incrementará como la reacción de LDH facilita el aumento de las tasas de regeneración de NAD + citosólica (Robergs et al., 2004). En el cerebro, sin embargo, el aumento de la concentración de lactato en la circulación (por ejemplo, durante el ejercicio) da lugar a un aumento de la eliminación de lactato en el cerebro (Quistorff et al., 2008; van Hall et al., 2009; Boumezbeur et al., 2010; Dienel, 2012). También se ha sugerido que el aumento de la actividad de la LDH (y, a su vez, la producción de lactato) simplemente compensa la incapacidad de la MAS para seguir el ritmo de la demanda citosólica de NAD+ (Schantz, 1986). En las neuronas, la activación por Ca+2 del MAS y del ciclo del TCA son competitivos, de manera que los niveles más bajos de Ca+2 estimulan la actividad del MAS mediante la activación del transportador de glutamato/aspartato (Contreras y Satrustegui, 2009), mientras que las concentraciones más altas de Ca+2 activan la α-cetoglutarato deshidrogenasa en la matriz mitocondrial, limitando el α-cetoglutarato disponible para el MAS (Contreras y Satrustegui, 2009). También es posible que el lactato se forme continuamente en el citosol, independientemente del estado metabólico, y que el lactato oxidado en la mitocondria se acople al MAS. En las mitocondrias cardíacas aisladas, por ejemplo, el MAS muestra un exceso de capacidad, lo que sugiere que la actividad del MAS por sí sola es suficiente para mantener la regeneración citosólica de NAD+ (Digerness y Reddy, 1976). ¿Por qué, entonces, en reposo y en condiciones totalmente aeróbicas, se produciría lactato durante la glucólisis, si todo el piruvato debería ir a las mitocondrias para la fosforilación oxidativa, y el MAS debería estar regenerando suficiente NAD+?
La glucólisis (an)aeróbica convencional
La aparición y desaparición del lactato durante los diferentes estados metabólicos ha sido un tema de muchas conjeturas, controversias e intrigas históricas. Ha habido muchas revisiones de la literatura que examinan el metabolismo del lactato, a las que los lectores pueden dirigirse. Algunas de las más recientes son (Cruz et al., 2012; Dienel, 2012; Kitaoka et al., 2012; Doherty y Cleveland, 2013; Newington et al., 2013; Brooks, 2014; Schurr, 2014; Todd, 2014). Por desgracia, muchos libros de texto contemporáneos siguen utilizando el destino metabólico del piruvato para distinguir dos tipos de glucólisis: aeróbica (es decir, que requiere oxígeno) y anaeróbica (es decir, sin oxígeno). En presencia de oxígeno, se ha dicho, el piruvato se dirigirá a las mitocondrias para encontrar su muerte metabólica a través de la fosforilación oxidativa, cuyo resultado neto es la resíntesis de ATP mitocondrial y el consumo de oxígeno (es decir, la respiración) (Voet et al., 2011). Por el contrario, cuando el oxígeno es limitante, el piruvato es reducido a lactato en el citosol por la LDH, oxidando su cofactor NADH en el proceso (Voet et al., 2011). Un problema con esta construcción tradicional es que no se concilia bien con algunas observaciones científicas recurrentes. Por ejemplo, está bien establecido que el lactato se produce, y se consume, en condiciones totalmente aeróbicas. De hecho, en individuos sanos y normóxicos en reposo en el estado postabsortivo, se puede esperar que se liberen aproximadamente 50 μmol-min-1 de lactato sólo del cerebro (van Hall et al., 2009; van Hall, 2010). Claramente, el lactato es más que un metabolito de desecho sin salida de la glucólisis anaeróbica; más bien, el transporte de lactato a través del organismo proporciona una perspectiva útil para interpretar la observación experimental.
El concepto de transporte de lactato
Se han propuesto dos conceptos de transporte de lactato que describen el movimiento y la utilización del lactato dentro y entre las células (Brooks, 1998). La hipótesis del transporte de lactato intracelular postula que el lactato formado durante la glucólisis puede utilizarse continuamente como fuente de energía dentro de la misma célula (Brooks, 1998). El transporte de lactato intercelular, o célula-célula, implica que el lactato generado y exportado desde una célula es tomado y utilizado por otra célula (Brooks, 1998). La transferencia de lactato célula-célula ha sido generalmente aceptada; sin embargo, los detalles más finos de la transferencia de lactato intracelular siguen siendo investigados. Recientemente, hemos demostrado una asociación tanto física como funcional de la LDH con las mitocondrias en el músculo esquelético (Elustondo et al., 2013). Mediante microscopía confocal de barrido láser, confirmamos la colocalización de la LDH con las proteínas de la membrana mitocondrial en el músculo esquelético de rata. Descubrimos que las mitocondrias de las fibras musculares esqueléticas de rata permeabilizadas con saponina oxidaban el lactato en presencia de NAD+, malato y ADP (Elustondo et al., 2013); otro grupo descubrió lo mismo en fibras humanas (Jacobs et al., 2013). El piruvato era entonces transportado a las mitocondrias, donde era oxidado por la piruvato deshidrogenasa (PDH), y luego por el ciclo TCA, con equivalentes reductores que estimulaban la respiración (Elustondo et al., 2013; Jacobs et al., 2013). Fuimos capaces de inhibir la respiración con sólo 5μM de alfa-ciano-hidroxicinamato, un inhibidor del transporte mitocondrial de piruvato, apoyando aún más que el piruvato, pero no el lactato es transportado a la matriz mitocondrial. Estos hallazgos apoyan que la LDH está estratégicamente posicionada para interactuar funcionalmente con las mitocondrias, y sugieren que la oxidación del lactato se produce cerca de la superficie externa de la membrana mitocondrial interna. ¿Cómo podría funcionar una lanzadera de lactato intracelular en una célula intacta? Volvamos al MAS.
In vivo, el NAD+ citosólico podría, en teoría, ser regenerado por la malato deshidrogenasa fuera de la matriz mitocondrial, como parte del MAS. La bibliografía ofrece algunos datos sobre diferentes tejidos y sus actividades de desplazamiento mitocondrial. En el cerebro, el MAS se ha considerado el sistema de transporte más importante para llevar el NADH citosólico a las mitocondrias (McKenna et al., 2006, y sus referencias); por el contrario, el transporte de glicerol-fosfato parece ser de menor importancia (Nguyen et al., 2003). De hecho, se ha informado de la íntima asociación del MAS y la biosíntesis del neurotransmisor glutamato (Palaiologos et al., 1988). Las actividades publicadas del MAS medidas en mitocondrias aisladas de cerebro de rata son del orden de 26,7 nmol-min-1-mg-1 (Pardo et al., 2006). En los sinaptosomas, la inhibición farmacológica del MAS da lugar a una disminución pronunciada (es decir, del 50%) de la oxidación del lactato (McKenna et al., 1993), lo que apoya el modelo ilustrado en la Figura 1. La producción intracerebral de lactato a partir de glucosa marcada con 13C apoya aún más la noción de que el lactato es un combustible importante para las neuronas (Sampol et al., 2013).
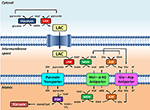
Figura 1. Representación esquemática del vínculo entre la glucólisis y la oxidación del lactato en la mitocondria esbozada en esta Perspectiva. En general, la glucólisis produce piruvato y NADH, además de ATP. El NAD+ puede regenerarse para la glucólisis mediante la reducción del piruvato a lactato (LAC) por la lactato deshidrogenasa (LDH). El LAC puede difundirse a la mitocondria donde es oxidado a piruvato por la LDH. El NAD+ es regenerado por la malato deshidrogenasa (MDH) de la lanzadera malato-aspartato. Posteriormente, el piruvato es transportado a través de la membrana mitocondrial interna hacia la matriz, donde es oxidado por la piruvato deshidrogenasa (PDH) a acetil CoA. Abreviaturas: α-KG, alfa-cetoglutarato; Glu, glutamato; AAT, aspartato-aminotransferasa; OAA, oxaloacetato; Mal, malato.
Hay que tener en cuenta que el MAS puede tener sus límites. A altas cargas de trabajo cardíacas, se ha demostrado que el transportador de α-cetoglutarato/malato de la membrana mitocondrial interna no puede competir con la α-cetoglutarato deshidrogenasa de la matriz por su sustrato compartido, el α-cetoglutarato (O’Donnell et al., 2004). Esto resulta en un efecto limitante para la MAS y su traslado de NADH a la mitocondria. El efecto neto de esta limitación para el MAS sería un aumento de la concentración de lactato citosólico, ya que la regeneración de NAD+ a través de la reacción de LDH ayudaría a preservar el NAD+/NADH homeostático, incluso en presencia de oxígeno adecuado. De hecho, este es el fenómeno clásico observado durante el ejercicio especialmente extenuante en el que el lactato puede acumularse en la sangre, a pesar de la adecuada disponibilidad de oxígeno.
Compartimentación intracelular de la LDH: lecciones del transporte de fosfocreatina
La noción de transporte de compuestos entre la mitocondria y el citosol para satisfacer las demandas energéticas de la célula utilizando enzimas de casi equilibrio no es ciertamente nueva. En el transporte de fosfocreatina (PCr) intervienen distintas isoformas de creatina quinasa (CK) mitocondrial y citosólica para transportar fosfato de «alta energía» de la mitocondria al citosol. Al igual que la reacción de la LDH, la reacción de la CK (fosfocreatina + ADP + H+ ⇌ creatina + ATP), se considera «casi en equilibrio», favoreciendo la resíntesis de ATP. Sin embargo, las pruebas experimentales demuestran que, en las células miocárdicas, sólo la CK citosólica está realmente en equilibrio o cerca de él (revisado en Joubert et al., 2004). Por otro lado, la CK mitocondrial, localizada en el espacio intermembranal, está desplazada del equilibrio, favoreciendo la resíntesis neta de PCr. Por analogía, se cree que hay dos poblaciones distintas de LDH implicadas en el transporte intracelular de lactato: la citosólica y la mitocondrial. La LDH citosólica estaría en o cerca del equilibrio, mientras que la LDH mitocondrial estaría desplazada del equilibrio. La LDH citosólica favorecería la producción neta de lactato, mientras que la LDH mitocondrial favorecería la oxidación del lactato. Y al igual que la translocasa de nucleótidos de adenina (ANT), que transporta ADP a la matriz a través de la membrana mitocondrial interna a cambio de ATP, facilita el desplazamiento del equilibrio para la CK mitocondrial en el espacio intermembranal, también el transportador de piruvato transportaría continuamente piruvato, desplazando del equilibrio la reacción de la LDH mitocondrial (Figura 1). Este transporte de lactato se beneficiaría de la localización de la LDH en el espacio intermembranal cerca de la membrana mitocondrial interna, unida al exterior de la membrana mitocondrial externa en los sitios de contacto de la membrana mitocondrial externa e interna, o ambos. Si la oxidación intracelular del lactato se produce en las mitocondrias a través de la compartimentación, como en el caso de la lanzadera de PCr, la localización celular de la LDH dentro, en o alrededor de las mitocondrias sería una característica destacada.
Compartimentación intercelular del metabolismo del lactato: la lanzadera de lactato entre astrocitos y neuronas
Un cuerpo rico y creciente de investigación neuroenergética también apoya la existencia del metabolismo del lactato compartimentado entre las células cerebrales vecinas, es decir, astrocitos y neuronas (revisado en Pellerin y Magistretti, 2012). Una variante del transporte intercelular de lactato en general (Brooks, 2009), el transporte de lactato entre astrocitos y neuronas (Pellerin y Magistretti, 2012) se basa en la idea de que los astrocitos son predominantemente glucolíticos, mientras que las neuronas son más oxidativas (Bouzier-Sore y Pellerin, 2013 y sus referencias). Utilizando un enfoque de modelado metabólico, se argumentó que el mayor flujo metabólico a través de la PDH y las lanzaderas de NADH mitocondriales en las neuronas en comparación con los astrocitos dicta necesariamente la liberación neta de lactato por los astrocitos y la oxidación por las neuronas (Neves et al.2012), apoyando muchas observaciones experimentales (revisadas en Bouzier-Sore y Pellerin, 2013). Como se ha mencionado anteriormente, el MAS constituye el principal transportador mitocondrial de NADH en las neuronas maduras (Kauppinen et al., 1987; Ramos et al., 2003; Contreras y Satrustegui, 2009; Gellerich et al., 2012). Por lo tanto, una característica importante de la neurona consumidora de lactato bien puede ser su alta actividad MAS (Neves et al., 2012). ¿Ha llegado el momento de que exista una lanzadera de lactato-malato-aspartato? ¿Existe un apoyo teórico adicional para tal modelo en el que el lactato sirve como un equivalente reductor?
Regeneración del NAD+ citosólico
La oxidación del lactato en la mitocondria da más sentido a la glucólisis aeróbica al permitir la regeneración del NAD+ citosólico por la LDH citosólica. De hecho, la evidencia en células cultivadas apunta a una relación lactato/piruvato altamente lábil que varía para preservar el NAD+/NADH homeostático (Sun et al., 2012). Esto sería ventajoso para la célula por varias razones. En primer lugar, proporcionaría un medio inmediato para regenerar el NAD+ localmente (es decir, en el citosol, donde se produce la glucólisis); la mayor difusibilidad relativa del lactato (peso molecular = 89,07 g/mol) frente al NAD+ (peso molecular = 663,43 g/mol) significa que el lactato puede difundirse fácilmente desde la célula en condiciones de mayor flujo glucolítico (por ejemplo, ejercicio intenso, estrés hipóxico), mientras que también se dirige hacia la mitocondria. Durante tiempos de demanda de energía celular reducida, la producción continuada de lactato durante tasas mucho más bajas de flujo glucolítico todavía se utilizaría para mantener el NAD+/NADH homeostático dentro de la célula, así como para el acoplamiento continuado del traslado de lactato intracelular al MAS.
Desplazamiento de protones y transporte de sustrato mitocondrial
La oxidación de lactato en la mitocondria da sentido a la glucólisis aeróbica porque la producción de lactato en el citosol consume efectivamente un protón (Robergs et al., 2004), lo que se cree que ayuda a mitigar la acidosis metabólica asociada con el aumento del recambio de ATP y las altas tasas de glucólisis (Robergs et al., 2004). La concentración citosólica de lactato suele superar a la de piruvato en al menos 10 veces, lo que significa que el lactato, y no el piruvato, es el monocarboxilato predominante que entra en el espacio intermembrana de la mitocondria (Brooks et al., 1999). Al oxidar el lactato en el espacio intermembranal mitocondrial, se liberarían protones donde podrían contribuir al componente ΔpH de la fuerza motriz de protones mitocondrial a través de la membrana interna (Santo-Domingo y Demaurex, 2012), y/o ser transportados indirectamente a la mitocondria por el MAS. Al igual que con el transporte de fosfato inorgánico y algunos otros sustratos e iones (Santo-Domingo y Demaurex, 2012), el transporte de piruvato a través de la membrana mitocondrial interna en las mitocondrias de hígado de rata parece estar directamente acoplado al simportador de protones (o antiportador de OH) (Papa et al., 1971; Halestrap, 1975). La oxidación del lactato cerca de la superficie externa de la membrana mitocondrial interna, que libera un protón, contribuiría al ΔpH y, a su vez, al transporte de piruvato hacia la matriz. Junto a la membrana interna mitocondrial, la relación de acción de la masa de la LDH (es decir, concentraciones de productos/concentraciones de reacciones) podría verse facilitada en gran medida por el «sangrado» del piruvato a medida que se transporta continuamente a través de la membrana interna mitocondrial impermeable al lactato, así como por una generosa regeneración de NAD+ por parte de la malato deshidrogenasa extramatriz del MAS. En este modelo, el transporte de piruvato a través de la membrana mitocondrial interna influiría directamente en la tasa de oxidación del lactato fuera de la matriz. Por lo tanto, se esperaría que la oxidación del lactato en las mitocondrias estuviera regulada indirectamente en la reacción de la PDH en la matriz. Esto sería ventajoso porque, a diferencia de la LDH, la PDH está altamente regulada a través del alosterio y la modificación covalente. Como se ha mencionado, la modelización predice que una alta actividad de PDH dicta el consumo de lactato neuronal in vivo (Neves et al., 2012); y una alta actividad de PDH también caracteriza a las neuronas consumidoras de lactato en cultivo (Halim et al., 2010).
Consideraciones metodológicas
Si la oxidación mitocondrial del lactato está funcionalmente ligada a la actividad del MAS, entonces sería importante incluir componentes del MAS en los análisis in vitro de la oxidación mitocondrial del lactato, como el propio malato o el oxaloacetato. El malato es la opción más probable, ya que se incluye rutinariamente para estimular la respiración in vitro, donde es transportado a la matriz y oxidado por la malato deshidrogenasa mitocondrial a oxaloacetato. Este oxaloacetato puede entonces condensarse con el acetil coA formado, por ejemplo, cuando se añade piruvato. La inclusión de glutamato, además de malato, permite el pleno funcionamiento del MAS a nivel de la respiración mitocondrial. Un aspecto importante, pero que a veces se pasa por alto, de la evaluación adecuada de la oxidación mitocondrial del lactato es la inclusión del NAD+ como cofactor necesario para la reacción de la LDH, y del ADP como aceptor de fosfato para estimular la fosforilación oxidativa (es decir, la respiración de estado 3). Además, el componente extra-matriz del MAS implica la reacción de la malato deshidrogenasa: oxaloacetato + NADH + H+ ⇌ malato + NAD+. Los protocolos experimentales que examinan el consumo respiratorio de oxígeno en mitocondrias aisladas del músculo utilizando altas concentraciones de malato (por ejemplo, 4 mM; Rasmussen et al., 2002), pueden favorecer la reacción de la malato deshidrogenasa en la dirección inversa (es decir, la oxidación del malato y la producción de NADH + H+) cuando se añade a la muestra mitocondrial en combinación con NAD+. De hecho, se ha observado la reversibilidad del MAS en hepatocitos aislados (Berry, 1971) y en mitocondrias con MAS reconstituido (Kunz y Davis, 1991). El efecto neto de esta reversión del MAS en la respiración sería reducir el malato que entra en la mitocondria, formando oxaloacetato. Y lo que es más importante, la inversión impediría la oxidación del lactato a piruvato, y el posterior transporte y oxidación del piruvato en la matriz. Las soluciones a estas barreras metodológicas para observar la oxidación del lactato mitocondrial in vitro implican incluir al menos un componente del MAS. Si se añade malato, la concentración adecuada debe determinarse experimentalmente. La inclusión de ADP y NAD+ o NADH (recordemos que el MAS generará NAD+ para la reacción de LDH) es necesaria también para observar una oxidación mitocondrial del lactato apreciable.
Resumen
Un lactato-MAS es la interacción entre las lanzaderas de lactato y malato-aspartato para translocar el poder reductor a la mitocondria, particularmente dentro de las células oxidativas y metabólicamente activas.
Declaración de conflicto de intereses
El autor declara que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Muchas gracias al Dr. Erich Gnaiger (Universidad Médica de Innsbruck), y al Dr. George Brooks (Universidad de California, Berkeley) por cada una de las críticas a los borradores anteriores de este trabajo.
Barros, L. F. (2013). Señalización metabólica por lactato en el cerebro. Trends Neurosci. 36, 396-404. doi: 10.1016/j.tins.2013.04.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bergman, B. C., Wolfel, E. E., Butterfield, G. E., Lopaschuk, G. D., Casazza, G. A., Horning, M. A., et al. (1999). Active muscle and whole body lactate kinetics after endurance training in men. J. Appl. Physiol. (1985) 87, 1684-1696.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Berry, M. N. (1971). Reducción dependiente de energía de piruvato a lactato por células parenquimatosas aisladas intactas de hígado de rata. Biochem. Biophys. Res. Commun. 44, 1449-1456. doi: 10.1016/S0006-291X(71)80248-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Boumezbeur, F., Petersen, K. F., Cline, G. W., Mason, G. F., Behar, K. L., Shulman, G. I., et al. (2010). La contribución del lactato sanguíneo al metabolismo energético del cerebro en los seres humanos medido por espectroscopia de resonancia magnética nuclear 13C dinámica. J. Neurosci. 30, 13983-13991. doi: 10.1523/JNEUROSCI.2040-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., and Pellerin, L. (2013). Desentrañando la compleja naturaleza metabólica de los astrocitos. Front. Cell. Neurosci. 7:179. doi: 10.3389/fncel.2013.00179
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., Voisin, P., Bouchaud, V., Bezancon, E., Franconi, J. M., and Pellerin, L. (2006). Competition between glucose and lactate as oxidative energy substrates in both neurons and astrocytes: a comparative NMR study. Eur. J. Neurosci. 24, 1687-1694. doi: 10.1111/j.1460-9568.2006.05056.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (1998). Mamíferos utilización de combustible durante el ejercicio sostenido. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 120, 89-107. doi: 10.1016/S0305-0491(98)00025-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2009). Cell-cell and intracellular lactate shuttles. J. Physiol. 587, 5591-5600. doi: 10.1113/jphysiol.2009.178350
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2014). «Sistemas metabólicos: la formación y utilización del lactato», en Historia de la fisiología del ejercicio. Human Kinetics, ed C. M. Tipton (Champaign, IL: Human Kinetics), 447-475.
Google Scholar
Brooks, G. A., Butterfield, G. E., Wolfe, R. R., Groves, B. M., Mazzeo, R. S., Sutton, J. R., et al. (1991). Disminución de la dependencia del lactato durante el ejercicio tras la aclimatación a 4.300 m. J. Appl. Physiol. (1985). 71, 333-341.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Brooks, G. A., Dubouchaud, H., Brown, M., Sicurello, J. P., y Butz, C. E. (1999). Papel de la deshidrogenasa de lactato mitocondrial y la oxidación de lactato en la lanzadera de lactato intracelular. Proc. Natl. Acad. Sci. U.S.A. 96, 1129-1134. doi: 10.1073/pnas.96.3.1129
Pubmed Abstract | Pubmed Full Text | Crossef Full Text | Google Scholar
Chatham, J. C., Des Rosiers, C., and Forder, J. R. (2001). Evidence of separate pathways for lactate uptake and release by the perfused rat heart. Am. J. Physiol. Endocrinol. Metab. 281, E794-E802.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Contreras, L., and Satrustegui, J. (2009). Señalización de calcio en las mitocondrias cerebrales: interacción de las vías de transporte de malato aspartato NADH y del uniportador de calcio/deshidrogenasa mitocondrial. J. Biol. Chem. 284, 7091-7099. doi: 10.1074/jbc.M808066200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Crabtree, B., and Newsholme, E. A. (1978). Sensibilidad de una reacción cercana al equilibrio en una vía metabólica a los cambios en la concentración de sustrato. Eur. J. Biochem. 89, 19-22. doi: 10.1111/j.1432-1033.1978.tb20891.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Cruz, R. S., de Aguiar, R. A., Turnes, T., Penteado Dos Santos, R., de Oliveira, M. F., and Caputo, F. (2012). Lanzadera intracelular: el metabolismo aeróbico del lactato. ScientificWorldJournal 2012:420984. doi: 10.1100/2012/420984
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Dienel, G. A. (2012). Metabolismo del lactato cerebral: los descubrimientos y las controversias. J. Cereb. Blood Flow Metab. 32, 1107-1138. doi: 10.1038/jcbfm.2011.175
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Digerness, S. B., y Reddy, W. J. (1976). La lanzadera de malato-aspartato en las mitocondrias del corazón. J. Mol. Cell. Cardiol. 8, 779-785. doi: 10.1016/0022-2828(76)90084-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Doherty, J. R., and Cleveland, J. L. (2013). Targeting lactate metabolism for cancer therapeutics. J. Clin. Invest. 123, 3685-3692. doi: 10.1172/JCI69741
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Donovan, C. M., y Pagliassotti, M. J. (2000). Evaluación cuantitativa de las vías de eliminación de lactato en los tipos de fibras musculares esqueléticas. Med. Sci. Sports Exerc. 32, 772-777. doi: 10.1097/00005768-200004000-00009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Elustondo, P. A., White, A. E., Hughes, M. E., Brebner, K., Pavlov, E., y Kane, D. A. (2013). Asociación física y funcional de la lactato deshidrogenasa (LDH) con las mitocondrias del músculo esquelético. J. Biol. Chem. 288, 25309-25317. doi: 10.1074/jbc.M113.476648
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Funfschilling, U., Supplie, L. M., Mahad, D., Boretius, S., Saab, A. S., Edgar, J., et al. (2012). Glycolytic oligodendrocytes maintain myelin and long-term axonal integrity. Nature 485, 517-521. doi: 10.1038/nature11007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Gainutdinov, T., Muth, K., Seppet, E., Orynbayeva, Z., et al. (2013). El control de la energización mitocondrial cerebral por el calcio citosólico: el pedal de gas mitocondrial. IUBMB Life 65, 180-190. doi: 10.1002/iub.1131
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Trumbekaite, S., Korzeniewski, B., Gaynutdinov, T., Seppet, E., et al. (2012). Cytosolic Ca2+ regulates the energization of isolated brain mitochondria by formation of pyruvate through the malate-aspartate shuttle. Biochem. J. 443, 747-755. doi: 10.1042/BJ20110765
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gertz, E. W., Wisneski, J. A., Stanley, W. C., and Neese, R. A. (1988). Utilización del sustrato miocárdico durante el ejercicio en humanos. Experimentos con isótopos de carbohidratos marcados con doble carbono. J. Clin. Invest. 82, 2017-2025. doi: 10.1172/JCI113822
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2004). Metabolismo del lactato: un nuevo paradigma para el tercer milenio. J. Physiol. 558, 5-30. doi: 10.1113/jphysiol.2003.058701
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2007). ¿Existe un transporte de lactato intracelular en el músculo esquelético? J. Physiol. 582, 899. doi: 10.1113/jphysiol.2007.138487
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Halestrap, A. P. (1975). El transportador de piruvato mitocondrial. Cinética y especificidad para sustratos e inhibidores. Biochem. J. 148, 85-96.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Halim, N. D., McFate, T., Mohyeldin, A., Okagaki, P., Korotchkina, L. G., Patel, M. S., et al. (2010). El estado de fosforilación de la piruvato deshidrogenasa distingue los fenotipos metabólicos de los astrocitos y neuronas del cerebro de rata cultivados. Glia 58, 1168-1176. doi: 10.1002/glia.20996
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Jacobs, R. A., Meinild, A. K., Nordsborg, N. B., and Lundby, C. (2013). La oxidación de lactato en las mitocondrias del músculo esquelético humano. Am. J. Physiol. Endocrinol. Metab. 304, E686-E689. doi: 10.1152/ajpendo.00476.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Joubert, F., Mateo, P., Gillet, B., Beloeil, J. C., Mazet, J. L., y Hoerter, J. A. (2004). Flujo de CK o transferencia directa de ATP: versatilidad de las vías de transferencia de energía evidenciada por RMN en el corazón perfundido. Mol. Cell. Biochem. 256-257, 43-58. doi: 10.1023/B:MCBI.0000009858.41434.fc
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kauppinen, R. A., Sihra, T. S., and Nicholls, D. G. (1987). El ácido aminoxiacético inhibe el transporte de malato-aspartato en terminales nerviosas aisladas e impide que las mitocondrias utilicen sustratos glucolíticos. Biochim. Biophys. Acta 930, 173-178. doi: 10.1016/0167-4889(87)90029-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kitaoka, Y., Hoshino, D., y Hatta, H. (2012). Transportador de monocarboxilato y el metabolismo del lactato. J. Phys. Fitness Sports Med. 1, 247-252. doi: 10.7600/jpfsm.1.247
CrossRef Full Text | Google Scholar
Kline, E. S., Brandt, R. B., Laux, J. E., Spainhour, S. E., Higgins, E. S., Rogers, K. S., et al. (1986). Localization of L-lactate dehydrogenase in mitochondria. Arch. Biochem. Biophys. 246, 673-680. doi: 10.1016/0003-9861(86)90323-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kunz, W. S., y Davis, E. J. (1991). Control de la transferencia intracelular reversible del potencial reductor. Arch. Biochem. Biophys. 284, 40-46. doi: 10.1016/0003-9861(91)90260-P
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Luft, F. C. (2001). Actualización de la acidosis láctica para los clínicos de cuidados críticos. J. Am. Soc. Nephrol. 12 Suppl 17: S15-S19.
Pubmed Abstract | Pubmed Full Text | Google Scholar
McKenna, M. C., Tildon, J. T., Stevenson, J. H., Boatright, R., and Huang, S. (1993). Regulación del metabolismo energético en terminales sinápticos y astrocitos cerebrales de rata cultivados: diferencias reveladas usando aminooxiacetato. Dev. Neurosci. 15, 320-329. doi: 10.1159/000111351
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
McKenna, M. C., Waagepetersen, H. S., Schousboe, A., and Sonnewald, U. (2006). Neuronal and astrocytic shuttle mechanisms for cytosolic-mitochondrial transfer of reducing equivalents: current evidence and pharmacological tools. Biochem. Pharmacol. 71, 399-407. doi: 10.1016/j.bcp.2005.10.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Neves, A., Costalat, R., and Pellerin, L. (2012). Determinantes de los fenotipos metabólicos de las células cerebrales y la utilización de sustratos energéticos desentrañados con un enfoque de modelado. PLoS Comput. Biol. 8:e1002686. doi: 10.1371/journal.pcbi.1002686
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Newington, J. T., Harris, R. A., y Cumming, R. C. (2013). Reevaluación del metabolismo en la enfermedad de alzheimer desde la perspectiva del modelo de transporte de lactato astrocito-neurona. J. Neurodegener. Dis. 2013, 13. doi: 10.1155/2013/234572
CrossRef Full Text | Google Scholar
Nguyen, N. H., Brathe, A., y Hassel, B. (2003). Neuronal uptake and metabolism of glycerol and the neuronal expression of mitochondrial glycerol-3-phosphate dehydrogenase. J. Neurochem. 85, 831-842. doi: 10.1046/j.1471-4159.2003.01762.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
O’Donnell, J. M., Kudej, R. K., LaNoue, K. F., Vatner, S. F., and Lewandowski, E. D. (2004). Limited transfer of cytosolic NADH into mitochondria at high cardiac workload. Am. J. Physiol Heart Circ. Physiol. 286, H2237-H2242. doi: 10.1152/ajpheart.01113.2003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Palaiologos, G., Hertz, L., y Schousboe, A. (1988). Evidencia de que la actividad de la aspartato aminotransferasa y la función del transportador de cetodicarboxilato son esenciales para la biosíntesis del transmisor glutamato. J. Neurochem. 51, 317-320. doi: 10.1111/j.1471-4159.1988.tb04872.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Papa, S., Francavilla, A., Paradies, G., y Meduri, B. (1971). El transporte de piruvato en las mitocondrias de hígado de rata. FEBS Lett. 12, 285-288. doi: 10.1016/0014-5793(71)80200-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pardo, B., Contreras, L., Serrano, A., Ramos, M., Kobayashi, K., Iijima, M., et al. (2006). Papel esencial de aralar en la transducción de pequeñas señales de Ca2+ a las mitocondrias neuronales. J. Biol. Chem. 281, 1039-1047. doi: 10.1074/jbc.M507270200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pellerin, L., and Magistretti, P. J. (2012). Dulces dieciséis para el ANLS. J. Cereb. Blood Flow Metab. 32, 1152-1166. doi: 10.1038/jcbfm.2011.149
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., y Grunnet, N. (2011a). El lactato cerebral alto no es causado por un cambio en la relación lactato deshidrogenasa A/B. Proc. Natl. Acad. Sci. U.S.A. 108, E21. respuesta del autor: E22. doi: 10.1073/pnas.1017750108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., y Grunnet, N. (2011b). El patrón isoenzimático de la LDH no juega un papel fisiológico; excepto quizás durante las transiciones rápidas en el metabolismo energético. Aging (Albany, NY) 3, 457-460.
Google Scholar
Quistorff, B., Secher, N. H., y Van Lieshout, J. J. (2008). El lactato alimenta el cerebro humano durante el ejercicio. FASEB J. 22, 3443-3449. doi: 10.1096/fj.08-106104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Ramos, M., del Arco, A., Pardo, B., Martínez-Serrano, A., Martínez-Morales, J. R., Kobayashi, K., et al. (2003). Developmental changes in the Ca2+-regulated mitochondrial aspartate-glutamate carrier aralar1 in brain and prominent expression in the spinal cord. Brain Res. Dev. Brain Res. 143, 33-46. doi: 10.1016/S0165-3806(03)00097-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rasmussen, H. N., van Hall, G., and Rasmussen, U. F. (2002). Lactate dehydrogenase is not a mitochondrial en human and mouse vastus lateralis muscle. J. Physiol. 541, 575-580. doi: 10.1113/jphysiol.2002.019216
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Robergs, R. A., Ghiasvand, F., y Parker, D. (2004). Biochemistry of exercise-induced metabolic acidosis. Am. J. Physiol. Regul. Integr. Comp. Physiol. 287, R502-R516. doi: 10.1152/ajpregu.00114.2004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rueda, C. B., Llorente-Folch, I., Amigo, I., Contreras, L., González-Sánchez, P., Martínez-Valero, P., et al. (2014). Regulación por Ca2+ de la función mitocondrial en neuronas. Biochim. Biophys. Acta 1837, 1617-1624. doi: 10.1016/j.bbabio.2014.04.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Safer, B., Smith, C. M., y Williamson, J. R. (1971). Control del transporte de equivalentes reductores a través de la membrana mitocondrial en el corazón de rata perfundido. J. Mol. Cell. Cardiol. 2, 111-124. doi: 10.1016/0022-2828(71)90065-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sampol, D., Ostrofet, E., Jobin, M. L., Raffard, G., Sanchez, S., Bouchaud, V., et al. (2013). Glucose and lactate metabolism in the awake and stimulated rat: a (13)C-NMR study. Front. Neuroenergetics 5:5. doi: 10.3389/fnene.2013.00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Santo-Domingo, J., y Demaurex, N. (2012). Perspectivas sobre: Simposio SGP sobre fisiología y medicina mitocondrial: el renacimiento del pH mitocondrial. J. Gen. Physiol. 139, 415-423. doi: 10.1085/jgp.201110767
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Schantz, P. G. (1986). Plasticidad del músculo esquelético humano con especial referencia a los efectos del entrenamiento físico sobre los niveles enzimáticos de las lanzaderas NADH y la expresión fenotípica de las proteínas miofibrilares lentas y rápidas. Acta Physiol. Scand. Suppl. 558, 1-62.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Schurr, A. (2014). Glucólisis cerebral: un siglo de persistentes malentendidos y conceptos erróneos. Front. Neurosci. 8:360. doi: 10.3389/fnins.2014.00360
CrossRef Full Text | Google Scholar
Schurr, A., West, C. A., y Rigor, B. M. (1988). Función sináptica apoyada por lactato en la preparación de rebanadas de hipocampo de rata. Science 240, 1326-1328. doi: 10.1126/science.3375817
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Skilleter, D. N., y Kun, E. (1972). La oxidación de L-lactato por las mitocondrias del hígado. Arch. Biochem. Biophys. 152, 92-104. doi: 10.1016/0003-9861(72)90197-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Spriet, L. L., Howlett, R. A., y Heigenhauser, G. J. (2000). Una aproximación enzimática a la producción de lactato en el músculo esquelético humano durante el ejercicio. Med. Sci. Sports Exerc. 32, 756-763. doi: 10.1097/00005768-200004000-00007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Stainsby, W. N., y Brooks, G. A. (1990). Control del metabolismo del ácido láctico en los músculos en contracción y durante el ejercicio. Exerc. Sport Sci. Rev. 18, 29-63. doi: 10.1249/00003677-199001000-00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sun, F., Dai, C., Xie, J., y Hu, X. (2012). Cuestiones bioquímicas en la estimación de la relación NAD/NADH libre citosólica. PLoS ONE 7:e34525. doi: 10.1371/journal.pone.0034525
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Todd, J. J. (2014). Lactato: valioso para el rendimiento físico y el mantenimiento de la función cerebral durante el ejercicio. Biosci. Horiz. 7, 1-7. doi: 10.1093/biohorizons/hzu001
CrossRef Full Text | Google Scholar
van Hall, G. (2010). Cinética del lactato en los tejidos humanos en reposo y durante el ejercicio. Acta Physiol. (Oxf.) 199, 499-508. doi: 10.1111/j.1748-1716.2010.02122.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
van Hall, G., Stromstad, M., Rasmussen, P., Jans, O., Zaar, M., Gam, C., et al. (2009). Blood lactate is an important energy source for the human brain. J. Cereb. Blood Flow Metab. 29, 1121-1129. doi: 10.1038/jcbfm.2009.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Voet, D., Voet, J. G., y Pratt, C. W. (2011). Fundamentos de la bioquímica: Life at the Molecular Level. Hoboken, NJ: Wiley.
Google Scholar
Williamson, D. H., Lund, P., y Krebs, H. A. (1967). El estado redox del dinucleótido de nicotinamida-adenina libre en el citoplasma y las mitocondrias del hígado de rata. Biochem. J. 103, 514-527.
Pubmed Abstract | Pubmed Full Text | Google Scholar