- Introduzione: Reazione della lattato deidrogenasi
- La navetta malato-aspartato
- Glicolisi (an)aerobica convenzionale
- Il concetto di shuttle del lattato
- Compartimentalizzazione intracellulare di LDH: lezioni dalla navetta della fosfocreatina
- Compartimentalizzazione intercellulare del metabolismo del lattato: la navetta lattato astrociti-neuroni
- Rigenerazione del NAD+ citosolico
- Trasporto di protoni e trasporto mitocondriale di substrati
- Considerazioni metodologiche
- Sommario
- Dichiarazione di conflitto di interessi
- Riconoscimenti
Introduzione: Reazione della lattato deidrogenasi
La riduzione del piruvato a lattato, catalizzata dalla lattato deidrogenasi (LDH; piruvato + NADH + H+ ⇌ lattato + NAD+) nel citosol di molte cellule, è stata considerata un “vicolo cieco” metabolico (Luft, 2001; Quistorff e Grunnet, 2011a), o forse più giustamente, un cul de sac metabolico (Barros, 2013), perché il lattato può rientrare nella rete metabolica solo attraverso il piruvato. Nei mammiferi, la reazione LDH è anche considerata “quasi in equilibrio” (Spriet et al., 2000; Quistorff e Grunnet, 2011a,b), il che significa che la reazione è regolata principalmente dalle concentrazioni dei suoi reagenti e prodotti, piuttosto che da mezzi più sofisticati di regolazione allosterica o modifica covalente (Crabtree e Newsholme, 1978). Poiché l’equilibrio per la reazione LDH si trova molto a destra (cioè, la formazione di lattato favorita) (Williamson et al., 1967), indipendentemente dalla isoforma LDH (Quistorff e Grunnet, 2011a,b), l’implicazione potrebbe essere che LDH raramente favorisce la reazione inversa (cioè, l’ossidazione del lattato) in vivo. Infatti, il rapporto massa-azione (/) necessario per un’apprezzabile ossidazione del lattato dovrebbe superare la costante di equilibrio della LDH. Tuttavia, l’evidenza sperimentale smentisce sempre di più qualsiasi nozione che la LDH operi in modo unidirezionale in vivo, e sostiene che il lattato serve come un importante carburante metabolico per molti tessuti, compresi quelli scheletrici (Brooks et al., 1991; Bergman et al, 1999; Donovan e Pagliassotti, 2000) e muscolo cardiaco (Gertz et al., 1988; Chatham et al., 2001), fegato (Skilleter e Kun, 1972; Kline et al., 1986) e cervello (Schurr et al., 1988; Bouzier-Sore et al., 2006; Wyss et al., 2011; Funfschilling et al., 2012; rivisto in Barros, 2013). Lo scopo della presente prospettiva è quello di avanzare un modello in cui il lattato è centrale per la navetta di substrato energetico tra il citosol (glicolisi) e i mitocondri (fosforilazione ossidativa). I componenti di tale concetto sono stati dimostrati nel cuore (Safer et al., 1971) e nel muscolo scheletrico (Schantz, 1986), sono stati successivamente estesi a una prospettiva di navetta del lattato (Stainsby e Brooks, 1990; Brooks et al., 1999) e ampiamente rivisti (Gladden, 2004) e nuovamente commentati (Gladden, 2007). Il concetto è particolarmente sostenuto da recenti ricerche in cellule neuronali (Gellerich et al., 2012, 2013; Rueda et al., 2014). Mentre il concetto delineato nella presente prospettiva non è nuovo, di per sé (Safer et al, 1971), un’apparente mancanza di riconoscimento convenzionale o di accettazione dei suoi fondamenti teorici merita ulteriore attenzione.
A causa dell’impermeabilità della membrana mitocondriale interna a NAD+ e NADH, il NADH generato dalla glicolisi in condizioni aerobiche dipende dal trasferimento indiretto di equivalenti riducenti nei mitocondri attraverso la navetta malato-aspartato (MAS) e la navetta glicerolo-fosfato. Queste navette sono anche pensate per rigenerare il NAD+ citosolico necessario per sostenere il flusso glicolitico alla reazione della gliceraldeide 3-fosfato deidrogenasi che richiede NAD+. È stato dimostrato che la MAS è il mezzo predominante con cui questo avviene nella maggior parte dei tessuti ossidativi, e sembra costituire la principale navetta di NADH nei neuroni maturi (Kauppinen et al., 1987; Ramos et al., 2003; Contreras e Satrustegui, 2009; Gellerich et al., 2012). È anche ben stabilito che in condizioni di aumento della domanda di energia cellulare e/o di aumento del flusso glicolitico (ad esempio, durante l’esercizio fisico intenso), così come l’ipossia, la concentrazione di lattato aumenterà poiché la reazione LDH facilita l’aumento dei tassi di rigenerazione del NAD+ citosolico (Robergs et al., 2004). Nel cervello, tuttavia, l’aumento della concentrazione di lattato in circolazione (ad esempio, come durante l’esercizio) si traduce in un aumento dello smaltimento del lattato nel cervello (Quistorff et al., 2008; van Hall et al., 2009; Boumezbeur et al., 2010; Dienel, 2012). È stato anche suggerito che l’aumentata attività della LDH (e, a sua volta, la produzione di lattato) compensi semplicemente l’incapacità del MAS di tenere il passo con la domanda citosolica di NAD+ (Schantz, 1986). Nei neuroni, l’attivazione del Ca+2 della MAS e del ciclo TCA sono competitive, in modo tale che livelli più bassi di Ca+2 stimolano l’attività della MAS attivando il trasportatore glutammato/aspartato (Contreras e Satrustegui, 2009), mentre concentrazioni più alte di Ca+2 attivano l’α-chetoglutarato deidrogenasi nella matrice mitocondriale, limitando l’α-chetoglutarato disponibile per la MAS (Contreras e Satrustegui, 2009). È anche possibile che il lattato si formi continuamente nel citosol, indipendentemente dallo stato metabolico, e che il lattato ossidato nei mitocondri sia accoppiato alla MAS. Nei mitocondri cardiaci isolati, per esempio, il MAS mostra una capacità in eccesso, suggerendo che l’attività del MAS da sola è sufficiente a mantenere la rigenerazione citosolica del NAD+ (Digerness e Reddy, 1976). Perché, allora, a riposo e in condizioni completamente aerobiche, dovrebbe essere prodotto lattato durante la glicolisi, se tutto il piruvato dovrebbe andare ai mitocondri per la fosforilazione ossidativa, e il MAS dovrebbe rigenerare sufficiente NAD+?
Glicolisi (an)aerobica convenzionale
La comparsa e la scomparsa del lattato durante i vari stati metabolici è stato un argomento di molte congetture storiche, controversie e curiosità. Ci sono state molte revisioni della letteratura che esaminano il metabolismo del lattato, a cui i lettori possono essere indirizzati. Alcune delle più recenti includono (Cruz et al., 2012; Dienel, 2012; Kitaoka et al., 2012; Doherty e Cleveland, 2013; Newington et al., 2013; Brooks, 2014; Schurr, 2014; Todd, 2014). Purtroppo, molti libri di testo contemporanei usano ancora il destino metabolico del piruvato per distinguere due tipi di glicolisi: aerobica (cioè che richiede ossigeno) e anaerobica (cioè senza ossigeno). In presenza di ossigeno, è stato detto, il piruvato procederà verso i mitocondri per incontrare la sua fine metabolica attraverso la fosforilazione ossidativa, il cui risultato netto è la risintesi mitocondriale di ATP e il consumo di ossigeno (cioè, la respirazione) (Voet et al., 2011). Al contrario, quando l’ossigeno è limitante, il piruvato viene ridotto a lattato nel citosol dalla LDH, ossidando il suo cofattore NADH nel processo (Voet et al., 2011). Un problema con questo costrutto tradizionale è che non si concilia bene con alcune osservazioni scientifiche ricorrenti. Per esempio, è ben stabilito che il lattato è prodotto, e consumato, in condizioni completamente aerobiche. Infatti, in individui sani e normotossici a riposo nello stato post-sbornia, ci si può aspettare che circa 50 μmol-min-1 di lattato siano rilasciati dal solo cervello (van Hall et al., 2009; van Hall, 2010). Chiaramente, il lattato è più di un metabolita di scarto della glicolisi anaerobica; piuttosto, lo shuttling del lattato in tutto l’organismo fornisce una prospettiva utile in cui interpretare l’osservazione sperimentale.
Il concetto di shuttle del lattato
Sono stati avanzati due concetti di shuttle del lattato che descrivono il movimento e l’utilizzo del lattato all’interno e tra le cellule (Brooks, 1998). L’ipotesi della navetta intracellulare del lattato postula che il lattato formato durante la glicolisi possa essere continuamente utilizzato come fonte di energia all’interno della stessa cellula (Brooks, 1998). La navetta intercellulare o cellula-cellula del lattato coinvolge il lattato generato ed esportato da una cellula per essere assunto e utilizzato da un’altra cellula (Brooks, 1998). La navetta cellula-cellula di lattato ha guadagnato l’accettazione generale; i dettagli più fini della navetta intracellulare di lattato continuano ad essere studiati, tuttavia. Recentemente, abbiamo dimostrato sia un’associazione fisica che funzionale di LDH con i mitocondri nel muscolo scheletrico (Elustondo et al., 2013). Utilizzando la microscopia confocale a scansione laser, abbiamo confermato la colocalizzazione della LDH con le proteine di membrana mitocondriali nel muscolo scheletrico di ratto. Abbiamo scoperto che i mitocondri nelle fibre muscolari scheletriche di ratto permeabilizzate con saponina ossidavano il lattato in presenza di NAD+, malato e ADP (Elustondo et al., 2013); questo è stato trovato in modo simile da un altro gruppo in fibre umane (Jacobs et al., 2013). Il piruvato è stato poi trasportato nei mitocondri dove è stato ulteriormente ossidato dalla piruvato deidrogenasi (PDH), quindi dal ciclo TCA, con equivalenti riducenti che stimolano la respirazione (Elustondo et al., 2013; Jacobs et al., 2013). Siamo stati in grado di inibire la respirazione con soli 5μM di alfa-ciano-idrossicinnamato, un inibitore del trasporto mitocondriale del piruvato, sostenendo ulteriormente che il piruvato, ma non il lattato viene trasportato nella matrice mitocondriale. Questi risultati sostengono che la LDH è strategicamente posizionata per interagire funzionalmente con i mitocondri e suggeriscono che l’ossidazione del lattato avviene vicino alla superficie esterna della membrana mitocondriale interna. Come potrebbe funzionare una navetta intracellulare del lattato in una cellula intatta? Torniamo al MAS.
In vivo, il NAD+ citosolico potrebbe, in teoria, essere rigenerato dalla malato deidrogenasi fuori dalla matrice mitocondriale, come parte del MAS. La letteratura fornisce alcune informazioni sui diversi tessuti e sulle loro attività di shuttling mitocondriale. Nel cervello, il MAS è stato considerato il sistema di shuttle più importante per portare il NADH citosolico nei mitocondri (McKenna et al., 2006, e relativi riferimenti); al contrario, lo shuttle glicerolo-fosfato sembra essere di minore importanza (Nguyen et al., 2003). Infatti, l’intima associazione della MAS e la biosintesi del neurotrasmettitore glutammato è stata riportata (Palaiologos et al., 1988). Le attività pubblicate della MAS misurate nei mitocondri isolati dal cervello di ratto sono dell’ordine di 26,7 nmol-min-1-mg-1 (Pardo et al., 2006). Nei sinaptosomi, l’inibizione farmacologica del MAS risulta in una diminuzione pronunciata (50%) dell’ossidazione del lattato (McKenna et al., 1993), sostenendo il modello illustrato nella Figura 1. La produzione intracerebrale di lattato dal glucosio marcato con 13C supporta ulteriormente la nozione che il lattato è un importante carburante per i neuroni (Sampol et al., 2013).
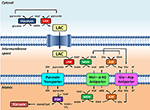
Figura 1. Rappresentazione schematica del legame tra glicolisi e ossidazione del lattato nei mitocondri delineato in questa prospettiva. Nel complesso, la glicolisi produce piruvato e NADH, oltre all’ATP. Il NAD+ può essere rigenerato per la glicolisi dalla riduzione del piruvato a lattato (LAC) da parte della lattato deidrogenasi (LDH). Il LAC può diffondersi nei mitocondri dove viene ossidato a piruvato dalla LDH. Il NAD+ è rigenerato dalla malato deidrogenasi extra-matrice (MDH) della navetta malato-aspartato. Il piruvato viene successivamente trasportato attraverso la membrana mitocondriale interna nella matrice, dove viene poi ossidato dalla piruvato deidrogenasi (PDH) ad acetil CoA. Abbreviazioni: α-KG, alfa-chetoglutarato; Glu, glutammato; AAT, aspartato-aminotransferasi; OAA, ossalacetato; Mal, malato.
Si noti che il MAS può avere i suoi limiti. Ad alti carichi di lavoro cardiaci, è stato dimostrato che il trasportatore α-chetoglutarato/malato della membrana mitocondriale interna non può competere con la matrice α-chetoglutarato deidrogenasi per il loro substrato condiviso, l’α-chetoglutarato (O’Donnell et al., 2004). Questo si traduce in un effetto limitante per il MAS e il suo trasferimento di NADH nei mitocondri. L’effetto netto di questa limitazione al MAS sarebbe un aumento della concentrazione citosolica di lattato, poiché la rigenerazione di NAD+ attraverso la reazione LDH aiuterebbe a preservare il NAD+/NADH omeostatico, anche in presenza di ossigeno adeguato. Infatti, questo è il classico fenomeno osservato durante un esercizio particolarmente faticoso, dove il lattato può accumularsi nel sangue, nonostante un’adeguata disponibilità di ossigeno.
La nozione di fare la spola tra i mitocondri e il citosol per soddisfare le richieste energetiche della cellula utilizzando enzimi quasi in equilibrio non è certamente nuova. La navetta fosfocreatina (PCr) coinvolge distinte isoforme di creatina chinasi (CK) mitocondriali e citosoliche per trasportare essenzialmente fosfato “ad alta energia” dai mitocondri al citosol. Come la reazione LDH, la reazione CK (fosfocreatina + ADP + H+ ⇌ creatina + ATP), è considerata “quasi in equilibrio”, favorendo la risintesi dell’ATP. Tuttavia, l’evidenza sperimentale dimostra che nelle cellule miocardiche, solo la CK citosolica è effettivamente all’equilibrio, o quasi (rivista in Joubert et al., 2004). La CK mitocondriale, invece, localizzata nello spazio intermembrana, è spostata dall’equilibrio, favorendo la risintesi netta della PCr. Per analogia, si pensa che due popolazioni distinte di LDH siano coinvolte nella navetta intracellulare del lattato: citosolica e mitocondriale. L’LDH citosolico sarebbe all’equilibrio o vicino all’equilibrio, mentre l’LDH mitocondriale sarebbe spostato dall’equilibrio. L’LDH citosolico favorirebbe la produzione netta di lattato, mentre l’LDH mitocondriale favorirebbe l’ossidazione del lattato. E proprio come l’adenina nucleotide translocase (ANT), che trasporta ADP nella matrice attraverso la membrana mitocondriale interna in cambio di ATP, facilita lo spostamento dall’equilibrio per il CK mitocondriale nello spazio intermembrana, così anche il trasportatore di piruvato trasporterebbe continuamente piruvato, spostando la reazione LDH mitocondriale dall’equilibrio (Figura 1). Una tale navetta del lattato trarrebbe vantaggio dalla localizzazione della LDH nello spazio intermembrana vicino alla membrana mitocondriale interna, legata all’esterno della membrana mitocondriale esterna nei siti di contatto della membrana mitocondriale esterna e interna, o entrambi. Se l’ossidazione intracellulare del lattato deve avvenire nei mitocondri attraverso la compartimentazione, come con la navetta PCr, la localizzazione cellulare della LDH in, presso o intorno ai mitocondri sarebbe una caratteristica saliente.
Un corpo ricco e crescente di ricerca neuroenergetica supporta anche l’esistenza di un metabolismo compartimentato del lattato tra cellule cerebrali vicine, vale a dire astrociti e neuroni (recensione in Pellerin e Magistretti, 2012). Una variante della navetta intercellulare del lattato in generale (Brooks, 2009), la navetta lattato astrociti-neuroni (Pellerin e Magistretti, 2012) si basa sull’idea che gli astrociti sono prevalentemente glicolitici, mentre i neuroni sono più ossidativi (Bouzier-Sore e Pellerin, 2013 e riferimenti ivi). Utilizzando un approccio di modellazione metabolica, è stato sostenuto che un maggiore flusso metabolico attraverso PDH e le navette mitocondriali NADH nei neuroni rispetto agli astrociti detta necessariamente il rilascio netto di lattato da parte degli astrociti e l’ossidazione da parte dei neuroni (Neves et al., 2012), sostenendo molte osservazioni sperimentali (rivisto in Bouzier-Sore e Pellerin, 2013). Come accennato in precedenza, il MAS costituisce la principale navetta mitocondriale NADH nei neuroni maturi (Kauppinen et al., 1987; Ramos et al., 2003; Contreras e Satrustegui, 2009; Gellerich et al., 2012). Quindi, una caratteristica importante del neurone consumatore di lattato potrebbe essere la sua elevata attività MAS (Neves et al., 2012). È il momento di una navetta lattato-malato-aspartato? C’è un ulteriore supporto teorico per un modello in cui il lattato serve come equivalente riducente?
Rigenerazione del NAD+ citosolico
L’ossidazione del lattato al mitocondrio dà un ulteriore senso alla glicolisi aerobica, permettendo la rigenerazione del NAD+ citosolico da parte della LDH citosolica. Infatti, l’evidenza in cellule coltivate indica un rapporto lattato/piruvato altamente labile che varia per preservare il NAD+/NADH omeostatico (Sun et al., 2012). Questo sarebbe vantaggioso per la cellula per una serie di ragioni. In primo luogo, fornirebbe un mezzo immediato con cui rigenerare NAD+ localmente (cioè, nel citosol, dove avviene la glicolisi); la maggiore diffusibilità relativa del lattato (peso molecolare = 89,07 g/mol) rispetto al NAD+ (peso molecolare = 663,43 g/mol) significa che il lattato può diffondere facilmente dalla cellula in condizioni di aumento del flusso glicolitico (ad esempio, esercizio intenso, stress ipossico), mentre viene anche diretto verso i mitocondri. Durante i periodi di ridotta domanda di energia cellulare, la produzione continua di lattato durante tassi molto più bassi di flusso glicolitico sarebbe ancora utilizzato per mantenere omeostatico NAD + / NADH all’interno della cella, così come per continuare l’accoppiamento del lattato intracellulare shuttling al MAS.
Trasporto di protoni e trasporto mitocondriale di substrati
L’ossidazione del lattato nei mitocondri ha senso nella glicolisi aerobica perché la produzione di lattato nel citosol consuma effettivamente un protone (Robergs et al, 2004), che si pensa aiuti a mitigare l’acidosi metabolica associata all’aumento del turnover dell’ATP e agli alti tassi di glicolisi (Robergs et al., 2004). La concentrazione citosolica del lattato supera tipicamente quella del piruvato di almeno 10 volte, il che significa che il lattato, e non il piruvato, è il monocarbossilato predominante che entra nello spazio intermembrana dei mitocondri (Brooks et al., 1999). Ossidando il lattato nello spazio intermembrana mitocondriale, i protoni verrebbero rilasciati dove potrebbero contribuire alla componente ΔpH della forza motrice protonica mitocondriale attraverso la membrana interna (Santo-Domingo e Demaurex, 2012), e/o essere trasportati indirettamente nei mitocondri dal MAS. Come per il trasporto del fosfato inorganico e di alcuni altri substrati e ioni (Santo-Domingo e Demaurex, 2012), il trasporto mediato dal trasportatore del piruvato attraverso la membrana mitocondriale interna nei mitocondri del fegato di ratto sembra essere direttamente accoppiato al simporto protonico (o OH- antiport) (Papa et al., 1971; Halestrap, 1975). L’ossidazione del lattato vicino alla superficie esterna della membrana mitocondriale interna, che rilascia un protone, contribuirebbe al ΔpH e, a sua volta, al trasporto del piruvato nella matrice. Adiacente alla membrana mitocondriale interna, il rapporto massa azione LDH (cioè, concentrazioni di prodotti/concentrazioni di reazioni) potrebbe essere largamente facilitato dal “sanguinamento” del piruvato mentre viene continuamente trasportato attraverso la membrana mitocondriale interna impermeabile al lattato, così come una generosa rigenerazione di NAD+ da parte della malato deidrogenasi extra-matrice del MAS. In questo modello, il trasporto del piruvato attraverso la membrana mitocondriale interna influenzerebbe direttamente il tasso di ossidazione del lattato appena fuori dalla matrice. L’ossidazione del lattato nei mitocondri dovrebbe quindi essere regolata indirettamente dalla reazione PDH nella matrice. Questo sarebbe vantaggioso perché, a differenza della LDH, la PDH è altamente regolata attraverso l’allosteria e la modifica covalente. Come accennato, la modellazione prevede un’alta attività PDH per dettare il consumo di lattato neuronale in vivo (Neves et al., 2012); e l’alta attività PDH caratterizza anche i neuroni che consumano lattato in cultura (Halim et al., 2010).
Considerazioni metodologiche
Se l’ossidazione mitocondriale del lattato è funzionalmente legata all’attività del MAS, allora sarebbe importante includere componenti del MAS nelle analisi in vitro dell’ossidazione mitocondriale del lattato, come il malato stesso o l’ossalacetato. Il malato è la scelta più probabile, dato che è abitualmente incluso per stimolare la respirazione in vitro, dove viene trasportato nella matrice e ossidato dalla malato deidrogenasi mitocondriale in ossalacetato. Questo ossalacetato può poi condensare con l’acetil coA formato, per esempio, quando viene aggiunto piruvato. Includere il glutammato oltre al malato, permette il pieno funzionamento del MAS a livello della respirazione mitocondriale. Un aspetto importante, ma a volte trascurato, della valutazione appropriata dell’ossidazione mitocondriale del lattato è l’inclusione del NAD+ come cofattore necessario per la reazione LDH, e l’ADP come accettore di fosfato per stimolare la fosforilazione ossidativa (cioè la respirazione allo stato 3). Inoltre, la componente extra-matrice della MAS coinvolge la reazione della malato deidrogenasi: ossalacetato + NADH + H+ ⇌ malato + NAD+. I protocolli sperimentali che esaminano il consumo di ossigeno respiratorio nei mitocondri isolati dal muscolo utilizzando alte concentrazioni di malato (ad esempio, 4 mM; Rasmussen et al., 2002), possono favorire la reazione malato deidrogenasi in direzione inversa (cioè, ossidazione del malato e produzione di NADH + H+) quando aggiunto al campione mitocondriale in combinazione con NAD+. Infatti, la reversibilità della MAS è stata osservata in epatociti isolati (Berry, 1971) e in mitocondri con MAS ricostituita (Kunz e Davis, 1991). L’effetto netto di questa inversione MAS sulla respirazione sarebbe quello di ridurre il malato dall’entrare nei mitocondri, formando ossalacetato. Ancora più importante, l’inversione impedirebbe l’ossidazione del lattato a piruvato, e il successivo trasporto e ossidazione del piruvato nella matrice. Le soluzioni a queste barriere metodologiche per osservare l’ossidazione mitocondriale del lattato in vitro comportano l’inclusione di almeno un componente del MAS. Se si aggiunge il malato, la concentrazione appropriata dovrebbe essere determinata sperimentalmente. Includere ADP e NAD+ o NADH (ricordiamo che il MAS genererà NAD+ per la reazione LDH) è necessario anche per osservare un’apprezzabile ossidazione mitocondriale del lattato.
Sommario
Un lattato-MAS è l’interazione tra il lattato e le navette malato-aspartato per traslocare il potere riducente ai mitocondri, in particolare all’interno di cellule ossidative e metabolicamente attive.
Dichiarazione di conflitto di interessi
L’autore dichiara che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Molti ringraziamenti al Dr. Erich Gnaiger (Medical University of Innsbruck) e al Dr. George Brooks (University of California, Berkeley) per aver criticato le bozze precedenti di questo lavoro.
Barros, L. F. (2013). Segnalazione metabolica da lattato nel cervello. Trends Neurosci. 36, 396-404. doi: 10.1016/j.tins.2013.04.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bergman, B. C., Wolfel, E. E., Butterfield, G. E., Lopaschuk, G. D., Casazza, G. A., Horning, M. A., et al. Cinetica del lattato attivo e del corpo intero dopo l’allenamento di resistenza negli uomini. J. Appl. Physiol. (1985) 87, 1684-1696.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Berry, M. N. (1971). Energia-dipendente riduzione del piruvato in lattato da cellule parenchimali isolate intatte dal fegato di ratto. Biochimica. Biophys. Res. Commun. 44, 1449-1456. doi: 10.1016/S0006-291X(71)80248-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Boumezbeur, F., Petersen, K. F., Cline, G. W., Mason, G. F., Behar, K. L., Shulman, G. I., et al. Il contributo del lattato di sangue al metabolismo energetico del cervello negli esseri umani misurato dalla dinamica 13C risonanza magnetica nucleare spettroscopia. J. Neurosci. 30, 13983-13991. doi: 10.1523/JNEUROSCI.2040-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., e Pellerin, L. (2013). Svelare la complessa natura metabolica degli astrociti. Fronte. Cell. Neurosci. 7:179. doi: 10.3389/fncel.2013.00179
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., Voisin, P., Bouchaud, V., Bezancon, E., Franconi, J. M., e Pellerin, L. (2006). Concorrenza tra glucosio e lattato come substrati di energia ossidativa sia nei neuroni che negli astrociti: uno studio NMR comparativo. Eur. J. Neurosci. 24, 1687-1694. doi: 10.1111/j.1460-9568.2006.05056.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (1998). L’utilizzo del carburante nei mammiferi durante l’esercizio prolungato. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 120, 89-107. doi: 10.1016/S0305-0491(98)00025-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2009). Navette di lattato cellula-cellula e intracellulare. J. Physiol. 587, 5591-5600. doi: 10.1113/jphysiol.2009.178350
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2014). “Sistemi metabolici: la formazione e l’utilizzo del lattato”, in Storia della fisiologia dell’esercizio fisico. Human Kinetics, ed C. M. Tipton (Champaign, IL: Human Kinetics), 447-475.
Google Scholar
Brooks, G. A., Butterfield, G. E., Wolfe, R. R., Groves, B. M., Mazzeo, R. S., Sutton, J. R., et al. (1991). Diminuita dipendenza da lattato durante l’esercizio dopo acclimatazione a 4.300 m. J. Appl. Physiol. (1985). 71, 333-341.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Brooks, G. A., Dubouchaud, H., Brown, M., Sicurello, J. P., e Butz, C. E. (1999). Ruolo della lattato deidrogenasi mitocondriale e l’ossidazione del lattato nella navetta intracellulare lattato. Proc. Natl. Acad. Sci. U.S.A. 96, 1129-1134. doi: 10.1073/pnas.96.3.1129
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Chatham, J. C., Des Rosiers, C., e Forder, J. R. (2001). Prove di percorsi separati per l’assorbimento e il rilascio di lattato dal cuore di ratto perfuso. Am. J. Physiol. Endocrinol. Metab. 281, E794-E802.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Contreras, L., e Satrustegui, J. (2009). Segnalazione di calcio nei mitocondri del cervello: interazione di malato aspartato NADH shuttle e calcio uniporter / vie deidrogenasi mitocondriale. J. Biol. Chem. 284, 7091-7099. doi: 10.1074/jbc.M808066200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Crabtree, B., e Newsholme, E. A. (1978). Sensibilità di una reazione vicina all’equilibrio in una via metabolica ai cambiamenti nella concentrazione del substrato. Eur. J. Biochem. 89, 19-22. doi: 10.1111/j.1432-1033.1978.tb20891.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Cruz, R. S., de Aguiar, R. A., Turnes, T., Penteado Dos Santos, R., de Oliveira, M. F., and Caputo, F. (2012). Navetta intracellulare: il metabolismo aerobico del lattato. ScientificWorldJournal 2012:420984. doi: 10.1100/2012/420984
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Dienel, G. A. (2012). Metabolismo del lattato cerebrale: le scoperte e le controversie. J. Cereb. Blood Flow Metab. 32, 1107-1138. doi: 10.1038/jcbfm.2011.175
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Digerness, S. B., e Reddy, W. J. (1976). La navetta malato-aspartato nei mitocondri del cuore. J. Mol. Cell. Cardiol. 8, 779-785. doi: 10.1016/0022-2828(76)90084-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Doherty, J. R., e Cleveland, J. L. (2013). Targeting metabolismo lattato per la terapia del cancro. J. Clin. Invest. 123, 3685-3692. doi: 10.1172/JCI69741
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Donovan, C. M., e Pagliassotti, M. J. (2000). Valutazione quantitativa delle vie di smaltimento del lattato nei tipi di fibre muscolari scheletriche. Med. Sci. Sport Exerc. 32, 772-777. doi: 10.1097/00005768-200004000-00009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Elustondo, P. A., White, A. E., Hughes, M. E., Brebner, K., Pavlov, E., e Kane, D. A. (2013). Associazione fisica e funzionale di lattato deidrogenasi (LDH) con mitocondri del muscolo scheletrico. J. Biol. Chem. 288, 25309-25317. doi: 10.1074/jbc.M113.476648
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Funfschilling, U., Supplie, L. M., Mahad, D., Boretius, S., Saab, A. S., Edgar, J., et al. Glicolitici oligodendrociti mantenere la mielina e l’integrità assonale a lungo termine. Natura 485, 517-521. doi: 10.1038/nature11007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Gainutdinov, T., Muth, K., Seppet, E., Orynbayeva, Z., et al. Il controllo di energizzazione mitocondriale del cervello da calcio citosolico: il pedale del gas mitocondriale. IUBMB vita 65, 180-190. doi: 10.1002/iub.1131
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Trumbekaite, S., Korzeniewski, B., Gaynutdinov, T., Seppet, E., et al. Ca2+ citosolico regola l’energizzazione dei mitocondri cerebrali isolati dalla formazione di piruvato attraverso la navetta malato-aspartato. Biochem. J. 443, 747-755. doi: 10.1042/BJ20110765
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gertz, E. W., Wisneski, J. A., Stanley, W. C., e Neese, R. A. (1988). Utilizzo del substrato miocardico durante l’esercizio nell’uomo. Esperimenti di isotopi di carboidrati con doppia marcatura di carbonio. J. Clin. Invest. 82, 2017-2025. doi: 10.1172/JCI113822
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2004). Metabolismo del lattato: un nuovo paradigma per il terzo millennio. J. Physiol. 558, 5-30. doi: 10.1113/jphysiol.2003.058701
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2007). C’è una navetta intracellulare lattato nel muscolo scheletrico? J. Physiol. 582, 899. doi: 10.1113/jphysiol.2007.138487
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Halestrap, A. P. (1975). Il trasportatore piruvato mitocondriale. Cinetica e specificità per substrati e inibitori. Biochimica. J. 148, 85-96.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Halim, N. D., McFate, T., Mohyeldin, A., Okagaki, P., Korotchkina, L. G., Patel, M. S., et al. Stato di fosforilazione di piruvato deidrogenasi distingue fenotipi metabolici di astrociti e neuroni del cervello di ratto in coltura. Glia 58, 1168-1176. doi: 10.1002/glia.20996
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Jacobs, R. A., Meinild, A. K., Nordsborg, N. B., e Lundby, C. (2013). Ossidazione del lattato in mitocondri del muscolo scheletrico umano. Am. J. Physiol. Endocrinol. Metab. 304, E686-E689. doi: 10.1152/ajpendo.00476.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Joubert, F., Mateo, P., Gillet, B., Beloeil, J. C., Mazet, J. L., e Hoerter, J. A. (2004). Flusso CK o trasferimento diretto di ATP: versatilità delle vie di trasferimento di energia evidenziata da NMR nel cuore perfuso. Mol. Cell. Biochem. 256-257, 43-58. doi: 10.1023/B:MCBI.0000009858.41434.fc
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kauppinen, R. A., Sihra, T. S., e Nicholls, D. G. (1987). L’acido aminoossiacetico inibisce la navetta malato-aspartato in terminali nervosi isolati e impedisce ai mitocondri di utilizzare substrati glicolitici. Biochim. Biofisica. Acta 930, 173-178. doi: 10.1016/0167-4889(87)90029-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kitaoka, Y., Hoshino, D., e Hatta, H. (2012). Trasportatore di monocarbossilato e metabolismo del lattato. J. Phys. Fitness Sport Med. 1, 247-252. doi: 10.7600/jpfsm.1.247
CrossRef Full Text | Google Scholar
Kline, E. S., Brandt, R. B., Laux, J. E., Spainhour, S. E., Higgins, E. S., Rogers, K. S., et al. Localizzazione di L-lattato deidrogenasi nei mitocondri. Arch. Biochem. Biophys. 246, 673-680. doi: 10.1016/0003-9861(86)90323-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kunz, W. S., e Davis, E. J. (1991). Controllo del trasferimento intracellulare reversibile del potenziale di riduzione. Arch. Biochem. Biophys. 284, 40-46. doi: 10.1016/0003-9861(91)90260-P
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Luft, F. C. (2001). Aggiornamento sull’acidosi lattica per i medici di assistenza critica. J. Am. Soc. Nephrol. 12 Suppl 17: S15-S19.
Pubmed Abstract | Pubmed Full Text | Google Scholar
McKenna, M. C., Tildon, J. T., Stevenson, J. H., Boatright, R., e Huang, S. (1993). Regolazione del metabolismo energetico nei terminali sinaptici e astrociti del cervello di ratto in coltura: differenze rivelate utilizzando aminoossiacetato. Dev. Neurosci. 15, 320-329. doi: 10.1159/000111351
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
McKenna, M. C., Waagepetersen, H. S., Schousboe, A., and Sonnewald, U. (2006). Meccanismi di navetta neuronale e astrocitaria per il trasferimento citosolico-mitocondriale di equivalenti riducenti: prove attuali e strumenti farmacologici. Biochem. Pharmacol. 71, 399-407. doi: 10.1016/j.bcp.2005.10.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Neves, A., Costalat, R., e Pellerin, L. (2012). Determinanti dei fenotipi metabolici delle cellule cerebrali e l’utilizzo di substrati energetici svelato con un approccio modellistico. PLoS Comput. Biol. 8:e1002686. doi: 10.1371/journal.pcbi.1002686
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Newington, J. T., Harris, R. A., e Cumming, R. C. (2013). Rivalutare il metabolismo nella malattia di Alzheimer dal punto di vista del modello di navetta lattato astrocita-neurone. J. Neurodegener. Dis. 2013, 13. doi: 10.1155/2013/234572
CrossRef Full Text | Google Scholar
Nguyen, N. H., Brathe, A., e Hassel, B. (2003). Assorbimento e metabolismo neuronale di glicerolo e l’espressione neuronale di glicerolo-3-fosfato deidrogenasi mitocondriale. J. Neurochem. 85, 831-842. doi: 10.1046/j.1471-4159.2003.01762.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
O’Donnell, J. M., Kudej, R. K., LaNoue, K. F., Vatner, S. F., and Lewandowski, E. D. (2004). Trasferimento limitato di NADH citosolico nei mitocondri ad alto carico di lavoro cardiaco. Am. J. Physiol. Heart Circ. Physiol. 286, H2237-H2242. doi: 10.1152/ajpheart.01113.2003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Palaiologos, G., Hertz, L., e Schousboe, A. (1988). La prova che l’attività dell’aspartato aminotransferasi e la funzione del trasportatore chetodicarbossilato sono essenziali per la biosintesi del glutammato trasmettitore. J. Neurochem. 51, 317-320. doi: 10.1111/j.1471-4159.1988.tb04872.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Papa, S., Francavilla, A., Paradies, G., e Meduri, B. (1971). Il trasporto del piruvato nei mitocondri del fegato di ratto. FEBS Lett. 12, 285-288. doi: 10.1016/0014-5793(71)80200-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pardo, B., Contreras, L., Serrano, A., Ramos, M., Kobayashi, K., Iijima, M., et al. Ruolo essenziale di aralar nella trasduzione di piccoli segnali di Ca2+ ai mitocondri neuronali. J. Biol. Chem. 281, 1039-1047. doi: 10.1074/jbc.M507270200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pellerin, L., e Magistretti, P. J. (2012). Sweet sixteen per ANLS. J. Cereb. Blood Flow Metab. 32, 1152-1166. doi: 10.1038/jcbfm.2011.149
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., e Grunnet, N. (2011a). Alto lattato del cervello non è causato da uno spostamento del rapporto lattato deidrogenasi A/B. Proc. Natl. Acad. Sci. U.S.A. 108, E21. risposta dell’autore: E22. doi: 10.1073/pnas.1017750108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., e Grunnet, N. (2011b). Il modello isoenzimatico di LDH non svolge un ruolo fisiologico, tranne forse durante le transizioni veloci nel metabolismo energetico. Aging (Albany, NY) 3, 457-460.
Google Scholar
Quistorff, B., Secher, N. H., e Van Lieshout, J. J. (2008). Lattato alimenta il cervello umano durante l’esercizio. FASEB J. 22, 3443-3449. doi: 10.1096/fj.08-106104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Ramos, M., del Arco, A., Pardo, B., Martinez-Serrano, A., Martinez-Morales, J. R., Kobayashi, K., et al. Cambiamenti nello sviluppo del Ca2+-regolato mitocondriale aspartato-glutammato vettore aralar1 nel cervello e l’espressione prominente nel midollo spinale. Brain Res. Dev. Brain Res. 143, 33-46. doi: 10.1016/S0165-3806(03)00097-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rasmussen, H. N., van Hall, G., and Rasmussen, U. F. (2002). Lattato deidrogenasi non è un enzima mitocondriale nel muscolo vastus lateralis umano e murino. J. Physiol. 541, 575-580. doi: 10.1113/jphysiol.2002.019216
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Robergs, R. A., Ghiasvand, F., and Parker, D. (2004). Biochimica dell’acidosi metabolica indotta dall’esercizio. Am. J. Physiol. Regul. Integr. Comp. Physiol. 287, R502-R516. doi: 10.1152/ajpregu.00114.2004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rueda, C. B., Llorente-Folch, I., Amigo, I., Contreras, L., Gonzalez-Sanchez, P., Martinez-Valero, P., et al. (2014). Ca2 + regolazione della funzione mitocondriale nei neuroni. Biochim. Biophys. Acta 1837, 1617-1624. doi: 10.1016/j.bbabio.2014.04.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Safer, B., Smith, C. M., e Williamson, J. R. (1971). Controllo del trasporto di equivalenti riducenti attraverso la membrana mitocondriale in un cuore di ratto perfuso. J. Mol. Cell. Cardiol. 2, 111-124. doi: 10.1016/0022-2828(71)90065-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sampol, D., Ostrofet, E., Jobin, M. L., Raffard, G., Sanchez, S., Bouchaud, V., et al. Metabolismo del glucosio e lattato nel ratto sveglio e stimolato: uno studio (13)C-NMR. Fronte. Neuroenergetics 5:5. doi: 10.3389/fnene.2013.00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Santo-Domingo, J., e Demaurex, N. (2012). Prospettive su: Simposio SGP sulla fisiologia mitocondriale e la medicina: il rinascimento del pH mitocondriale. J. Gen. Physiol. 139, 415-423. doi: 10.1085/jgp.201110767
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Schantz, P. G. (1986). Plasticità del muscolo scheletrico umano con particolare riferimento agli effetti dell’allenamento fisico sui livelli enzimatici delle navette NADH e sull’espressione fenotipica delle proteine miofibrillari lente e veloci. Acta Physiol. Scand. Suppl. 558, 1-62.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Schurr, A. (2014). Glicolisi cerebrale: un secolo di incomprensioni e malintesi persistenti. Fronte. Neurosci. 8:360. doi: 10.3389/fnins.2014.00360
CrossRef Full Text | Google Scholar
Schurr, A., West, C. A., e Rigor, B. M. (1988). Funzione sinaptica supportata dal lattato nella preparazione della fetta dell’ippocampo di ratto. Scienza 240, 1326-1328. doi: 10.1126/science.3375817
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Skilleter, D. N., e Kun, E. (1972). L’ossidazione di L-lattato dai mitocondri del fegato. Arch. Biochem. Biophys. 152, 92-104. doi: 10.1016/0003-9861(72)90197-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Spriet, L. L., Howlett, R. A., e Heigenhauser, G. J. (2000). Un approccio enzimatico alla produzione di lattato nel muscolo scheletrico umano durante l’esercizio. Med. Sci. Sport Exerc. 32, 756-763. doi: 10.1097/00005768-200004000-00007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Stainsby, W. N., and Brooks, G. A. (1990). Controllo del metabolismo dell’acido lattico nei muscoli in contrazione e durante l’esercizio. Exerc. Sport Sci. Rev. 18, 29-63. doi: 10.1249/00003677-199001000-00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sun, F., Dai, C., Xie, J., and Hu, X. (2012). Problemi biochimici nella stima del rapporto NAD/NADH libero citosolico. PLoS ONE 7:e34525. doi: 10.1371/journal.pone.0034525
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Todd, J. J. (2014). Lattato: prezioso per le prestazioni fisiche e il mantenimento della funzione cerebrale durante l’esercizio. Biosci. Orizzonti. 7, 1-7. doi: 10.1093/biohorizons/hzu001
CrossRef Full Text | Google Scholar
van Hall, G. (2010). Cinetica del lattato nei tessuti umani a riposo e durante l’esercizio. Acta Physiol. (Oxf.) 199, 499-508. doi: 10.1111/j.1748-1716.2010.02122.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
van Hall, G., Stromstad, M., Rasmussen, P., Jans, O., Zaar, M., Gam, C., et al. (2009). Sangue lattato è una fonte di energia importante per il cervello umano. J. Cereb. Blood Flow Metab. 29, 1121-1129. doi: 10.1038/jcbfm.2009.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Voet, D., Voet, J. G., e Pratt, C. W. (2011). Fondamenti di biochimica: La vita a livello molecolare. Hoboken, NJ: Wiley.
Google Scholar
Williamson, D. H., Lund, P., e Krebs, H. A. (1967). Lo stato redox di libero nicotinamide-adenina dinucleotide nel citoplasma e mitocondri del fegato di ratto. Biochem. J. 103, 514-527.
Pubmed Abstract | Pubmed Full Text | Google Scholar