- Introduction: Reacção da desidrogenase láctica
- A Vaivém Malate-Aspartate
- Glicólise (An)aeróbica convencional
- O Conceito de Vaivém de Lactato
- Compartimentação intracelular do LDH: Lições do Vaivém Fosfocreatina
- Compartimentação intercelular do metabolismo do lactato: a nave espacial Astrocyte-Neuron Lactate Shuttle
- Regeneração do NAD+ citosólico
- Vaivém de prótons e transporte de substrato mitocondrial
- Considerações metodológicas
- Sumário
- Conflict of Interest Statement
- Confidências
Introduction: Reacção da desidrogenase láctica
A redução do piruvato ao lactato, catalisado pela desidrogenase láctica (LDH; Piruvato + NADH + H+ ⇌ Lactato + NAD+) no citosol de muitas células, tem sido considerado como um “beco sem saída” metabólico (Luft, 2001; Quistorff e Grunnet, 2011a), ou talvez mais apropriadamente, um cul de sac metabólico (Barros, 2013), porque o lactato só pode voltar a entrar na rede metabólica através do piruvato. Nos mamíferos, a reação LDH também é considerada como “near-equilibrium” (Spriet et al., 2000; Quistorff e Grunnet, 2011a,b), significando que a reação é regulada principalmente pelas concentrações de seus reagentes e produtos, e não por meios mais sofisticados de regulação alostática ou modificação covalente (Crabtree e Newsholme, 1978). Como o equilíbrio para a reação LDH está longe da direita (i.e., a formação de lactato favorecida) (Williamson et al., 1967), independentemente da isoforma LDH (Quistorff e Grunnet, 2011a,b), a implicação pode ser que o LDH raramente favorece a reação reversa (i.e., a oxidação do lactato) in vivo. De fato, a razão de ação da massa (/) necessária para uma oxidação apreciável do lactato precisaria exceder a constante de equilíbrio para o LDH. Entretanto, evidências experimentais desmentem cada vez mais qualquer noção de que o LDH opera unidirecionalmente in vivo, e sustenta que o lactato serve como um importante combustível metabólico para muitos tecidos, incluindo o esquelético (Brooks et al., 1991; Bergman et al, 1999; Donovan e Pagliassotti, 2000) e músculo cardíaco (Gertz et al., 1988; Chatham et al., 2001), fígado (Skilleter e Kun, 1972; Kline et al., 1986), e cérebro (Schurr et al., 1988; Bouzier-Sore et al., 2006; Wyss et al., 2011; Funfschilling et al., 2012; revisto em Barros, 2013). O objetivo da Perspectiva atual é encaminhar um modelo no qual o lactato é central para o fechamento do substrato energético entre o citosol (glicólise) e a mitocôndria (fosforilação oxidativa). Componentes de tal conceito foram demonstrados no coração (Safer et al., 1971) e no músculo esquelético (Schantz, 1986), foram mais tarde expandidos para uma perspectiva de transporte de lactato (Stainsby e Brooks, 1990; Brooks et al., 1999) e revistos de forma abrangente (Gladden, 2004) e novamente comentados (Gladden, 2007). O conceito é particularmente apoiado por pesquisas recentes em células neuronais (Gellerich et al., 2012, 2013; Rueda et al., 2014). Embora o conceito delineado na Perspectiva actual não seja novo, per se (Safer et al, 1971), uma aparente falta de reconhecimento ou aceitação dos seus fundamentos teóricos, merece mais atenção.
A Vaivém Malate-Aspartate
Devem à impermeabilidade da membrana mitocondrial interna ao NAD+ e ao NADH, o NADH gerado pela glicólise em condições aeróbias depende da transferência indirecta de equivalentes redutores para as mitocôndrias através da Vaivém Malate-aspartate (MAS) e da Vaivém glicerol-fosfato. Esses vaivéns também são considerados para regenerar o NAD+ citosólico necessário para suportar o fluxo glicolítico na reação de 3-fosfato de gliceraldeído desidrogenase com o NAD+. O MAS demonstrou ser o meio predominante pelo qual isto ocorre na maioria dos tecidos oxidantes, e parece constituir o principal vaivém NADH em neurónios maduros (Kauppinen et al., 1987; Ramos et al., 2003; Contreras e Satrustegui, 2009; Gellerich et al., 2012). Também está bem estabelecido que durante condições de aumento da demanda de energia celular e/ou aumento do fluxo glicolítico (por exemplo, durante exercício extenuante), bem como hipoxia, a concentração de lactato aumentará à medida que a reação LDH facilitará o aumento das taxas de regeneração do NAD+ citosólico (Robergs et al., 2004). No cérebro, entretanto, o aumento da concentração de lactato na circulação (por exemplo, como durante o exercício) resulta em um aumento na disposição de lactato no cérebro (Quistorff et al., 2008; van Hall et al., 2009; Boumezbeur et al., 2010; Dienel, 2012). Foi também sugerido que o aumento da actividade do LDH (e, por sua vez, a produção de lactato) compensa simplesmente a incapacidade do MAS em acompanhar a procura do NAD+ citosólico (Schantz, 1986). Nos neurônios, a ativação de Ca+2 do ciclo do MAS e TCA é competitiva, de tal forma que níveis mais baixos de Ca+2 estimulam a atividade do MAS ativando o glutamato/transportador do estado (Contreras e Satrustegui, 2009), enquanto concentrações mais elevadas de Ca+2 ativam α-ketoglutarate desidrogenase na matriz mitocondrial, limitando o α-ketoglutarate disponível para o MAS (Contreras e Satrustegui, 2009). Também é possível que o lactato seja formado continuamente no citosol, independentemente do estado metabólico, e que o lactato oxidado nas mitocôndrias seja acoplado ao MAS. Nas mitocôndrias cardíacas isoladas, por exemplo, o MAS apresenta um excesso de capacidade, sugerindo que apenas a atividade do MAS é suficiente para manter a regeneração citosólica do NAD+ (Digerness and Reddy, 1976). Por que, então, em repouso e sob condições totalmente aeróbicas, o lactato seria produzido durante a glicólise, se todo o piruvato deveria estar indo para a mitocôndria para fosforilação oxidativa, e a EAM deveria estar regenerando NAD+?
Glicólise (An)aeróbica convencional
O aparecimento e desaparecimento do lactato durante estados metabólicos variáveis tem sido um tópico de muita conjectura histórica, controvérsia e intriga. Tem havido muitas revisões da literatura que examina o metabolismo do ácido láctico, para as quais os leitores podem ser orientados. Algumas das mais recentes incluem (Cruz et al., 2012; Dienel, 2012; Kitaoka et al., 2012; Doherty e Cleveland, 2013; Newington et al., 2013; Brooks, 2014; Schurr, 2014; Todd, 2014). Infelizmente, muitos livros didáticos contemporâneos ainda utilizam o destino metabólico do piruvato para distinguir dois tipos de glicólise: aeróbica (isto é, que requer oxigênio) e anaeróbica (isto é, sem oxigênio). Na presença de oxigénio, tem sido dito, o piruvato irá para as mitocôndrias para satisfazer o seu declínio metabólico através da fosforilação oxidativa, cujo resultado líquido é a ressíntese do ATP mitocondrial e o consumo de oxigénio (ou seja, a respiração) (Voet et al., 2011). Por outro lado, quando o oxigênio é limitante, o piruvato é reduzido ao lactato no citosol pelo LDH, oxidando seu cofator NADH no processo (Voet et al., 2011). Um problema com esta construção tradicional é que ela não se concilia bem com algumas observações científicas recorrentes. Por exemplo, é bem estabelecido que o lactato é produzido, e consumido, em condições totalmente aeróbias. De facto, em indivíduos saudáveis, normoxicais em repouso no estado pós-respiratório, pode esperar-se que aproximadamente 50 μmol-min-1 de lactato sejam libertados apenas do cérebro (van Hall et al., 2009; van Hall, 2010). Claramente, o lactato é mais do que um metabólito de resíduo de glicólise anaeróbica; ao invés disso, o fechamento do lactato em todo o organismo fornece uma perspectiva útil para a interpretação da observação experimental.
O Conceito de Vaivém de Lactato
Dois conceitos de vaivém de lactato foram encaminhados que descrevem o movimento e utilização do lactato dentro e entre células (Brooks, 1998). A hipótese do vaivém intracelular de lactato postula que o lactato formado durante a glicólise pode ser continuamente utilizado como fonte de energia dentro da mesma célula (Brooks, 1998). O vaivém intercelular, ou vaivém de células de lactato envolve lactato gerado e exportado de uma célula para ser absorvido e utilizado por outra célula (Brooks, 1998). O vaivém de células de lactato ganhou aceitação geral; os detalhes mais finos do vaivém de lactato intracelular continuam, no entanto, a ser investigados. Recentemente, demonstramos uma associação física, bem como funcional do LDH com mitocôndrias no músculo esquelético (Elustondo et al., 2013). Utilizando microscopia confocal de varredura a laser, confirmamos a colocalização do LDH com proteínas da membrana mitocondrial no músculo esquelético do rato. Encontramos mitocôndrias em fibras musculares esqueléticas permeabilizadas por saponina de ratos oxidados com lactato na presença de NAD+, malato e ADP (Elustondo et al., 2013); isto foi encontrado de forma semelhante por outro grupo em fibras humanas (Jacobs et al., 2013). O piruvato foi então transportado para as mitocôndrias onde foi oxidado ainda mais pela piruvato desidrogenase (PDH), depois pelo ciclo TCA, com redução de equivalentes estimulando a respiração (Elustondo et al., 2013; Jacobs et al., 2013). Conseguimos inibir a respiração com apenas 5μM alfa-ciano-hidroxicinamato, um inibidor do transporte mitocondrial piruvato, suportando ainda mais esse piruvato, mas não lactato, que é transportado para a matriz mitocondrial. Estes achados suportam que o LDH está estrategicamente posicionado para interagir funcionalmente com mitocôndrias, e sugerem que a oxidação do lactato ocorre perto da superfície externa da membrana mitocondrial interna. Como pode um vaivém de lactato intracelular operar em uma célula intacta? Voltemos ao MAS.
In vivo, o NAD+ citosólico poderia, em teoria, ser regenerado pela desidrogenase malácea fora da matriz mitocondrial, como parte do MAS. A literatura dá algumas informações sobre diferentes tecidos e suas atividades de fechamento mitocondrial. No cérebro, o MAS tem sido considerado o sistema de shuttle mais importante para levar o NADH citosólico para a mitocôndria (McKenna et al., 2006, e suas referências); inversamente, o shuttle glicerol-fosfato parece ser de menor importância (Nguyen et al., 2003). De fato, a associação íntima do MAS e a biossíntese do glutamato neurotransmissor tem sido relatada (Palaiologos et al., 1988). As atividades publicadas da EAM medida em mitocôndrias isoladas do cérebro de ratos estão na ordem de 26,7 nmol-min-1-mg-1 (Pardo et al., 2006). Nos sinaptosomas, a inibição farmacológica da EAM resulta em uma acentuada (i.e. 50%) diminuição na oxidação do lactato (McKenna et al., 1993), suportando o modelo ilustrado na Figura 1. A produção intracerebral de lactato a partir da glicose 13C rotulada suporta ainda mais a noção de que o lactato é um combustível importante para os neurônios (Sampol et al., 2013).
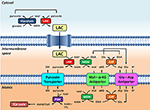
Figura 1. Representação esquemática da ligação entre glicólise e oxidação do lactato nas mitocôndrias delineada nesta Perspectiva. Em geral, a glicólise produz piruvato e NADH, além de ATP. O NAD+ pode ser regenerado para glicólise pela redução do piruvato para lactato (LAC) pela desidrogenase láctica (LDH). O LAC pode se difundir para as mitocôndrias onde é oxidado a piruvato pelo LDH. O NAD+ é regenerado pela desidrogenase extra-matriz de malato (MDH) da nave de transporte de malato aspartato. O piruvato é posteriormente transportado através da membrana mitocondrial interna para a matriz, onde é oxidado pela piruvato desidrogenase (PDH) até a acetil CoA. Abreviaturas: α-KG, alfa-ketoglutarato; Glu, glutamato; AAT, aspartato-aminotransferase; OAA, oxaloacetato; Mal, malato.
Deve-se notar que o MAS pode ter seus limites. Em altas cargas de trabalho cardíaco, foi demonstrado que o α-ketoglutarate/malate transportador da membrana mitocondrial interna não pode competir com a matriz α-ketoglutarate desidrogenase por seu substrato compartilhado, α-ketoglutarate (O’Donnell et al., 2004). Isto resulta em um efeito limitante para o EAM e seu fechamento de NADH na mitocôndria. O efeito líquido dessa limitação ao MAS seria um aumento da concentração de lactato citosólico, já que a regeneração do NAD+ através da reação LDH ajudaria a preservar o NAD+/NADH homeostático, mesmo na presença de oxigênio adequado. De fato, este é o fenômeno clássico observado durante exercício especialmente extenuante onde o lactato pode se acumular no sangue, apesar da disponibilidade adequada de oxigênio.
Compartimentação intracelular do LDH: Lições do Vaivém Fosfocreatina
A noção de compostos de fechamento entre a mitocôndria e o citosol para atender as demandas energéticas da célula usando enzimas de quase-equilíbrio certamente não é nova. O vaivém de fosfocreatina (PCr) envolve isoformas distintas de creatina quinase mitocondrial e citosólica (CK) para essencialmente transportar o fosfato de “alta energia” das mitocôndrias para o citosol. Tal como a reacção LDH, a reacção CK (fosfocreatina + ADP + H+ ⇌ creatina + ATP), é considerada de “quase equilíbrio”, favorecendo a ressíntese de ATP. Entretanto, evidências experimentais demonstram que em células miocárdicas, apenas a CK citosólica está de fato em equilíbrio ou próxima do equilíbrio (Revisado em Joubert et al., 2004). A CK mitocondrial, por outro lado, localizada no espaço intermembrana, é deslocada do equilíbrio, favorecendo a ressíntese net PCr. Por analogia, duas populações distintas de LDH são consideradas envolvidas no vaivém intracelular de lactato: a citosólica e a mitocondrial. O LDH citosólico estaria em equilíbrio ou próximo dele, enquanto o LDH mitocondrial estaria deslocado do equilíbrio. O LDH citosólico favoreceria a produção líquida de lactato, enquanto que o LDH mitocondrial favoreceria a oxidação do lactato. E assim como a translocase adenina nucleotídica (ANT), que transporta ADP para a matriz através da membrana mitocondrial interna em troca de ATP, facilita o deslocamento de equilíbrio para CK mitocondrial no espaço intermembrana, assim também o transportador pirúvio transportaria pirúvio continuamente, deslocando a reação LDH mitocondrial do equilíbrio (Figura 1). Tal transporte de LDH se beneficiaria da localização do LDH no espaço intermembrana próximo à membrana mitocondrial interna, ligado ao exterior da membrana mitocondrial externa nos locais de contato da membrana mitocondrial externa e interna, ou ambas. Se a oxidação do lactato intracelular for ocorrer na mitocôndria via compartimentação, como no vaivém PCr, a localização celular do LDH na, na ou sobre a mitocôndria seria uma característica marcante.
Um corpo rico e crescente de pesquisas neuroenergéticas também suporta a existência de metabolismo compartimentado do lactato entre as células cerebrais vizinhas – principalmente as astrócitos e neurônios (Revisado em Pellerin e Magistretti, 2012). Uma variante do vaivém de lactato intercelular em geral (Brooks, 2009), o vaivém de lactato astrocítico-neurão (Pellerin e Magistretti, 2012) baseia-se na ideia de que os astrocíticos são predominantemente glicolíticos, enquanto os neurónios são mais oxidantes (Bouzier-Sore e Pellerin, 2013 e respectivas referências). Usando uma abordagem de modelagem metabólica, foi argumentado que um maior fluxo metabólico através do PDH e dos vaivéns mitocondriais de NADH em neurônios em comparação aos astrocitos dita necessariamente a liberação líquida de lactato por astrocitos e a oxidação por neurônios (Neves et al., 2012), apoiando muitas observações experimentais (revistas em Bouzier-Sore e Pellerin, 2013). Como mencionado anteriormente, o MAS constitui o maior vaivém mitocondrial NADH em neurónios maduros (Kauppinen et al., 1987; Ramos et al., 2003; Contreras e Satrustegui, 2009; Gellerich et al., 2012). Assim, uma característica importante do neurônio consumidor de lactato pode muito bem ser sua alta atividade de MAS (Neves et al., 2012). Está na hora de um vaivém de Lactato-Malato Asparato? Existe suporte teórico adicional para tal modelo no qual o lactato serve como um equivalente redutor?
Regeneração do NAD+ citosólico
Oxidação do lactato na mitocôndria faz ainda mais sentido a glicólise aeróbica ao permitir a regeneração do NAD+ citosólico pelo LDH citosólico. Na verdade, evidências em células cultivadas apontam para uma relação lactato altamente lábeis/piruvado que varia para preservar o NAD+/NADH homeostático (Sun et al., 2012). Isto seria vantajoso para a célula por uma série de razões. Em primeiro lugar, ele forneceria um meio imediato para regenerar o NAD+ localmente (ou seja, no citosol, onde ocorre a glicólise); a maior difusibilidade relativa do lactato (peso molecular = 89,07 g/mol) versus NAD+ (peso molecular = 663,43 g/mol) significa que o lactato pode se difundir facilmente da célula sob condições de aumento do fluxo glicolítico (por exemplo, exercício intenso, estresse hipóxico), enquanto também é direcionado para as mitocôndrias. Durante períodos de menor demanda de energia celular, a produção contínua de lactato durante taxas muito menores de fluxo glicolítico ainda seria usada para manter o NAD+/NADH homeostático dentro da célula, bem como para o acoplamento contínuo do fechamento intracelular de lactato com o MAS.
Vaivém de prótons e transporte de substrato mitocondrial
Oxidação do lactato nas mitocôndrias faz sentido da glicólise aeróbica porque a produção de lactato no citosol consome efetivamente um próton (Robergs et al.., 2004), que se pensa ajudar a mitigar a acidose metabólica associada ao aumento da rotação do ATP e às altas taxas de glicólise (Robergs et al., 2004). A concentração citosólica de lactato normalmente excede a de piruvato em pelo menos 10 vezes, o que significa que o lactato, e não o piruvato, é o monocarboxilato predominante que entra no espaço intermembrana da mitocôndria (Brooks et al., 1999). Ao oxidar o lactato no espaço intermembrana mitocondrial, os prótons seriam liberados onde poderiam contribuir para o componente ΔpH da força motora do próton mitocondrial através da membrana interna (Santo-Domingo e Demaurex, 2012), e/ou ser transportados indiretamente para a mitocôndria pelo MAS. Assim como no transporte de fosfato inorgânico e alguns outros substratos e íons (Santo-Domingo e Demaurex, 2012), o transporte mediado por portadores de piruvato através da membrana mitocondrial interna nas mitocôndrias hepáticas de ratos parece estar diretamente acoplado ao protão simpático (ou OH- anti-porto) (Papa et al., 1971; Halestrap, 1975). A oxidação do lactato perto da superfície externa da membrana mitocondrial interna, que libera um próton, contribuiria para o ΔpH, e, por sua vez, o transporte piruvato para a matriz. Adjacente à membrana mitocondrial interna, a relação de ação da massa LDH (ou seja, concentrações de produtos/concentrações de reações) poderia ser amplamente facilitada pelo “sangramento” do piruvato, uma vez que ele é continuamente transportado através da membrana mitocondrial interna imprevisível ao lactato, bem como uma generosa regeneração do NAD+ pela desidrogenase malatada extra-matriz do MAS. Neste modelo, o transporte do piruvato através da membrana mitocondrial interna influenciaria diretamente a taxa de oxidação do ácido láctico logo fora da matriz. A oxidação do lactato nas mitocôndrias seria, portanto, regulada indiretamente na reação PDH na matriz. Isto seria vantajoso porque, ao contrário do LDH, o PDH é altamente regulado através de alosteria e modificação covalente. Como mencionado, a modelagem prevê alta atividade de PDH para ditar o consumo de lactato neuronal in vivo (Neves et al., 2012); e alta atividade de PDH também caracteriza neurônios consumidores de lactato em cultura (Halim et al, 2010).
Considerações metodológicas
Se a oxidação do lactato mitocondrial está funcionalmente ligada à atividade do MAS, então seria importante incluir componentes do MAS em análises in vitro da oxidação do lactato mitocondrial, como o próprio malato ou o oxaloacetato. O malato é a escolha provável, pois é rotineiramente incluído para estimular a respiração in vitro, onde é transportado para a matriz e oxidado pelo malato mitocondrial desidrogenase a oxaloacetato. Este oxaloacetato pode então condensar-se com acetil coA formado, por exemplo, quando é adicionado piruvato. A inclusão do glutamato, além do malato, permite o funcionamento completo do MAS ao nível da respiração mitocondrial. Um aspecto importante, mas às vezes negligenciado da avaliação apropriada da oxidação do lactato mitocondrial é a inclusão do NAD+ como o cofactor necessário para a reacção LDH, e do ADP como o acetor de fosfato para estimular a fosforilação oxidativa (i.e., respiração de estado 3). Além disso, o componente extra-matriz do MAS envolve a reação de malato desidrogenase: oxaloacetato + NADH + H+ ⇌ malato + NAD+. Protocolos experimentais examinando o consumo de oxigênio respiratório em mitocôndrias isoladas a partir do músculo usando altas concentrações de malato (por exemplo, 4 mM; Rasmussen et al., 2002), podem favorecer a reação de desidrogenase do malato no sentido inverso (ou seja, oxidação do malato e produção de NADH + H+) quando adicionado à amostra mitocondrial em combinação com NAD+. De fato, a reversibilidade da EAM tem sido observada em hepatócitos isolados (Berry, 1971) e mitocôndrias com EAM reconstituído (Kunz e Davis, 1991). O efeito líquido desta reversão da EAM na respiração seria reduzir a entrada de malato nas mitocôndrias, formando o oxaloacetato. Mais importante, a reversão evitaria a oxidação do lactato para o piruvato, e o subsequente transporte e oxidação do piruvato na matriz. Soluções para estas barreiras metodológicas à observação da oxidação do lactato mitocondrial in vitro envolvem a inclusão de pelo menos um componente do MAS. Se for adicionado malato, a concentração apropriada deve ser determinada experimentalmente. Incluindo ADP e NAD+ ou NADH (recall, o MAS irá gerar NAD+ para a reação LDH) também é necessário para observar uma oxidação significativa do lactato mitocondrial.
Sumário
A Lactato-MAS é a interação entre o lactato e os vaivéns de malato para translocar a energia redutora para as mitocôndrias, particularmente dentro das células oxidativas, metabolicamente ativas.
Conflict of Interest Statement
O autor declara que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Confidências
Muitos agradecimentos ao Dr. Erich Gnaiger (Universidade Médica de Innsbruck), e ao Dr. George Brooks (Universidade da Califórnia, Berkeley) por cada rascunho crítico anterior deste trabalho.
Barros, L. F. (2013). Sinalização metabólica por lactato no cérebro. Tendências Neuroci. 36, 396-404. doi: 10.1016/j.tins.2013.04.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bergman, B. C., Wolfel, E. E., Butterfield, G. E., Lopaschuk, G. D., Casazza, G. A., Horning, M. A., et al. (1999). Cinética activa do músculo e do lactato de todo o corpo após treino de resistência em homens. J. Appl. Physiol. (1985) 87, 1684-1696.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Berry, M. N. (1971). Redução dependente de energia de piruvato a lactato por células parenquimatosas isoladas intactas do fígado de rato. Bioquímica. Biofísicos. Res. Comun. 44, 1449-1456. doi: 10.1016/S0006-291X(71)80248-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Boumezbeur, F., Petersen, K. F., Cline, G. W., Mason, G. F., Behar, K. L., Shulman, G. I., et al. (2010). A contribuição do lactato de sangue para o metabolismo da energia cerebral em humanos medida pela espectroscopia dinâmica de ressonância magnética nuclear 13C. J. Neurosci. 30, 13983-13991. doi: 10.1523/JNEUROSCI.2040-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., e Pellerin, L. (2013). Desfazendo a complexa natureza metabólica dos astrocitos. Frente. Célula. Neurosci. 7:179. doi: 10.3389/fncel.2013.00179
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Bouzier-Sore, A. K., Voisin, P., Bouchaud, V., Bezancon, E., Franconi, J. M., e Pellerin, L. (2006). Competition between glucose and lactate as oxidative energy substrates in both neurons and astrocytes: a comparative NMR study. Eur. J. Neurosci. 24, 1687-1694. doi: 10.1111/j.1460-9568.2006.05056.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (1998). Utilização de combustível de mamíferos durante exercício prolongado. Comp. Bioquímica. Fisiol. B Biochem. Mol. Biol. 120, 89-107. doi: 10.1016/S0305-0491(98)00025-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2009). Vaivéns de células e de lactato intracelular. J. Physiol. 587, 5591-5600. doi: 10.1113/jphysiol.2009.178350
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Brooks, G. A. (2014). “Sistemas metabólicos: a formação e utilização do lactato”, em History of Exercise Physiology. Human Kinetics, ed C. M. Tipton (Champaign, IL: Human Kinetics), 447-475.
Google Scholar
Brooks, G. A., Butterfield, G. E., Wolfe, R. R., Groves, B. M., Mazzeo, R. S., Sutton, J. R., et al. (1991). Diminuição da dependência do lactato durante o exercício após a aclimatação para 4.300 m. J. Appl. Physiol. (1985). 71, 333-341.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Brooks, G. A., Dubouchaud, H., Brown, M., Sicurello, J. P., e Butz, C. E. (1999). Papel da mitocondrial lactato desidrogenase e da oxidação do lactato no vaivém intracelular de lactato. Proc. Natl. Acad. Sci. U.S.A. 96, 1129-1134. doi: 10.1073/pnas.96.3.1129
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Chatham, J. C., Des Rosiers, C., and Forder, J. R. (2001). Evidência de caminhos separados para a captação e liberação do lactato pelo coração do rato perfundido. Am. J. Physiol. Endocrinol. Metab. 281, E794-E802.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Contreras, L., e Satrustegui, J. (2009). Sinalização de cálcio nas mitocôndrias cerebrais: interação entre o aspartato malato NADH shuttle e as vias uniporter/mitocondrial de desidrogenase de cálcio. J. Biol. Quimiocondria. 284, 7091-7099. doi: 10.1074/jbc.M808066200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Crabtree, B., e Newsholme, E. A. (1978). Sensibilidade de uma reação de quase equilíbrio em uma via metabólica a mudanças na concentração do substrato. Eur. J. Biochem. 89, 19-22. doi: 10.1111/j.1432-1033.1978.tb20891.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Cruz, R. S., de Aguiar, R. A., Turnes, T., Penteado Dos Santos, R., de Oliveira, M. F., e Caputo, F. (2012). Vaivém intracelular: o metabolismo aeróbio do lactato. ScientificWorldJournal 2012:420984. doi: 10.1100/2012/420984
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Dienel, G. A. (2012). Metabolismo do Lactato Cerebral: as descobertas e as controvérsias. J. Cereb. Blood Flow Metab. 32, 1107-1138. doi: 10.1038/jcbfm.2011.175
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Digerness, S. B., e Reddy, W. J. (1976). O vaivém de malate-aspartate na mitocôndria do coração. J. Mol. Cell. Cardiol. 8, 779-785. doi: 10.1016/0022-2828(76)90084-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Doherty, J. R., e Cleveland, J. L. (2013). Alvejando o metabolismo do lactato para a terapêutica do câncer. J. Clin. Invest. 123, 3685-3692. doi: 10.1172/JCI69741
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Donovan, C. M., e Pagliassotti, M. J. (2000). Avaliação quantitativa das vias de eliminação do lactato em tipos de fibras musculares esqueléticas. Med. Sci. Exercício Esportivo. 32, 772-777. doi: 10.1097/00005768-200004000-00009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Elustondo, P. A., White, A. E., Hughes, M. E., Brebner, K., Pavlov, E., e Kane, D. A. (2013). Associação física e funcional da desidrogenase láctica (LDH) com mitocôndrias musculares esqueléticas. J. Biol. Chem. 288, 25309-25317. doi: 10.1074/jbc.M113.476648
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Funfschilling, U., Supplie, L. M., Mahad, D., Boretius, S., Saab, A. S., Edgar, J., et al. (2012). Os oligodendrócitos glicolíticos mantêm a mielina e a integridade axonal a longo prazo. Nature 485, 517-521. doi: 10.1038/nature11007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Gainutdinov, T., Muth, K., Seppet, E., Orynbayeva, Z., et al. (2013). O controle da energização mitocondrial do cérebro pelo cálcio citosólico: o pedal do gás mitocondrial. IUBMB Life 65, 180-190. doi: 10.1002/iub.1131
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Trumbekaite, S., Korzeniewski, B., Gaynutdinov, T., Seppet, E., et al. (2012). Cytosolic Ca2+ regula a energização de mitocôndrias cerebrais isoladas pela formação de piruvato através do vaivém malate-aspartate. Biochem. J. 443, 747-755. doi: 10.1042/BJ20110765
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gertz, E. W., Wisneski, J. A., Stanley, W. C., and Neese, R. A. (1988). Utilização do substrato miocárdico durante o exercício em humanos. Experimentos com isótopos duplos de carboidratos marcados com carbono. J. Clin. Invest. 82, 2017-2025. doi: 10.1172/JCI113822
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2004). Metabolismo do lactato: um novo paradigma para o terceiro milênio. J. Physiol. 558, 5-30. doi: 10.1113/jphysiol.2003.058701
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gladden, L. B. (2007). Existe um vaivém de lactato intracelular no músculo esquelético? J. Fisiol. 582, 899. doi: 10.1113/jphysiol.2007.138487
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Halestrap, A. P. (1975). O portador mitocondrial pirúvio. Cinética e especificidade para substratos e inibidores. Bioquímica. J. 148, 85-96.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Halim, N. D., McFate, T., Mohyeldin, A., Okagaki, P., Korotchkina, L. G., Patel, M. S., et al. (2010). O estado de fosforilação da desidrogenase piruvada distingue fenótipos metabólicos de astrocitos e neurônios cerebrais de ratos cultivados. Glia 58, 1168-1176. doi: 10.1002/glia.20996
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Jacobs, R. A., Meinild, A. K., Nordsborg, N. B., e Lundby, C. (2013). Oxidação do lactato em mitocôndrias musculares esqueléticas humanas. Am. J. Physiol. Endocrinol. Metab. 304, E686-E689. doi: 10.1152/ajpendo.00476.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Joubert, F., Mateo, P., Gillet, B., Beloeil, J. C., Mazet, J. L., and Hoerter, J. A. (2004). CK flux ou transferência direta ATP: versatilidade das vias de transferência de energia evidenciada pela RMN no coração perfumado. Mol. Cell. Bioquímica. 256-257, 43-58. doi: 10.1023/B:MCBI.0000009858.41434.fc
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kauppinen, R. A., Sihra, T. S., e Nicholls, D. G. (1987). O ácido aminooxiacético inibe o transporte de malato aspartato em terminais nervosos isolados e impede que as mitocôndrias utilizem substratos glicolíticos. Biochim. Biofísicos. Acta 930, 173-178. doi: 10.1016/0167-4889(87)90029-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kitaoka, Y., Hoshino, D., e Hatta, H. (2012). Transportador de monocarboxilato e metabolismo do lactato. J. Phys. Fitness Sports Med. 1, 247-252. doi: 10.7600/jpfsm.1.247
CrossRef Full Text | Google Scholar
Kline, E. S., Brandt, R. B., Laux, J. E., Spainhour, S. E., Higgins, E. S., Rogers, K. S., et al. (1986). Localização da L-lactato desidrogenase na mitocôndria. Arco. Biochem. Biófilos. 246, 673-680. doi: 10.1016/0003-9861(86)90323-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Kunz, W. S., e Davis, E. J. (1991). Control of reversible intracellular transfer of reducing potential. Arco. Biochem. Biofísica. 284, 40-46. doi: 10.1016/0003-9861(91)90260-P
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Luft, F. C. (2001). Atualização em acidose láctica para médicos de cuidados críticos. J. Am. Soc. Nephrol. 12 Suppl 17: S15-S19.
Pubmed Abstract | Pubmed Full Text | Google Scholar
McKenna, M. C., Tildon, J. T., Stevenson, J. H., Boatright, R., and Huang, S. (1993). Regulation of energy metabolism in synaptic terminals and cultural rat brain astrocytes: differences revealed using aminooxyacetate. Dev. Neurosci. 15, 320-329. doi: 10.1159/000111351
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
McKenna, M. C., Waagepetersen, H. S., Schousboe, A., and Sonnewald, U. (2006). Neuronal and astrocytic shuttle mechanisms for cytosolic-mitochondrial transfer of reducing equivalentents: current evidence and pharmacological tools. Biochem. Farmacol. 71, 399-407. doi: 10.1016/j.bcp.2005.10.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Neves, A., Costalat, R., e Pellerin, L. (2012). Determinantes dos fenótipos metabólicos das células cerebrais e da utilização do substrato energético desvendados com uma abordagem de modelagem. PLoS Computação. Biol. 8:e1002686. doi: 10.1371/journal.pcbi.1002686
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Newington, J. T., Harris, R. A., and Cumming, R. C. (2013). Reavaliando o metabolismo na doença de Alzheimer a partir da perspectiva do modelo de vaivém de ácido astrocítico-neuron-láctico. J. Neurodegener. Dis. 2013, 13. doi: 10.1155/2013/234572
CrossRef Full Text | Google Scholar
Nguyen, N. H., Brathe, A., e Hassel, B. (2003). A absorção neuronal e metabolismo do glicerol e a expressão neuronal da mitocondrial glicerol-3-fosfato desidrogenase. J. Neurochem. 85, 831-842. doi: 10.1046/j.1471-4159.2003.01762.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
O’Donnell, J. M., Kudej, R. K., LaNoue, K. F., Vatner, S. F., e Lewandowski, E. D. (2004). Transferência limitada de NADH citosólico para mitocôndria com alta carga de trabalho cardíaco. Am. J. Physiol. Circ. do Coração. Physiol. 286, H2237-H2242. doi: 10.1152/ajpheart.01113.2003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Palaiologos, G., Hertz, L., e Schousboe, A. (1988). Evidência de que a atividade de aminotransferase de aspartato e a função portadora de cetodicarboxilato são essenciais para biossíntese do glutamato transmissor. J. Neurochem. 51, 317-320. doi: 10.1111/j.1471-4159.1988.tb04872.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Papa, S., Francavilla, A., Paradies, G., and Meduri, B. (1971). O transporte de pirúvio nas mitocôndrias de fígado de rato. FEBS Lett. 12, 285-288. doi: 10.1016/0014-5793(71)80200-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pardo, B., Contreras, L., Serrano, A., Ramos, M., Kobayashi, K., Iijima, M., et al. (2006). Papel essencial do aralar na transdução de pequenos sinais de Ca2+ para mitocôndrias neuronais. J. Biol. Chem. 281, 1039-1047. doi: 10.1074/jbc.M507270200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Pellerin, L., e Magistretti, P. J. (2012). Doces dezesseis para ANLS. J. Cereb. Blood Flow Metab. 32, 1152-1166. doi: 10.1038/jcbfm.2011.149
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., and Grunnet, N. (2011a). O lactato elevado no cérebro não é causado por uma mudança na relação de lactato desidrogenase A/B. Proc. Natl. Acad. Sci. U.S.A. 108, E21. resposta do autor: E22. doi: 10.1073/pnas.1017750108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Quistorff, B., e Grunnet, N. (2011b). O padrão isoenzimático do LDH não desempenha um papel fisiológico; exceto talvez durante transições rápidas no metabolismo de energia. Envelhecimento (Albany, NY) 3, 457-460.
Google Scholar
Quistorff, B., Secher, N. H., e Van Lieshout, J. J. (2008). O lactato alimenta o cérebro humano durante o exercício. FASEB J. 22, 3443-3449. doi: 10.1096/fj.08-106104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Ramos, M., del Arco, A., Pardo, B., Martinez-Serrano, A., Martinez-Morales, J. R., Kobayashi, K., et al. (2003). Alterações do desenvolvimento do C2+-regulado mitocondrial aspartato-glutamato aralar1 no cérebro e expressão proeminente na medula espinhal. Res. Cerebral. Dev. Brain Res. 143, 33-46. doi: 10.1016/S0165-3806(03)00097-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rasmussen, H. N., van Hall, G., and Rasmussen, U. F. (2002). A desidrogenase láctica não é uma enzima mitocondrial no músculo humano e no músculo vasto lateral do rato. J. Physiol. 541, 575-580. doi: 10.1113/jphysiol.2002.019216
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Robergs, R. A., Ghiasvand, F., and Parker, D. (2004). Bioquímica da acidose metabólica induzida pelo exercício. Am. J. Physiol. Regul. Integr. Comp. Physiol. 287, R502-R516. doi: 10.1152/ajpregu.00114.2004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Rueda, C. B., Llorente-Folch, I., Amigo, I., Contreras, L., Gonzalez-Sanchez, P., Martinez-Valero, P., et al. (2014). Ca2+ regulação da função mitocondrial em neurônios. Biochim. Biophys. Acta 1837, 1617-1624. doi: 10.1016/j.bbabio.2014.04.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Safer, B., Smith, C. M., and Williamson, J. R. (1971). Control of the transport of reducing equivalentents across the mitochondrial membrane in perfused rat heart. J. Mol. Cell. Cardiol. 2, 111-124. doi: 10.1016/0022-2828(71)90065-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sampol, D., Ostrofet, E., Jobin, M. L., Raffard, G., Sanchez, S., Bouchaud, V., et al. (2013). Glucose e metabolismo do lactato no rato desperto e estimulado: um estudo (13)C-NMR. Frente. Neuroenergética 5:5. doi: 10.3389/fnene.2013.00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Santo-Domingo, J., e Demaurex, N. (2012). Perspectivas sobre: Simpósio do SGP sobre fisiologia e medicina mitocondrial: o renascimento do pH mitocondrial. J. Gen. Physiol. 139, 415-423. doi: 10.1085/jgp.201110767
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Schantz, P. G. (1986). Plasticidade do músculo esquelético humano com especial referência aos efeitos do treino físico sobre os níveis enzimáticos dos vaivéns NADH e expressão fenotípica das proteínas miofibrilares lentas e rápidas. Acta Physiol. Escândalo. Suppl. 558, 1-62.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Schurr, A. (2014). Glicólise cerebral: um século de mal-entendidos e equívocos persistentes. Frente. Neurosci. 8:360. doi: 10.3389/fnins.2014.00360
CrossRef Full Text | Google Scholar
Schurr, A., West, C. A., and Rigor, B. M. (1988). Função sináptica suportada por lactato na preparação da fatia hipocampal de rato. Science 240, 1326-1328. doi: 10.1126/science.3375817
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Skilleter, D. N., e Kun, E. (1972). A oxidação do L-lactato por mitocôndrias hepáticas. Arco. Biochem. Biophys. 152, 92-104. doi: 10.1016/0003-9861(72)90197-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Spriet, L. L., Howlett, R. A., e Heigenhauser, G. J. (2000). Uma abordagem enzimática da produção de lactato no músculo esquelético humano durante o exercício. Med. Sci. Exercício Esportivo. 32, 756-763. doi: 10.1097/00005768-200004000-00007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Stainsby, W. N., e Brooks, G. A. (1990). Controle do metabolismo do ácido láctico na contração muscular e durante o exercício. Exercício. Sport Sci. Rev. 18, 29-63. doi: 10.1249/00003677-199001000-00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sun, F., Dai, C., Xie, J., and Hu, X. (2012). Questões bioquímicas na estimativa da razão citosólica livre de NAD/NADH. PLoS ONE 7:e34525. doi: 10.1371/journal.pone.0034525
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Todd, J. J. (2014). Lactato: valioso para o desempenho físico e manutenção da função cerebral durante o exercício. Biosci. Horiz. 7, 1-7. doi: 10.1093/biohorizons/hzu001
CrossRef Full Text | Google Scholar
van Hall, G. (2010). Cinética do lactato em tecidos humanos em repouso e durante o exercício. Acta Physiol. (Oxf.) 199, 499-508. doi: 10.1111/j.1748-1716.2010.02122.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
van Hall, G., Stromstad, M., Rasmussen, P., Jans, O., Zaar, M., Gam, C., et al. (2009). O lactato de sangue é uma importante fonte de energia para o cérebro humano. J. Cereb. Blood Flow Metab. 29, 1121-1129. doi: 10.1038/jcbfm.2009.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Voet, D., Voet, J. G., e Pratt, C. W. (2011). Fundamentos da Bioquímica: Vida ao Nível Molecular. Hoboken, NJ: Wiley.
Google Scholar
Williamson, D. H., Lund, P., e Krebs, H. A. (1967). O estado redox de nicotinamida-adenina dinucleotídeo livre no citoplasma e mitocôndria do fígado de rato. Biochem. J. 103, 514-527.
Pubmed Abstract | Pubmed Full Text | Google Scholar