US Pharm. 2011;36(5):HS4-HS8.
Odhaduje se, že v současné době trpí chronickou bolestí 50 milionů Američanů a dalších 25 milionů trpí akutní bolestí.1 Každý rok se téměř polovina všech Američanů dostaví ke svému lékaři s hlavní stížností na bolest.2 Základem léčby středně silné až silné bolesti jsou opioidní analgetika, k nimž se podle potřeby přidávají další analgetika, jako jsou nesteroidní protizánětlivé léky (NSAID) a další adjuvantní terapie, včetně tricyklických antidepresiv (TCA), antikonvulziv a lokálních anestetik.3,4 Podle průzkumu Americké společnosti pro bolest (APS) provedeného v roce 1999 se však více než čtyřem z deseti lidí se středně silnou až silnou bolestí nedostává úlevy.5 Z těch, kterým se nedostává úlevy od bolesti, mohou někteří pociťovat bolest, která nereaguje na opioidy nebo jinou farmakoterapii navzdory vhodnému užívání těchto látek, jako je tomu u opioidní rezistence a neuropatické bolesti.
Opioidní rezistence a neuropatická bolest
Opioidní rezistence je definována jako nereagování na intravenózní morfin sulfát v dávce nejméně 100 mg za hodinu (nebo ekvivalentní dávku jiného opioidu), trvale vysoké hodnocení bolesti a nezmírnění bolesti ani po zdvojnásobení dávky opioidu. Rezistence na opioidy byla zjištěna u mnoha chorobných stavů včetně rakoviny, chronické bolesti, neuropatie, komplexního regionálního bolestivého syndromu, postherpetické neuralgie a pankreatitidy.6 Neuropatická bolest je důsledkem poškození periferních nebo centrálních nervů a běžně se léčí přípravky, jako jsou TCA a antikonvulziva. Bohužel u většiny pacientů nedochází při užívání těchto látek k výrazné úlevě.7,8 Jak při rezistenci na opioidy, tak při neuropatické bolesti mohou být jednou z možností antagonisté N-metyl-d-aspartátu (NMDA).
Antagonisté NMDA receptorů
NMDA je receptor pro excitační neurotransmiter glutamát, který se uvolňuje při škodlivých periferních podnětech.7,9 Aktivace NMDA receptorů je spojena s hyperalgezií, neuropatickou bolestí a sníženou funkčností opioidních receptorů. Hyperalgezie a neuropatická bolest jsou důsledkem zvýšené senzitizace míšních neuronů, což vede ke zvýšené úrovni bolesti.7,9,10 Snížená funkce opioidních receptorů je způsobena snížením citlivosti opioidních receptorů. Tato snížená citlivost se následně projevuje tolerancí k opioidům, protože pacienti budou k dosažení stejných terapeutických účinků potřebovat vyšší dávky opioidů.9 Proto mohou mít antagonisté NMDA v těchto oblastech léčby bolesti svou roli.10
K dispozici je několik antagonistů NMDA receptorů: ketamin, metadon, memantin, amantadin a dextrometorfan (TABULKA 1).11,12 Každý z nich se liší mírou své aktivity na NMDA receptoru. Ketamin je silný antagonista NMDA, zatímco ostatní jsou slabší blokátory NMDA receptorů.13 Závažnost a četnost nežádoucích účinků závisí na afinitě k NMDA receptoru. U dospělých jsou nežádoucími účinky antagonistů NMDA především nežádoucí účinky na centrální nervový systém (CNS), včetně halucinací, závratí, únavy, bolesti hlavy, mimotělních pocitů, nočních můr a smyslových změn. Vzhledem k tomu, že ketamin je silným antagonistou NMDA, je hůře snášen než ostatní antagonisté kvůli vyššímu výskytu nežádoucích účinků, zejména halucinací a disociativního psychického stavu.7
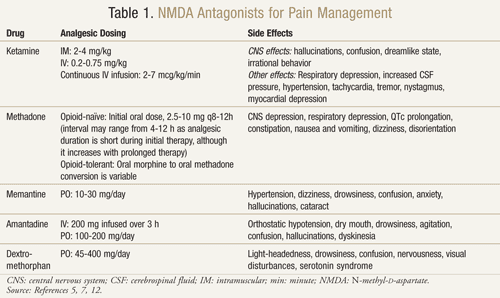
Ketamin: Ketamin se ukázal jako prospěšný v mnoha případech bolesti. V klinické studii přineslo přidání nízké dávky intravenózního ketaminu k opioidům oproti samotným opioidům pooperačně po velké břišní operaci lepší analgezii, menší sedaci a menší potřebu morfinu nebo zásahu lékaře ke zvládnutí bolesti.14 Byla také provedena randomizovaná, dvojitě zaslepená, zkřížená, placebem kontrolovaná studie s cílem potvrdit předchozí výsledky, které naznačovaly, že ketamin je účinný u pacientů s rakovinou, kteří byli rezistentní na morfin.15 Každý z 10 zařazených pacientů dostával kromě morfinu ketamin v dávce 0,25 mg/kg, 0,50 mg/kg a placebo ve 3 různých dnech s odstupem nejméně 2 dnů. Výsledky ukázaly, že ketamin v obou dávkách významně snižoval bolest ve srovnání s placebem. Pacienti, kteří dostávali 0,5 mg/kg, měli lepší analgetický účinek než pacienti na 0,25 mg/kg (P <,05). Významné nežádoucí účinky se vyskytly u čtyř pacientů, kteří měli halucinace, a u dvou pacientů, kteří měli nepříjemný pocit, který označovali jako „prázdnou hlavu“. K úspěšnému zvrácení těchto nežádoucích účinků na CNS dostali pacienti diazepam 1 mg. Pacienti pociťovali významnou ospalost u obou dávek ketaminu, i když nejvýraznější byla u dávky 0,5 mg/kg (P <,05).15
V prospektivní, multicentrické, nezaslepené, otevřené studii na 39 pacientech bylo prokázáno, že „burst“ infuze ketaminu má významný účinek na bolest související s nádorovým onemocněním u pacientů, kteří byli buď rezistentní na opioidy i po přidání adjuvantních analgetik, nebo netolerovali nežádoucí účinky opioidů.16 Burst ketamin byl definován jako krátkodobá (3-5denní) subkutánní infuze, která začínala počáteční dávkou 100 mg/24 h a poté se postupně zvyšovala na 300 mg/24 h a 500 mg/24 h, pokud bolest pacienta přetrvávala bez nesnesitelných vedlejších účinků. Úleva od bolesti byla analyzována podle typu bolesti (somatická, viscerální nebo neuropatická). U pacientů s více než jedním typem bolesti byla každá bolest analyzována zvlášť. Ze 43 bolestí léčených u 39 pacientů se u 29 (67 %) projevilo alespoň 50% snížení na slovní hodnotící škále (0 = žádná bolest, 10 = nejhorší možná bolest) podpořené významným snížením spotřeby opioidů v průběhu 24 hodin a/nebo zlepšením mobility nebo funkčního stavu. Dvanáct pacientů hlásilo nežádoucí účinky na CNS včetně pocitu „odstupu“, halucinací, ospalosti a závratí.16
Methadon: Metadon je dalším antagonistou NMDA, který byl studován u rezistence na opioidy a neuropatické bolesti. Ukázalo se, že je vhodnou volbou pro použití jako náhradní opioid u pacientů, kteří jsou špatně kontrolováni nebo se u nich při užívání jiných opioidů objevují nežádoucí účinky omezující dávku.17 U 80 % pacientů s rakovinou s nekontrolovanou bolestí nebo významnými nežádoucími účinky metadon prokázal snížení bolesti a nežádoucích účinků po přechodu z morfinu na metadon.18
Metadon rovněž prokázal účinnost u pacientů s refrakterní neuropatickou bolestí. Ve dvojitě zaslepené, randomizované, kontrolované, zkřížené studii provedené u 18 pacientů, kteří nereagovali na tradiční analgetické režimy pro svou chronickou neuropatickou bolest, prokázal perorální metadon v dávce 10 mg dvakrát denně statisticky významné zmírnění bolesti v maximální intenzitě bolesti (P = .013), průměrné intenzitě bolesti (P = .020) a úlevě od bolesti (P = .015) ve srovnání s placebem.19 Metadon v dávce 5 mg dvakrát denně rovněž prokázal analgetické zlepšení v maximální intenzitě bolesti a úlevě od bolesti; nedosáhl však statistické významnosti. Šest pacientů ze studie odstoupilo z důvodu nežádoucích účinků včetně nevolnosti, zvracení, závratí, pocení a dezorientace se silnými bolestmi hlavy. Ostatní, kteří studii dokončili, uváděli pouze mírné až středně závažné nežádoucí účinky.19
Gagnon et al provedli studii metadonu v léčbě neuropatické bolesti u 18 pacientů, kteří buď nedostávali opioidy proti bolesti, nebo dostávali denní dávku opioidů ne vyšší než ekvivalent 120 mg perorálního morfinu kvůli nežádoucím účinkům, které bránily dalšímu zvyšování dávky.8 Dávky metadonu byly zahajovány v rozmezí 2 mg až 5 mg třikrát denně v závislosti na věku a titrovány až do stabilní dávky na základě klinické odpovědi a nežádoucích účinků. V případě průlomové bolesti byly podle potřeby povoleny dávky metadonu 2 mg každé 4 až 6 hodin. Pacienti byli sledováni po dobu s mediánem 106 dní (16 až 466 dní). U všech pacientů došlo při léčbě metadonem ke zlepšení skóre bolesti na vizuální analogové škále (VAS; 0-10 cm, kde 0 = žádná bolest a 10 = nejhorší možná bolest). Průměrná hodnota VAS ± směrodatná odchylka (SD) před léčbou byla 7,7 ± 1,5 cm a při užívání metadonu se snížila na 1,4 ± 1,7 cm (P <,0001). Devět z 18 pacientů (50 %) nemělo během užívání stabilní dávky metadonu vůbec žádnou bolest. Ze 13 pacientů, kteří měli alodynii jako součást neuropatické bolesti, došlo u 9 (70 %) k úplnému vymizení (žádná klinicky detekovatelná alodynie) a u 4 (30 %) k částečnému vymizení (alodynie na <50 % plochy). Z 8 pacientů, kteří měli vystřelující bolest, všech 8 (100 %) uvedlo kontrolu symptomů při stabilní dávce metadonu. Nežádoucí účinky zahrnovaly mírnou ospalost a nevolnost, která byla přechodná, spolu se zácpou, která byla vyřešena projímadly.8
Naneštěstí je užívání metadonu často náročné vzhledem k jeho dlouhému a proměnlivému poločasu přibližně 8 až 59 hodin, nutnému monitorování EKG kvůli možnému prodloužení QTc a mnoha lékovým interakcím s jinými látkami prodlužujícími QTc a také s inhibitory CYP3A4 a CYP2D6.12 Kromě toho je konverze opioidů obtížná, protože se zvyšující se dávkou morfinu se zvyšuje účinnost metadonu. Proto nelze nalézt jednotný poměr pro ekvianalgetické dávkování mezi morfinem a metadonem.17
Memantin: Další antagonisté NMDA receptorů, jako je memantin, amantadin a dextrometorfan, vykazují u neuropatické bolesti smíšené výsledky.20 Memantin má bezpečný profil nežádoucích účinků a rychlý nástup účinku, nicméně v randomizované, dvojitě zaslepené, zkřížené studii, kde byl memantin podáván skupině 19 pacientů s chronickou bolestí v důsledku poškození nervu po operaci, nebyl zjištěn žádný rozdíl ve snížení bolesti memantinem oproti placebu.21 Kromě toho studie s memantinem u pacientů se senzorickou neuropatií spojenou s HIV neprokázala pozitivní výsledky.22
Amantadin: Amantadin je dalším lékem, který v klinických studiích vykazoval smíšené výsledky. Dvojitě zaslepená, randomizovaná, placebem kontrolovaná studie byla provedena u 15 pacientů s rakovinou, kteří měli chirurgickou neuropatickou bolest.23 V randomizovaném pořadí dostávali pacienti s odstupem 1 týdne infuzi 200 mg amantadinu nebo placeba. Spontánní a evokovaná bolest byla měřena 48 hodin před léčbou, během ní a po ní. Na konci infuze došlo v průměru k 85% snížení bolesti u amantadinu oproti 45% u placeba (P = .009). Při porovnání průměrné intenzity bolesti 48 hodin před léčbou a po ní došlo u amantadinu ke snížení bolesti o 31 % (P = .006), zatímco u placeba bylo zaznamenáno nevýznamné snížení bolesti o 6 % (P = .40).23
Na rozdíl od těchto pozitivních výsledků provedli Fukui et al studii amantadinu u 19 pacientů, kteří nereagovali na konvenční léčbu neuropatické bolesti, včetně antikonvulziv, antidepresiv a nervových blokád.24 Pacienti začali užívat perorální amantadin v dávce 100 mg/den po dobu 1 týdne a poté byl titrován na 200 mg/den. Výsledky ukázaly snížení bolesti pouze u 2 (10,5 %) z 19 pacientů. Nežádoucí účinky se vyskytly u 52,6 % pacientů, včetně sucha v ústech, ospalosti, halucinací, excitace, podráždění, závratí, dyskineze a vypadávání vlasů.24
Dextrometorfan: Dextrometorfan, který se běžně vyskytuje ve volně prodejných lécích proti kašli, byl také přezkoumán z hlediska jeho použití u neuropatické bolesti. V placebem kontrolované, dvojitě zaslepené, randomizované zkřížené studii dostávalo 15 pacientů s neuropatickou bolestí 270 mg dextrometorfanu a placeba v náhodném pořadí oddělených 1týdenním vymývacím obdobím.25 Výsledky ukázaly 30% snížení bolesti po jedné dávce dextrometorfanu ve srovnání s placebem. Po 1,5 hodině a 2,5 až 4 hodinách od podání léku byl zjištěn statisticky významný rozdíl ve snížení bolesti dextrometorfanu oproti placebu (P <,05 a P <,002). Nežádoucí účinky zahrnovaly závratě, ospalost, poruchy vidění a návaly horka; žádný z nich nebyl závažný.25
Jelikož se dextrometorfan metabolizuje prostřednictvím CYP2D6 na aktivní metabolit dextrorphan, byli porovnáváni také extenzivní versus špatní metabolizátoři. U pacientů, kteří byli extenzivními metabolizátory dextrometorfanu, byla analgezie lepší než u špatných metabolizátorů. Byl učiněn závěr, že dextrometorfan má potenciál v léčbě neuropatické bolesti, ale k ověření jeho použití jsou zapotřebí rozsáhlejší studie.25
Úloha farmaceuta
Farmaceuti mohou pochopením současné úlohy antagonistů NMDA významně ovlivnit péči o pacienty, kterým se nedostává adekvátní úlevy od bolesti v důsledku rezistence na opioidy a neuropatické bolesti, která není adekvátně kontrolována běžně používanými přípravky. Vzhledem k tomu, že metadon se v současné době v této oblasti ukazuje jako velmi slibný, je důležité, aby lékárníci rozuměli tomu, jak usnadnit bezpečné používání této látky s ohledem na správné dávkování, lékové interakce a sledování nežádoucích účinků.
Závěr
Antagonisté NMDA jsou skvělým místem pro zkoumání v léčbě neuropatické bolesti a bolesti rezistentní na opioidy. Mezi v současnosti testované antagonisty NMDA patří ketamin, metadon, memantin, amantadin a dextrometorfan. Dosavadní klinické studie prokázaly význam ketaminu a metadonu při snižování neuropatické bolesti a bolesti rezistentní na opioidy. Obavy však vyvolávají nežádoucí účinky na CNS, zejména u ketaminu. Memantin, amantadin a dextrometorfan jsou slabší antagonisté NMDA s bezpečnějším profilem toxicity, ale v těchto případech bolesti neprokázaly konzistentní přínos.12 K určení jejich nejvhodnějšího použití při léčbě bolesti a také k účinnému zvládání jejich nežádoucích účinků je zapotřebí dalších studií s NMDA-antagonisty.
1. Weiner K. Problematika bolesti. Bolest je epidemie. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Dostupné 4. října 2010.
2. Turk DC. Bolest bolí – jednotlivce, významné osoby i společnost! Bulletin APS. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Přístup 4. října 2010.
3. Chronická bolest v Americe: překážky na cestě k úlevě. Americká společnost pro bolest. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Přístup 7. ledna 2011.
4. Health Care Guidelines (Směrnice pro zdravotní péči): Hodnocení a léčba akutní bolesti. Institute For Clinical Systems Improvement. Vydání šesté. Březen 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Přístupné
8. dubna 2011.
5. Lussier D, Huskey AG, Portenoy RK. Adjuvantní analgetika v léčbě nádorové bolesti. Onkologický časopis.
6. McCormick WC, Schreiner RL. Diagnostika a léčba bolesti rezistentní na opiáty u pokročilého AIDS. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. NMDA antagonisté a neuropatická bolest – vícenásobné lékové cíle a vícenásobné použití. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadone in the treatment of neuropathic pain. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Aktuální informace o neurofyziologii přenosu a modulace bolesti: zaměření na NMDA-receptor. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Mechanismy tolerance a hyperalgezie vyvolané opioidy. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. Použití antagonistů NMDA receptorů v léčbě chronické bolesti. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Přístup 8. dubna 2011.
12. Lexicomp Online. www.lexi.com. Přístup 12. dubna 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication &Léčba léky proti bolesti. Rocklin, Kalifornie: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Přístup 8. dubna 2011.
14. Bhavani-Shankar K, Jasmeet SO. Management pooperační bolesti. UptoDate. May 28, 2010. www.uptodate.com. Přístup 4. října 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgetický účinek intravenózního ketaminu u pacientů s rakovinou na terapii morfinem: randomizovaná, kontrolovaná, dvojitě zaslepená, zkřížená, dvoudávková studie. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. „Burst“ ketamin pro refrakterní nádorovou bolest: otevřený audit 39 pacientů. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Léčba bolestivých stavů metadonem. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Switching from morphine to improve analgesia and tolerability in cancer patients: a prospective study. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Low-dose methadone has an analgesic effect in neuropathic pain: a double-blind randomized controlled crossover trial. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Léčba nádorové bolesti: adjuvantní analgetika. UptoDate. May 28, 2010. www.uptodate.com. Přístup 4. října 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantin (antagonista N-methyl-d-aspartátových receptorů) v léčbě neuropatické bolesti po amputaci nebo operaci: randomizovaná, dvojitě zaslepená, zkřížená studie. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. Placebem kontrolovaná studie memantinu pro léčbu senzorické neuropatie spojené s virem lidské imunodeficience. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. Antagonista NMDA receptorů amantadin snižuje chirurgickou neuropatickou bolest u pacientů s rakovinou: dvojitě zaslepená, randomizovaná, placebem kontrolovaná studie. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Klinické použití amantadinu, antagonisty NMDA, u neuropatické bolesti. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Analgetický účinek dextrometh-orphaninu u neuropatické bolesti. Acta Anaesthesiol Scand. 2004;48:328-336.