US Pharm. 2011;36(5):HS4-HS8.
Se estimează că 50 de milioane de americani suferă în prezent de dureri cronice, alături de alte 25 de milioane care suferă de dureri acute.1 În fiecare an, aproape jumătate dintre americani se prezintă la medicul lor cu o plângere principală de durere.2 Pilonul principal al tratamentului durerii moderate până la severe este reprezentat de analgezicele opioide, la care se adaugă alte analgezice, cum ar fi medicamentele antiinflamatoare nesteroidiene (AINS) și alte terapii adjuvante, inclusiv antidepresivele triciclice (TCA), anticonvulsivantele și anestezicele topice, după caz.3,4 Cu toate acestea, mai mult de patru din 10 persoane cu durere moderată până la severă nu sunt ameliorate, conform unui sondaj al Societății Americane pentru Durere (APS) realizat în 1999.5 Dintre cei care nu sunt ameliorate, unii pot avea dureri care nu răspund la opioide sau la alte terapii medicamentoase, în ciuda utilizării adecvate a acestor agenți, ca în cazul rezistenței la opioide și al durerii neuropatice.
Rezistența la opioide și durerea neuropată
Rezistența la opioide este definită ca lipsa de răspuns la sulfat de morfină IV de cel puțin 100 mg pe oră (sau la o doză echivalentă de alt opioid), evaluări constant ridicate ale durerii și durere care nu este ameliorată chiar și după ce doza de opioide este dublată. Rezistența la opioide a fost constatată într-o multitudine de stări de boală, inclusiv cancerul, durerea cronică, neuropatia, sindromul durerii regionale complexe, nevralgia postherpetică și pancreatita.6 Durerea neuropată rezultă în urma unei leziuni a nervilor periferici sau centrali și este tratată în mod obișnuit cu agenți precum TCA și anticonvulsivante. Din păcate, majoritatea pacienților nu experimentează o ameliorare semnificativă cu acești agenți.7,8 Atât în cazul rezistenței la opioide, cât și în cazul durerii neuropatice, antagoniștii N-metil-d-aspartat (NMDA) pot fi o opțiune.
Antagoniștii receptorilor NMDA
NMDA este un receptor pentru neurotransmițătorul excitator glutamat, care este eliberat la stimuli periferici nocivi.7,9 Activarea receptorilor NMDA a fost asociată cu hiperalgezia, durerea neuropată și funcționalitatea redusă a receptorilor opioizi. Hiperalgezia și durerea neuropată sunt rezultatul sensibilizării crescute a neuronilor spinali, ceea ce duce la un nivel sporit de durere.7,9,10 Funcția redusă a receptorilor opioizi este cauzată de o scădere a sensibilității receptorilor opioizi. Această sensibilitate scăzută, la rândul său, se traduce prin toleranță la opioide, deoarece pacienții vor avea nevoie de doze mai mari de opioide pentru a obține aceleași efecte terapeutice.9 Prin urmare, antagoniștii NMDA ar putea avea un rol în aceste domenii de gestionare a durerii.10
Există mai mulți antagoniști ai receptorilor NMDA disponibili: ketamină, metadonă, memantină, amantadină și dextrometorfan (TABELUL 1).11,12 Fiecare dintre aceștia diferă în funcție de nivelul lor de activitate asupra receptorilor NMDA. Ketamina este un antagonist NMDA puternic, în timp ce ceilalți sunt blocanți mai slabi ai receptorilor NMDA.13 Severitatea și frecvența efectelor secundare depind de afinitatea pentru receptorul NMDA. La adulți, efectele adverse ale antagoniștilor NMDA sunt în principal efecte secundare la nivelul sistemului nervos central (SNC), inclusiv halucinații, amețeli, amețeli, oboseală, cefalee, senzație de ieșire din corp, coșmaruri și modificări senzoriale. Deoarece ketamina este un antagonist NMDA puternic, este mai puțin tolerabilă decât ceilalți antagoniști din cauza unei incidențe mai mari a efectelor secundare, în special halucinații și o stare mentală disociativă.7
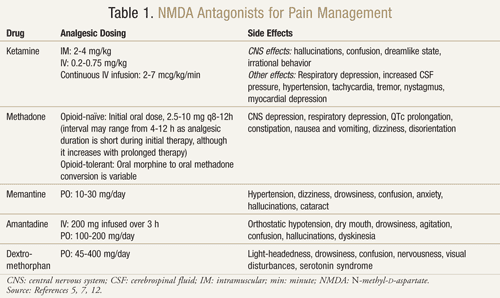
Ketamina: Ketamina s-a dovedit a fi benefică în multiple contexte de durere. Într-un studiu clinic, adăugarea unei doze mici de ketamină IV la opioide față de opioidele singure, postoperator după o intervenție chirurgicală abdominală majoră, a produs o analgezie mai bună, mai puțină sedare și o mai mică nevoie de morfină sau de intervenția medicului pentru a gestiona durerea.14 Un studiu randomizat, dublu-orb, încrucișat, controlat cu placebo a fost, de asemenea, efectuat pentru a confirma rezultatele anterioare care sugerau că ketamina era eficientă la pacienții cu cancer care erau rezistenți la morfină.15 Fiecare dintre cei 10 pacienți înrolați a primit ketamină în doze de 0,25 mg/kg, 0,50 mg/kg și placebo în 3 zile separate, la cel puțin 2 zile distanță, în plus față de morfină. Rezultatele au arătat că ketamina a redus semnificativ durerea la ambele doze în comparație cu placebo. Pacienții care au primit 0,5 mg/kg au avut un efect analgezic mai bun decât pacienții cu 0,25 mg/kg (P <.05). Efecte adverse semnificative au apărut la patru pacienți care au avut halucinații și la doi pacienți care au avut o senzație neplăcută la care s-au referit ca fiind „capul gol”. Pacienții au primit diazepam 1 mg pentru o inversare cu succes a acestor efecte adverse asupra SNC. Pacienții au prezentat o somnolență semnificativă cu ambele doze de ketamină, deși aceasta a fost mai pronunțată la doza de 0,5 mg/kg (P <.05).15
Într-un studiu prospectiv, multicentric, nevăzut, deschis, efectuat pe 39 de pacienți, s-a demonstrat că perfuzia de ketamină „în rafală” a avut un efect semnificativ asupra durerii legate de cancer la pacienții care erau fie rezistenți la opioide chiar și cu adăugarea de analgezice adjuvante, fie intoleranți la efectele adverse ale opioidelor.16 Ketamina în rafală a fost definită ca o perfuzie subcutanată de scurtă durată (3-5 zile), începând cu o doză inițială de 100 mg/24 h, apoi crescând la 300 mg/24 h și 500 mg/24 h în mod progresiv, dacă durerea pacientului a fost persistentă fără efecte secundare intolerabile. Ameliorarea durerii a fost analizată în funcție de tipul de durere (somatică, viscerală sau neuropată). Acei pacienți cu mai multe tipuri de durere au avut fiecare dintre durerile lor analizate separat. Dintre cele 43 de dureri tratate la 39 de pacienți, 29 (67%) au prezentat o scădere de cel puțin 50% pe scara de evaluare verbală (0 = nicio durere, 10 = cea mai mare durere posibilă), susținută de o reducere semnificativă a utilizării de opioide pe parcursul a 24 de ore și/sau o îmbunătățire a mobilității sau a stării funcționale. Doisprezece pacienți au raportat efecte adverse la nivelul SNC, inclusiv senzația de „distanțare”, halucinații, somnolență și amețeli.16
Metadonă: Metadona este un alt antagonist NMDA care a fost studiat în rezistența la opioide și durerea neuropată. S-a demonstrat că este o opțiune bună pentru a fi utilizată ca opioid de înlocuire la pacienții care sunt slab controlați sau care prezintă efecte adverse limitatoare de doză în timp ce iau alte opioide.17 La 80% dintre pacienții cu cancer cu durere necontrolată sau cu efecte secundare semnificative, metadona a demonstrat o reducere a durerii și a efectelor adverse după trecerea de la morfină la metadonă.18
Metadona și-a demonstrat, de asemenea, eficacitatea la pacienții cu durere neuropatică refractară. Într-un studiu dublu-orb, randomizat, controlat, încrucișat, efectuat la 18 pacienți care nu au răspuns la regimurile analgezice tradiționale pentru durerea lor neuropată cronică, metadona orală de 10 mg de două ori pe zi a arătat o ameliorare semnificativă din punct de vedere statistic a durerii în ceea ce privește intensitatea maximă a durerii (P = 0,013), intensitatea medie a durerii (P = 0,020) și ameliorarea durerii (P = 0,015) în comparație cu placebo.19 Metadona la 5 mg de două ori pe zi a arătat, de asemenea, o ameliorare analgezică în ceea ce privește intensitatea maximă a durerii și ameliorarea durerii; cu toate acestea, nu a atins semnificația statistică. Șase pacienți s-au retras din studiu din cauza evenimentelor adverse, inclusiv greață, vărsături, amețeli, transpirații și dezorientare cu dureri de cap severe. Alții care au finalizat studiul au raportat doar că au avut efecte adverse ușoare până la moderate.19
Gagnon și colab. au efectuat un studiu al metadonei în tratamentul durerii neuropatice la 18 pacienți care fie nu primeau opioide pentru durerea lor, fie primeau o doză zilnică de opioide nu mai mare decât echivalentul a 120 mg de morfină orală din cauza efectelor secundare care împiedicau o creștere suplimentară a dozei.8 Dozele de metadonă au fost începute între 2 mg și 5 mg de trei ori pe zi în funcție de vârstă și au fost titrate până la o doză stabilă pe baza răspunsului clinic și a efectelor adverse. Metadona de 2 mg la fiecare 4 până la 6 ore a fost permisă pentru durerea de pătrundere, la nevoie. Pacienții au fost urmăriți timp de o medie de 106 zile (16 până la 466 de zile). Toți pacienții au înregistrat o îmbunătățire a scorurilor de durere pe scara analogică vizuală (VAS; 0-10 cm, unde 0 = nicio durere și 10 = cea mai mare durere posibilă) cu tratamentul cu metadonă. Media VAS înainte de tratament ± deviația standard (SD) a fost de 7,7 ± 1,5 cm și a scăzut la 1,4 ± 1,7 cm atunci când au luat metadonă (P <.0001). Nouă din 18 (50%) nu au avut deloc durere în timp ce se aflau pe o doză stabilă de metadonă. Dintre cei 13 pacienți care au avut alodinie ca parte a durerii neuropatice, 9 (70%) au prezentat o rezoluție completă (fără alodinie detectabilă clinic) și 4 (30%) au avut o rezoluție parțială (alodinie în <50% din suprafață). Dintre cei 8 pacienți care au avut dureri prin împușcare, toți cei 8 (100%) au raportat un control al simptomelor cu o doză stabilă de metadonă. Efectele secundare au inclus somnolență ușoară și greață care au fost trecătoare, împreună cu constipație care a fost rezolvată cu laxative.8
Din păcate, metadona este adesea dificil de utilizat, având în vedere timpul său de înjumătățire lung și variabil de aproximativ 8 până la 59 de ore, monitorizarea ECG necesară pentru o posibilă prelungire a QTc și numeroase interacțiuni medicamentoase cu alți agenți care prelungesc QTc, precum și cu inhibitorii CYP3A4 și CYP2D6.12 În plus, conversia opioidelor este dificilă, deoarece metadona crește în potență odată cu creșterea dozelor de morfină. Prin urmare, nu se poate găsi un raport unic pentru o dozare echianalgezică între morfină și metadonă. 17
Memantină: Alți antagoniști ai receptorilor NMDA, cum ar fi memantina, amantadina și dextrometorfanul, au prezentat rezultate mixte în durerea neuropată.20 Memantina are un profil sigur de efecte secundare și un debut rapid de acțiune; cu toate acestea, într-un studiu randomizat, dublu-orb, încrucișat, în care memantina a fost administrată unui grup de 19 pacienți cu durere cronică datorată leziunilor nervoase după o intervenție chirurgicală, nu a existat nicio diferență în reducerea durerii cu memantina față de placebo.21 În plus, un studiu cu memantină la pacienții cu neuropatie senzorială asociată cu HIV nu a prezentat rezultate pozitive.22
Amantadina: Amantadina este un alt medicament care a prezentat rezultate mixte în studiile clinice. Un studiu dublu-orb, randomizat, controlat cu placebo a fost efectuat la 15 pacienți cu cancer care aveau dureri neuropatice chirurgicale.23 Într-o ordine randomizată, pacienții au primit o perfuzie de 200 mg de amantadină sau placebo la o săptămână distanță unul de celălalt. Durerea spontană și cea evocată au fost măsurate cu 48 de ore înainte, în timpul și după tratament. În medie, s-a înregistrat o reducere a durerii de 85% cu amantadină față de 45% cu placebo (P = 0,009) la sfârșitul perfuziei. Atunci când s-a comparat intensitatea medie a durerii cu 48 de ore înainte și după tratament, amantadina a avut o reducere a durerii cu 31% (P = 0,006), în timp ce placebo a prezentat o reducere nesemnificativă a durerii de 6% (P = 0,40).23
În contrast cu aceste rezultate pozitive, Fukui și colab. au efectuat un studiu cu amantadină la 19 pacienți care nu au răspuns la tratamentele convenționale pentru durerea neuropatică, inclusiv anticonvulsivante, antidepresive și blocuri nervoase.24 Pacienții au început cu amantadină orală 100 mg/zi timp de o săptămână și au fost titrați la 200 mg/zi. Rezultatele au arătat o reducere a durerii doar la 2 (10,5%) dintre cei 19 pacienți. Efecte adverse au fost resimțite la 52,6% dintre pacienți, inclusiv uscăciune a gurii, somnolență, halucinații, excitație, iritare, amețeli, dischinezie și căderea părului.24
Dextrometorfan: Frecvent întâlnit în medicamentele OTC pentru tuse, dextrometorfanul a fost, de asemenea, revizuit pentru utilizarea sa în durerea neuropatică. Într-un studiu încrucișat randomizat, dublu-orb, controlat cu placebo, 15 pacienți cu dureri neuropatice au primit 270 mg de dextrometorfan și placebo în ordine aleatorie, separate de o perioadă de spălare de o săptămână.25 Rezultatele au arătat o reducere cu 30% a durerii după o singură doză de dextrometorfan comparativ cu placebo. După 1,5 ore și 2,5 până la 4 ore de la momentul administrării medicamentelor, a existat o diferență semnificativă din punct de vedere statistic în ceea ce privește reducerea durerii în cazul dextrometorfanului față de placebo (P <.05 și, respectiv, P <.002). Efectele secundare au inclus amețeală, somnolență, tulburări de vedere și bufeuri; niciuna nu a fost severă.25
Deoarece dextrometorfanul este metabolizat prin intermediul CYP2D6 în metabolitul activ dextrorfan, au fost comparați, de asemenea, metabolizatorii extensivi față de cei slab metabolizatori. Pacienții care erau metabolizatori extensivi ai dextrometorfanului au prezentat o analgezie mai bună decât cei slab metabolizatori. S-a concluzionat că dextrometorfanul are potențial în tratamentul durerii neuropatice, dar sunt necesare studii mai extinse pentru a valida utilizarea sa.25
Rolul farmacistului
Farmaciștii pot avea un mare impact asupra îngrijirii pacienților care nu beneficiază de o ameliorare adecvată a durerii din cauza rezistenței la opioide și a durerii neuropatice care nu este controlată în mod adecvat de agenții utilizați în mod obișnuit, prin înțelegerea rolului actual al antagoniștilor NMDA. Întrucât metadona s-a dovedit în prezent foarte promițătoare în acest domeniu, este important ca farmaciștii să înțeleagă cum să faciliteze utilizarea în siguranță a acestui agent în ceea ce privește dozarea adecvată, interacțiunile medicamentoase și monitorizarea efectelor adverse.
Concluzie
Antagoniștii NMDA sunt un loc minunat de explorat în tratamentul durerii rezistente la opioide și neuropatice. Antagoniștii NMDA care au fost testați în prezent includ ketamina, metadona, memantina, amantadina și dextrometorfanul. Studiile clinice de până acum au demonstrat valoarea ketaminei și a metadonei în reducerea durerii neuropatice și a durerii rezistente la opioide. Cu toate acestea, efectele adverse asupra SNC reprezintă o preocupare, în special în cazul ketaminei. Memantina, amantadina și dextrometorfanul sunt antagoniști NMDA mai slabi, cu un profil de toxicitate mai sigur, dar nu au demonstrat un beneficiu consistent în aceste contexte de durere.12 Sunt necesare mai multe studii privind antagoniștii NMDA pentru a determina cea mai bună utilizare a acestora în managementul durerii, precum și pentru a gestiona eficient efectele secundare ale acestora.
1. Weiner K. Probleme legate de durere. Durerea este o epidemie. Academia Americană de Management al Durerii. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Accesat la 4 octombrie 2010.
2. Turk DC. Durerea doare – indivizii, persoanele semnificative și societatea! Buletin APS. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Accesat la 4 octombrie 2010.
3. Chronic pain in America: roadblocks to relief. Societatea Americană a Durerii. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Accesat la 7 ianuarie 2011.
4. Orientări privind îngrijirea sănătății: Assessment and Management of Acute Pain. Institutul pentru îmbunătățirea sistemelor clinice. Ediția a 6-a. Martie 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Accesat la
8 aprilie 2011.
5. Lussier D, Huskey AG, Portenoy RK. Analgezicele adjuvante în managementul durerii oncologice. Oncologist.
6. McCormick WC, Schreiner RL. Diagnosticul și tratamentul durerii rezistente la opiacee în SIDA avansat. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. Antagoniștii NMDA și durerea neuropată – ținte multiple de medicamente și utilizări multiple. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadone in the treatment of neuropathic pain. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Actualizare privind neurofiziologia transmiterii și modulării durerii: accent pe receptorul NMDA. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Mecanismele toleranței și hiperalgeziei induse de opioide. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. Utilizarea antagoniștilor receptorilor NMDA în tratamentul durerii cronice. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Accesat la 8 aprilie 2011.
12. Lexicomp Online. www.lexi.com. Accesat la 12 aprilie 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Accesat la 8 aprilie 2011.
14. Bhavani-Shankar K, Jasmeet SO. Managementul durerii postoperatorii. UptoDate. 28 mai 2010. www.uptodate.com. Accesat la 4 octombrie 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgesic effect of intravenous ketamine in cancer patients on morphine therapy: a randomized, controlled, double-blind, crossover, double-dose study. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. Ketamina „în rafală” pentru durerea refractară a cancerului: un audit deschis de 39 de pacienți. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Tratamentul cu metadonă pentru stările de durere. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Trecerea de la morfină pentru a îmbunătăți analgezia și tolerabilitatea la pacienții cu cancer: un studiu prospectiv. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Bridson J, Nash TP, et al. Metadona în doze mici are un efect analgezic în durerea neuropată: un studiu dublu-orb, randomizat, controlat și încrucișat. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Managementul durerii cauzate de cancer: analgezicele adjuvante. UptoDate. 28 mai 2010. www.uptodate.com. Accesat la 4 octombrie 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantina (un antagonist al receptorului N-metil-d-aspartat) în tratamentul durerii neuropatice după amputație sau intervenție chirurgicală: un studiu randomizat, dublu-orb, încrucișat. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. Un studiu controlat cu placebo al memantinei pentru tratamentul neuropatiei senzoriale asociate cu virusul imunodeficienței umane. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. Antagonistul receptorului NMDA amantadina reduce durerea neuropată chirurgicală la pacienții cu cancer: un studiu dublu orb, randomizat, controlat cu placebo. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Aplicarea clinică a amantadinei, un antagonist NMDA, pentru durerea neuropatică. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Efectul analgezic al durerii neuropatice cu dextrometh-orfanină. Acta Anaesthesiol Scand. 2004;48:328-336.