US Pharm. 2011;36(5):HS4-HS8.
Nu lijden naar schatting 50 miljoen Amerikanen aan chronische pijn, en nog eens 25 miljoen Amerikanen aan acute pijn.1 Elk jaar komt bijna de helft van alle Amerikanen bij de huisarts met de hoofdklacht pijn.2 De belangrijkste behandeling van matige tot ernstige pijn bestaat uit opioïde analgetica, zo nodig aangevuld met andere analgetica zoals niet-steroïde anti-inflammatoire geneesmiddelen (NSAID’s) en andere ondersteunende therapieën, waaronder tricyclische antidepressiva (TCA’s), anticonvulsiva en plaatselijke verdovingsmiddelen.3,4 Meer dan vier op de tien mensen met matige tot ernstige pijn krijgen echter geen verlichting, volgens een onderzoek van de American Pain Society (APS) uit 1999.5 Van degenen die geen verlichting van de pijn krijgen, kunnen sommigen pijn ervaren die niet reageert op opioïden of andere geneesmiddelentherapieën ondanks passend gebruik van deze middelen, zoals bij opioïdresistentie en neuropathische pijn.
Opioïdresistentie en neuropathische pijn
Opioïdresistentie wordt gedefinieerd als ongevoeligheid voor IV morfinesulfaat van ten minste 100 mg per uur (of een gelijkwaardige dosering van een ander opioïd), consistent hoge pijnwaarderingen, en niet-verlichte pijn, zelfs nadat de opioïdendosis is verdubbeld. Resistentie tegen opioïden is vastgesteld bij een groot aantal ziektebeelden, waaronder kanker, chronische pijn, neuropathie, complex regionaal pijnsyndroom, postherpetische neuralgie en pancreatitis.6 Neuropathische pijn is het gevolg van letsel aan perifere of centrale zenuwen en wordt meestal behandeld met middelen als TCA’s en anti-epileptica. Helaas ondervindt een meerderheid van de patiënten geen significante verlichting met deze middelen.7,8 Bij zowel opioïdresistentie als neuropathische pijn kunnen N-methyl-d-aspartaat (NMDA) antagonisten een optie zijn.
NMDA-receptorantagonisten
NMDA is een receptor voor de excitatoire neurotransmitter glutamaat, die vrijkomt bij schadelijke perifere prikkels.7,9 De activatie van NMDA-receptoren is in verband gebracht met hyperalgesie, neuropathische pijn, en verminderde functionaliteit van opioïde receptoren. Hyperalgesie en neuropathische pijn zijn het gevolg van een verhoogde sensitisatie van spinale neuronen, wat leidt tot een verhoogd pijnniveau.7,9,10 De verminderde functie van opioïde receptoren wordt veroorzaakt door een afname van de gevoeligheid van de opioïde receptor. Deze verminderde gevoeligheid vertaalt zich weer in opioïd tolerantie, omdat patiënten hogere doses opioïden nodig hebben om dezelfde therapeutische effecten te bereiken.9 Daarom kunnen NMDA antagonisten een rol spelen in deze gebieden van pijnbestrijding.10
Er zijn verschillende NMDA receptor antagonisten beschikbaar: ketamine, methadon, memantine, amantadine, en dextromethorphan (TABEL 1).11,12 Ze verschillen elk in hun niveau van activiteit op de NMDA receptor. Ketamine is een sterke NMDA-antagonist, terwijl de anderen zwakkere NMDA-receptorblokkers zijn.13 De ernst en frequentie van bijwerkingen hangen af van de affiniteit voor de NMDA-receptor. Bij volwassenen zijn de bijwerkingen van NMDA-antagonisten voornamelijk bijwerkingen van het centrale zenuwstelsel (CZS), waaronder hallucinaties, licht in het hoofd, duizeligheid, vermoeidheid, hoofdpijn, buitenlichamelijke gewaarwordingen, nachtmerries, en zintuiglijke veranderingen. Aangezien ketamine een sterke NMDA-antagonist is, is het minder goed verdraagbaar dan de andere antagonisten door een hogere incidentie van bijwerkingen, met name hallucinaties en een dissociatieve mentale toestand.7
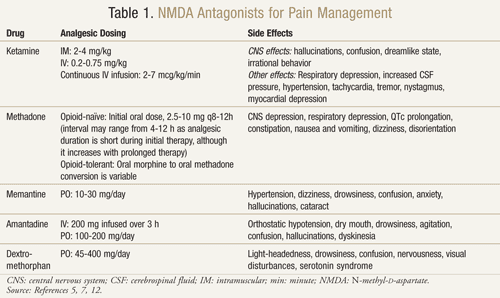
Ketamine: Ketamine is in meerdere pijnsituaties heilzaam gebleken. In een klinisch onderzoek leidde de toevoeging van een lage dosis IV-ketamine aan opioïden versus opioïden alleen postoperatief na een grote buikoperatie tot een betere analgesie, minder sedatie en een verminderde behoefte aan morfine of interventie van de arts om de pijn te beheersen.14 Een gerandomiseerde, dubbelblinde, cross-over, placebogecontroleerde studie werd ook uitgevoerd om eerdere resultaten te bevestigen die suggereerden dat ketamine effectief was bij kankerpatiënten die resistent waren tegen morfine.15 Elk van de 10 ingeschreven patiënten kreeg ketamine in een dosis van 0,25 mg/kg, 0,50 mg/kg, en placebo op 3 afzonderlijke dagen, ten minste 2 dagen na elkaar, naast hun morfine. De resultaten toonden aan dat ketamine de pijn bij beide doses significant verminderde in vergelijking met placebo. Patiënten die 0,5 mg/kg kregen hadden een beter analgetisch effect dan patiënten die 0,25 mg/kg kregen (P <.05). Significante bijwerkingen traden op bij vier patiënten die hallucinaties ervoeren en twee patiënten die een onaangenaam gevoel ervoeren dat zij “leeg hoofd” noemden. Patiënten kregen diazepam 1 mg voor een succesvolle omkering van deze CNS bijwerkingen. Patiënten ervoeren aanzienlijke slaperigheid bij beide doses ketamine, hoewel deze het meest uitgesproken was bij de dosis van 0,5 mg/kg (P <.05).15
In een prospectieve, multicenter, niet-geblindeerde, open-label trial met 39 patiënten, werd aangetoond dat “burst” ketamine-infusie een significant effect had op kankergerelateerde pijn bij patiënten die ofwel opioïd-resistent waren, zelfs met toevoeging van adjuvante analgetica, of intolerant waren voor de bijwerkingen van opioïden.16 Burst ketamine werd gedefinieerd als een kortdurende (3-5 dagen) subcutane infusie, beginnend met een initiële dosis van 100 mg/24 u, vervolgens stapsgewijs oplopend naar 300 mg/24 u en 500 mg/24 u als de pijn van de patiënt persistent was zonder onverdraaglijke bijwerkingen. De verlichting van de pijn werd geanalyseerd per type pijn (somatisch, visceraal, of neuropathisch). Bij patiënten met meer dan één type pijn werden alle pijnen afzonderlijk geanalyseerd. Van de 43 pijnen die bij 39 patiënten werden behandeld, vertoonden er 29 (67%) een afname van ten minste 50% op de verbale beoordelingsschaal (0 = geen pijn, 10 = ergst mogelijke pijn), ondersteund door een significante vermindering van het opioïdgebruik over 24 uur en/of een verbeterde mobiliteit of functionele status. Twaalf patiënten meldden bijwerkingen van het CZS, waaronder het gevoel van “spaced out”, hallucinaties, sufheid en duizeligheid.16
Methadon: Methadon is een andere NMDA-antagonist die is onderzocht bij opioïdresistentie en neuropathische pijn. Het is aangetoond dat het een goede optie is om te gebruiken als vervangend opioïd bij patiënten die slecht onder controle zijn of dosisbeperkende bijwerkingen ervaren terwijl ze andere opioïden gebruiken.17 Bij 80% van de kankerpatiënten met ongecontroleerde pijn of significante bijwerkingen is een vermindering van pijn en bijwerkingen aangetoond na een switch van morfine naar methadon.18
Methadon heeft ook effectiviteit aangetoond bij patiënten met refractaire neuropathische pijn. In een dubbelblind, gerandomiseerd, gecontroleerd, cross-over onderzoek uitgevoerd bij 18 patiënten die niet reageerden op traditionele analgetische regimes voor hun chronische neuropathische pijn, toonde 10 mg tweemaal daags oraal methadon statistisch significante pijnverlichting in maximale pijnintensiteit (P = .013), gemiddelde pijnintensiteit (P = .020), en verlichting van de pijn (P = .015) in vergelijking met placebo.19 Methadon van 5 mg tweemaal daags toonde ook analgetische verbetering in maximale pijnintensiteit en pijnverlichting; het bereikte echter geen statistische significantie. Zes patiënten trokken zich terug uit het onderzoek vanwege bijwerkingen, waaronder misselijkheid, braken, duizeligheid, zweten, en desoriëntatie met ernstige hoofdpijn. Anderen die de studie afmaakten, meldden slechts milde tot matige bijwerkingen te hebben.19
Gagnon e.a. voerden een proef uit met methadon bij de behandeling van neuropathische pijn bij 18 patiënten die ofwel geen opioïden kregen voor hun pijn of een dagelijkse dosis opioïden kregen die niet hoger was dan een equivalent van 120 mg oraal morfine vanwege bijwerkingen die verdere dosisescalatie verhinderden.8 Methadondoses werden gestart tussen 2 mg en 5 mg driemaal daags, afhankelijk van de leeftijd en getitreerd tot een stabiele dosis op basis van klinische respons en bijwerkingen. Methadon 2 mg elke 4 tot 6 uur was toegestaan voor doorbraakpijn indien nodig. De patiënten werden gedurende een mediaan van 106 dagen (16 tot 466 dagen) gevolgd. Alle patiënten ervoeren een verbetering in hun visuele analoge schaal (VAS; 0-10 cm, waarbij 0 = geen pijn en 10 = ergst mogelijke pijn) pijnscores met methadonbehandeling. De gemiddelde VAS ± standaarddeviatie (SD) vóór de behandeling was 7,7 ± 1,5 cm en daalde tot 1,4 ± 1,7 cm bij gebruik van methadon (P <.0001). Negen van de 18 (50%) hadden helemaal geen pijn terwijl ze op een stabiele dosis methadon waren. Van de 13 patiënten die allodynie hadden als onderdeel van hun neuropathische pijn, vertoonden 9 (70%) volledige resolutie (geen klinisch detecteerbare allodynie) en 4 (30%) hadden gedeeltelijke resolutie (allodynie in <50% van het oppervlak). Van de 8 patiënten met pijnscheuten meldden alle 8 (100%) symptoomcontrole bij een stabiele dosis methadon. Bijwerkingen waren lichte slaperigheid en misselijkheid die van voorbijgaande aard was, samen met constipatie die werd opgelost met laxeermiddelen.8
Helaas is methadon vaak moeilijk te gebruiken vanwege de lange en variabele halfwaardetijd van ongeveer 8 tot 59 uur, de vereiste ECG-controle voor mogelijke QTc-verlenging en de vele interacties met andere QTc-verlengende middelen, evenals CYP3A4- en CYP2D6-remmers.12 Bovendien is opioïdenconversie moeilijk omdat methadon in potentie toeneemt met toenemende doses morfine. Daarom kan geen eenduidige verhouding voor equianalgetische dosering worden gevonden tussen morfine en methadon.17
Memantine: Andere NMDA-receptorantagonisten zoals memantine, amantadine en dextromethorfan hebben gemengde resultaten laten zien bij neuropathische pijn.20 Memantine heeft een veilig bijwerkingenprofiel en een snel begin van werking; in een gerandomiseerde, dubbelblinde, cross-over studie waarbij memantine werd toegediend aan een groep van 19 patiënten met chronische pijn als gevolg van zenuwletsel na een operatie, was er echter geen verschil in pijnreductie met memantine versus placebo.21 Daarnaast liet een onderzoek met memantine bij patiënten met HIV-geassocieerde sensorische neuropathie geen positieve resultaten zien.22
Amantadine: Amantadine is een ander geneesmiddel dat in klinische studies gemengde resultaten heeft laten zien. Een dubbelblind, gerandomiseerd, placebogecontroleerd onderzoek werd uitgevoerd bij 15 kankerpatiënten die chirurgische neuropathische pijn hadden.23 In een gerandomiseerde volgorde kregen de patiënten 1 week na elkaar een infuus van 200 mg amantadine of placebo. Spontane en geëvoceerde pijn werden gemeten 48 uur voor, tijdens en na de behandeling. Gemiddeld was er een pijnvermindering van 85% met amantadine tegenover 45% met placebo (P = .009) aan het einde van de infusie. Bij vergelijking van de gemiddelde pijnintensiteit 48 uur voor en na de behandeling, had amantadine een pijnvermindering van 31% (P = .006), terwijl het placebo een niet-significante pijnvermindering van 6% (P = .40) liet zien.23
In tegenstelling tot deze positieve resultaten, voerden Fukui et al een studie uit met amantadine bij 19 patiënten die niet reageerden op de conventionele behandelingen voor neuropathische pijn, waaronder anti-epileptica, antidepressiva, en zenuwblokkades.24 De patiënten werden gestart met oraal amantadine 100 mg/dag gedurende 1 week en vervolgens getitreerd tot 200 mg/dag. De resultaten toonden pijnvermindering bij slechts 2 (10,5%) van de 19 patiënten. Bijwerkingen werden ervaren bij 52,6% van de patiënten, waaronder een droge mond, slaperigheid, hallucinaties, opwinding, irritatie, duizeligheid, dyskinesie en haarverlies.24
Dextromethorfan: Veel voorkomend in OTC hoestmedicijnen, is dextromethorfan ook beoordeeld voor het gebruik bij neuropathische pijn. In een placebogecontroleerde, dubbelblinde, gerandomiseerde cross-overstudie kregen 15 patiënten met neuropathische pijn 270 mg dextromethorfan en placebo in willekeurige volgorde, gescheiden door een uitloopperiode van 1 week.25 De resultaten toonden een vermindering van 30% van de pijn na een enkele dosis dextromethorfan vergeleken met placebo. Na 1,5 uur en 2,5 tot 4 uur vanaf het tijdstip van medicatie, was er een statistisch significant verschil in pijnvermindering van dextromethorfan versus placebo (P <.05 en P <.002, respectievelijk). Bijwerkingen waren onder meer lichthoofdigheid, slaperigheid, visuele stoornissen en opvliegers; geen van de bijwerkingen was ernstig.25
Omdat dextromethorfan via CYP2D6 wordt gemetaboliseerd tot de actieve metaboliet dextrorfan, werden ook extensieve versus slechte metabolisten vergeleken. Patiënten met een uitgebreid metabolisme van dextromethorfan ervoeren een betere analgesie dan patiënten met een slecht metabolisme. Geconcludeerd werd dat dextromethorfan potentieel heeft bij de behandeling van neuropathische pijn, maar uitgebreidere studies zijn nodig om het gebruik ervan te valideren.25
Rol van de apotheker
De apotheker kan de patiëntenzorg sterk beïnvloeden bij personen die geen adequate pijnstilling krijgen als gevolg van opioïdresistentie en neuropathische pijn die niet adequaat wordt bestreden met algemeen gebruikte middelen, door de huidige rol van NMDA-antagonisten te begrijpen. Aangezien methadon momenteel veelbelovend is gebleken op dit gebied, is het belangrijk dat apothekers begrijpen hoe ze het veilige gebruik van dit middel kunnen vergemakkelijken met betrekking tot de juiste dosering, medicijninteracties en monitoring van bijwerkingen.
Conclusie
NMDA-antagonisten zijn een geweldige mogelijkheid om te onderzoeken bij de behandeling van opioïd-resistente en neuropathische pijn. De NMDA-antagonisten die momenteel zijn getest zijn ketamine, methadon, memantine, amantadine, en dextromethorfan. De klinische proeven tot dusver hebben de waarde aangetoond van ketamine en methadon voor de vermindering van neuropathische pijn en opioïdresistente pijn. Bijwerkingen op het CZS zijn echter een punt van zorg, vooral bij ketamine. Memantine, amantadine en dextromethorfan zijn zwakkere NMDA-antagonisten met een veiliger toxiciteitsprofiel, maar hebben geen consistent voordeel aangetoond in deze pijnsettings.12 Meer studies van NMDA-antagonisten zijn nodig om hun beste gebruik bij pijnbestrijding te bepalen, evenals om hun bijwerkingen effectief te beheersen.
1. Weiner K. Pijnproblemen. Pijn is een epidemie. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Geraadpleegd op 4 oktober 2010.
2. Turk DC. Pijn doet pijn – individuen, belangrijke anderen, en de samenleving! APS Bulletin. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Accessed October 4, 2010.
3. Chronische pijn in Amerika: wegversperringen voor verlichting. American Pain Society. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Geraadpleegd op 7 januari 2011.
4. Richtlijnen voor de gezondheidszorg: Beoordeling en behandeling van acute pijn. Instituut voor Klinische Systeemverbetering. 6e ed. Maart 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Geraadpleegd
April 8, 2011.
5. Lussier D, Huskey AG, Portenoy RK. Adjuvante analgetica bij pijnbestrijding bij kanker. Oncologist.
6. McCormick WC, Schreiner RL. Diagnosis and treatment of opiate-resistant pain in advanced AIDS. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. NMDA antagonists and neuropathic pain-multiple drug targets and multiple uses. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadon bij de behandeling van neuropathische pijn. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Update over de neurofysiologie van pijntransmissie en modulatie: focus op de NMDA-receptor. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Mechanismen van opioïd-geïnduceerde tolerantie en hyperalgesie. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. Het gebruik van NMDA-receptor antagonisten bij de behandeling van chronische pijn. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Geraadpleegd op 8 april 2011.
12. Lexicomp Online. www.lexi.com. Geraadpleegd op 12 april 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Accessed April 8, 2011.
14. Bhavani-Shankar K, Jasmeet SO. Behandeling van postoperatieve pijn. UptoDate. May 28, 2010. www.uptodate.com. Geraadpleegd op 4 oktober 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgetisch effect van intraveneuze ketamine bij kankerpatiënten op morfine therapie: een gerandomiseerde, gecontroleerde, dubbelblinde, cross-over, dubbele dosis studie. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. “Burst” ketamine for refractory cancer pain: an open-label audit of 39 Patients. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Methadon behandeling voor pijntoestanden. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Switching from morphine to improve analgesia and tolerability in cancer patients: a prospective study. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Low-dose methadone has an analgesic effect in neuropathic pain: a double-blind randomized controlled cross-over trial. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Pijnbestrijding bij kanker: adjuvante analgetica. UptoDate. May 28, 2010. www.uptodate.com. Accessed October 4, 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantine (een N-methyl-d-aspartaat receptor antagonist) in de behandeling van neuropathische pijn na amputatie of chirurgie: een gerandomiseerd, dubbelblind, cross-over onderzoek. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. A placebo-controlled study of memantine for the treatment of human immunodeficiency virus-associated sensory neuropathy. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. De NMDA-receptorantagonist amantadine vermindert chirurgische neuropathische pijn bij kankerpatiënten: een dubbelblinde, gerandomiseerde, placebogecontroleerde trial. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Klinische toepassing van amantadine, een NMDA-antagonist, voor neuropathische pijn. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Analgetisch effect van dextrometh-orphanine neuropathische pijn. Acta Anaesthesiol Scand. 2004;48:328-336.