US Pharm. 2011;36(5):HS4-HS8.
Arviolta 50 miljoonaa amerikkalaista kärsii tällä hetkellä kroonisesta kivusta, ja lisäksi toiset 25 miljoonaa kärsii akuutista kivusta.1 Joka vuosi lähes puolet kaikista amerikkalaisista hakeutuu lääkärin vastaanotolle kipua koskevan päävaivan vuoksi.2 Keskivaikean tai vaikean kivun pääasiallinen hoitomuoto on opioidikipulääkitys, johon lisätään tarvittaessa muita kipulääkkeitä, kuten ei-steroidisia tulehduskipulääkkeitä (NSAID-lääkkeitä) ja muita liitännäishoitoja, kuten trisyklisiä masennuslääkkeitä (TCA-lääkkeitä), kouristuslääkkeitä ja paikallispuudutteita.3,4,4 Vuonna 1999 tehdyn American Pain Societyn (APS) tutkimuksen mukaan yli neljä kymmenestä keskivaikeaa tai vaikeaa kipua sairastavasta ei kuitenkaan saa helpotusta kipuunsa.5 Niistä, jotka eivät saa kivunlievitystä, osa saattaa kärsiä kivusta, joka ei reagoi opioideihin tai muihin lääkehoitoihin näiden aineiden asianmukaisesta käytöstä huolimatta, kuten opioidiresistenssissä ja neuropaattisessa kivussa.
Opioidiresistenssi ja neuropaattinen kipu
Opioidiresistenssi määritellään siten, että se ei reagoi infuusiona annettuun morfiinisulfaattiin, jonka annos on vähintään 100 mg tunnissa (tai vastaavaan annokseen muuta opioidia), että kipuarviot ovat jatkuvasti korkeat ja että kipu ei helpotu edes sen jälkeen, kun opioidiannos kaksinkertaistetaan. Opioidiresistenssiä on todettu monissa eri tautitiloissa, kuten syövässä, kroonisessa kivussa, neuropatiassa, kompleksisessa alueellisessa kipuoireyhtymässä, postherpeettisessä neuralgiassa ja haimatulehduksessa.6 Neuropaattinen kipu johtuu perifeeristen tai keskushermojen vammoista, ja sitä hoidetaan yleensä TCA-lääkkeiden ja kouristuslääkkeiden kaltaisilla aineilla. Valitettavasti suurin osa potilaista ei koe merkittävää helpotusta näillä aineilla.7,8 Sekä opioidiresistenssissä että neuropaattisessa kivussa N-metyyli-d-aspartaatti (NMDA) -antagonistit voivat olla vaihtoehto.
NMDA-reseptoriantagonistit
NMDA on reseptori eksitatoriselle välittäjäaineelle glutamaatille, jota vapautuu haitallisista perifeerisistä ärsykkeistä.7,9 NMDA-reseptorien aktivoituminen on yhdistetty hyperalgesiaan, neuropaattiseen kipuun ja opioidireseptorien heikentyneeseen toimintaan. Hyperalgesia ja neuropaattinen kipu ovat seurausta selkäydinneuronien lisääntyneestä herkistymisestä, mikä johtaa lisääntyneeseen kipuun.7,9,10 Opioidireseptorien heikentynyt toiminta johtuu opioidireseptorin herkkyyden vähenemisestä. Tämä vähentynyt herkkyys puolestaan johtaa opioiditoleranssiin, sillä potilaat tarvitsevat suurempia opioidiannoksia saavuttaakseen samat terapeuttiset vaikutukset.9 Siksi NMDA-antagonisteilla voi olla merkitystä näillä kivunhoidon osa-alueilla.10
Käytettävissä on useita NMDA-reseptoriantagonisteja: ketamiini, metadoni, memantiini, amantadiini ja dekstrometorfaani (TAULUKKO 1).11,12 Ne eroavat toisistaan kukin aktiivisuutensa NMDA-reseptoriin. Ketamiini on vahva NMDA-antagonisti, kun taas muut ovat heikompia NMDA-reseptorin salpaajia.13 Haittavaikutusten vakavuus ja esiintymistiheys riippuvat NMDA-reseptorin affiniteetista. Aikuisilla NMDA-antagonistien haittavaikutukset ovat pääasiassa keskushermoston (CNS) haittavaikutuksia, kuten hallusinaatioita, huimausta, pyörrytystä, väsymystä, päänsärkyä, kehon ulkopuolisia tuntemuksia, painajaisia ja sensorisia muutoksia. Koska ketamiini on voimakas NMDA-antagonisti, se on muita antagonisteja huonommin siedettävä, koska haittavaikutuksia, erityisesti hallusinaatioita ja dissosiatiivista psyykkistä tilaa, esiintyy enemmän.7
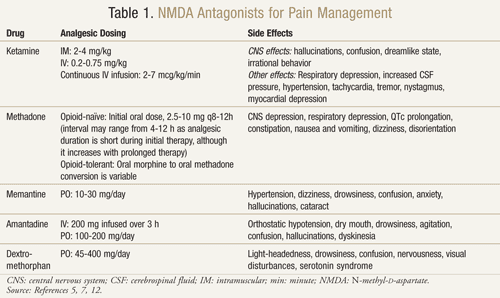
Ketamiini: Ketamiini on osoittautunut hyödylliseksi useissa kiputilanteissa. Kliinisessä tutkimuksessa pienen annoksen IV-ketamiinin lisääminen opioideihin verrattuna pelkkiin opioideihin postoperatiivisesti suuren vatsaleikkauksen jälkeen tuotti parempaa analgesiaa, vähemmän sedaatiota ja vähensi morfiinin tai lääkärin väliintulon tarvetta kivun hallitsemiseksi.14 Satunnaistettu, kaksoissokkoutettu, ristiintaulukoitu, lumekontrolloitu tutkimus suoritettiin myös vahvistamaan aiempia tuloksia, joiden mukaan ketamiini oli tehokasta syöpäpotilailla, jotka olivat resistenttejä morfiinille.15 Kukin kymmenestä tutkimukseen osallistuneesta potilaasta sai morfiinin lisäksi ketamiinia annoksina 0,25 mg/kg, 0,50 mg/kg ja lumelääkettä kolmena erillisenä päivänä vähintään kahden päivän välein. Tulokset osoittivat, että ketamiini vähensi kipua merkittävästi molemmilla annoksilla lumelääkkeeseen verrattuna. Potilailla, jotka saivat 0,5 mg/kg, oli parempi analgeettinen vaikutus kuin potilailla, jotka saivat 0,25 mg/kg (P <.05). Merkittäviä haittavaikutuksia ilmeni neljällä potilaalla, jotka kokivat hallusinaatioita, ja kahdella potilaalla, jotka kokivat epämiellyttävän tunteen, johon he viittasivat ”tyhjä pää”. Potilaat saivat 1 mg diatsepaamia näiden keskushermostoon kohdistuvien haittavaikutusten kumoamiseksi onnistuneesti. Potilaat kokivat merkittävää uneliaisuutta molemmilla ketamiiniannoksilla, joskin se oli voimakkainta 0,5 mg/kg annoksella (P <.05).15
Prospektiivisessa, monikeskuksisessa, sokkouttamattomassa, avoimessa tutkimuksessa, johon osallistui 39 potilasta, ”burst”-ketamiini-infuusiolla osoitettiin olevan merkittävä vaikutus syöpään liittyvään kipuun potilailla, jotka olivat joko opioidiresistenttejä, vaikka niihin lisättäisiinkin adjuvanttianalgeetteja, tai jotka olivat vaikeasti sietokyvyttömiä opioidien haitalliselle käytölle. 16 Burst-ketamiini määriteltiin lyhytkestoiseksi (3-5 vuorokautta) ihonalaiseksi infuusioksi, joka aloitettiin aloitusannoksella 100 mg/24 h ja jota nostettiin asteittain annoksiin 300 mg/24 h ja 500 mg/24 h, jos potilaan kipu oli jatkuvaa ilman sietämättömiä sivuvaikutuksia. Kivunlievitystä analysoitiin kivun tyypin mukaan (somaattinen, viskeraalinen tai neuropaattinen). Niillä potilailla, joilla oli useampi kuin yksi kiputyyppi, jokainen kipu analysoitiin erikseen. 39 potilaan 43:sta hoidetusta kivusta 29:llä (67 %) kipu väheni vähintään 50 % verbaalisella arviointiasteikolla (0 = ei kipua, 10 = pahin mahdollinen kipu), minkä tueksi opioidien käyttö väheni merkittävästi 24 tunnin aikana ja/tai liikkumiskyky tai toimintakyky parani. Kaksitoista potilasta ilmoitti keskushermostoon kohdistuneista haittavaikutuksista, kuten ”hajamielisyyden” tunteesta, hallusinaatioista, uneliaisuudesta ja huimauksesta.16
Methadone: Metadoni on toinen NMDA-antagonisti, jota on tutkittu opioidiresistenssin ja neuropaattisen kivun hoidossa. Sen on osoitettu olevan hyvä vaihtoehto käyttää korvaavana opioidina potilailla, jotka ovat huonosti kontrolloituja tai joilla esiintyy annosta rajoittavia haittavaikutuksia muita opioideja käytettäessä.17 80 %:lla syöpäpotilaista, joiden kipu on hallitsematon tai joilla on merkittäviä haittavaikutuksia, metadoni on osoittanut kivun ja haittavaikutusten vähenevän sen jälkeen, kun heidät on vaihdettu morfiinista metadoniin.18
Metadoni on osoittanut tehoavansa myös potilailla, joilla on refraktorista neuropaattista kipua. Kaksoissokkoutetussa, satunnaistetussa, kontrolloidussa, ristikkäistutkimuksessa, joka tehtiin 18 potilaalla, jotka eivät vastanneet perinteisiin analgeettisiin hoitomuotoihin kroonisen neuropaattisen kivun hoidossa, 10 mg kahdesti vuorokaudessa suun kautta otettavaa metadonia osoitti tilastollisesti merkitsevää kivunlievitystä maksimaalisessa kivun intensiteetissä (P = 0,013), keskimääräisessä kivun intensiteetissä (P = 0,020) ja kivunlievityksessä (P = 0,015) lumelääkkeeseen verrattuna.19 Metadoni annoksella, jonka annos oli 5 mg kahdesti vuorokaudessa osoitti kipua lievittävää vaikutusta maksimaalisessa kivun intensiteetissä ja kivunlievityksen lievityksessä; tilastollista merkitsevyyttäkään ei kuitenkaan ollut. Kuusi potilasta vetäytyi tutkimuksesta haittavaikutusten, kuten pahoinvoinnin, oksentelun, huimauksen, hikoilun ja voimakkaan päänsäryn aiheuttaman sekavuuden vuoksi. Muut, jotka suorittivat tutkimuksen loppuun, ilmoittivat vain lievistä tai kohtalaisista haittavaikutuksista.19
Gagnon ym. tekivät metadonitutkimuksen neuropaattisen kivun hoidossa 18 potilaalla, jotka joko eivät saaneet opioideja kipuunsa tai saivat päivittäisen opioidiannoksen, joka ei ollut suurempi kuin 120 mg:aa suun kautta annosteltua morfiinia vastaava annos, koska haittavaikutukset estivät annoksen suurentamisen jatkamisen.8 Metadoniannokset aloitettiin iästä riippuen 2-5 mg:n välillä kolme kertaa päivässä, ja ne titrattiin vakaaseen annokseen kliinisen vasteen ja haittavaikutusten perusteella. Metadonia annettiin 2 mg 4-6 tunnin välein läpilyöntikivun hoitoon tarpeen mukaan. Potilaita seurattiin keskimäärin 106 päivän ajan (16-466 päivää). Kaikkien potilaiden kipupisteet paranivat visuaalisella analogisella asteikolla (VAS; 0-10 cm, jossa 0 = ei kipua ja 10 = pahin mahdollinen kipu) metadonihoidon myötä. Keskimääräinen VAS ± keskihajonta (SD) ennen hoitoa oli 7,7 ± 1,5 cm, ja se laski 1,4 ± 1,7 cm:iin metadonia käytettäessä (P <.0001). Yhdeksällä 18:sta (50 %) ei ollut lainkaan kipua, kun he saivat vakaata metadoniannosta. Niistä 13 potilaasta, joilla allodynia oli osa neuropaattista kipua, 9:llä (70 %) allodynia hävisi kokonaan (ei kliinisesti havaittavaa allodyniaa) ja 4:llä (30 %) allodynia hävisi osittain (allodynia <50 %:lla pinta-alasta). Niistä kahdeksasta potilaasta, joilla oli ampumakipua, kaikki kahdeksan (100 %) ilmoittivat oireiden olevan hallinnassa vakaalla metadoniannoksella. Haittavaikutuksiin kuuluivat lievä uneliaisuus ja pahoinvointi, jotka olivat ohimeneviä, sekä ummetus, joka korjaantui laksatiiveilla. 8
Metadonin käyttö on valitettavasti usein haastavaa, kun otetaan huomioon sen pitkä ja vaihteleva puoliintumisaika, joka on noin 8-59 tuntia, tarvittava EKG-seuranta mahdollisen QTc-ajan pidentymisen varalta ja monet lääkeaineinteraktiot muiden QTc-aikaa pidentävien lääkeaineiden sekä CYP3A4:n ja CYP2D6:n estäjien kanssa.12 Lisäksi opioidien konversio on hankalaa, sillä metadonin teho lisääntyy lisääntyvien morfiiniannosten myötä. Siksi morfiinin ja metadonin välille ei voida löytää yhtä ainoaa suhdetta ekvianalgeettista annostelua varten.17
Memantiini: Muilla NMDA-reseptoriantagonisteilla, kuten memantiinilla, amantadiinilla ja dekstrometorfaanilla, on saatu vaihtelevia tuloksia neuropaattisen kivun hoidossa.20 Memantiinilla on turvallinen sivuvaikutusprofiili ja nopea vaikutus alkaa; satunnaistetussa, kaksoissokkoutetussa ristikkäistutkimuksessa, jossa memantiinia annettiin 19 potilaan ryhmälle, jolla oli kroonista kipua leikkauksen jälkeisen hermovaurion aiheuttaman hermovaurion vuoksi, ei kuitenkaan havaittu eroa kivun lievittymisessä memantiinin ja lumelääkkeen välillä.21 Lisäksi tutkimus, jossa memantiinia käytettiin potilailla, joilla oli HIV:n aiheuttama sensorinen neuropatia, ei osoittanut myönteisiä tuloksia.22
Amantadiini: Amantadiini on toinen lääke, joka on osoittanut vaihtelevia tuloksia kliinisissä tutkimuksissa. Kaksoissokkoutettu, satunnaistettu, lumekontrolloitu tutkimus tehtiin 15 syöpäpotilaalla, joilla oli kirurgista neuropaattista kipua.23 Satunnaistetussa järjestyksessä potilaat saivat 200 mg:n infuusion amantadiinia tai lumelääkettä viikon välein. Spontaani ja herätetty kipu mitattiin 48 tuntia ennen hoitoa, hoidon aikana ja sen jälkeen. Keskimäärin kipu väheni 85 % amantadiinilla ja 45 % lumelääkkeellä (P = .009) infuusion lopussa. Kun verrattiin kivun keskimääräistä voimakkuutta 48 tuntia ennen hoitoa ja hoidon jälkeen, amantadiini vähensi kipua 31 % (P = .006), kun taas lumelääkkeellä kipu väheni merkityksettömästi 6 % (P = .40).23
Kontrastina näille myönteisille tuloksille Fukui ym. tekivät amantadiinitutkimuksen 19 potilaalla, jotka eivät vastanneet neuropaattisen kivun tavanomaisiin hoitomuotoihin, mukaan lukien kouristelu- ja masennuslääkkeet sekä hermosalpaajat.24 Potilaille aloitettiin suun kautta otettavan amantadiinin käyttö 100 mg/vrk yhden viikon ajan ja titraus 200 mg:aan/vrk. Tulokset osoittivat kivun vähenemistä vain kahdella (10,5 %) 19 potilaasta. Haittavaikutuksia ilmeni 52,6 %:lla potilaista, mukaan lukien suun kuivuminen, uneliaisuus, hallusinaatiot, kiihtymys, ärtyneisyys, huimaus, dyskinesia ja hiustenlähtö.24
Deksstrometorfaani: Yleisesti reseptivapaasti myytävissä yskänlääkkeissä esiintyvää dekstrometorfaania on tarkasteltu myös sen käytöstä neuropaattisessa kivussa. Plasebokontrolloidussa, kaksoissokkoutetussa, satunnaistetussa ristikkäistutkimuksessa 15 neuropaattisesta kivusta kärsivää potilasta sai 270 mg dekstrometorfaania ja lumelääkettä satunnaisessa järjestyksessä, joiden välissä oli yhden viikon huuhtelujakso.25 Tulokset osoittivat kivun vähenevän 30 % yhden dekstrometorfaaniannoksen jälkeen lumelääkkeeseen verrattuna. 1,5 tunnin kuluttua ja 2,5-4 tunnin kuluttua lääkityksen antohetkestä oli tilastollisesti merkitsevä ero dekstrometorfaanin ja lumelääkkeen kivun vähenemisessä (P <.05 ja P <.002, vastaavasti). Haittavaikutuksia olivat huimaus, uneliaisuus, näköhäiriöt ja kuumat aallot; yksikään niistä ei ollut vakava.25
Koska dekstrometorfaani metaboloituu CYP2D6:n kautta aktiiviseksi metaboliitiksi dekstrometorfaaniksi, verrattiin myös laajoja ja huonoja metaboloijia. Potilaat, jotka olivat dekstrometorfaanin laajoja metaboloijia, kokivat paremman analgesian kuin huonot metaboloijat. Johtopäätöksenä todettiin, että dekstrometorfaanilla on potentiaalia neuropaattisen kivun hoidossa, mutta sen käytön validoimiseksi tarvitaan laajempia tutkimuksia.25
Apteekkarin rooli
Apteekkarit voivat vaikuttaa suuresti potilaiden hoitoon niiden henkilöiden kohdalla, jotka eivät saa riittävää kivunlievitystä opioidiresistenssin ja yleisesti käytetyillä lääkeaineilla riittämättömän hallitsemattomaksi jäävän neuropaattisen kivun vuoksi, ymmärtämällä NMDA-antagonistien nykyistä merkitystä. Koska metadoni on tällä hetkellä osoittautunut erittäin lupaavaksi tällä alalla, on tärkeää, että farmaseutit ymmärtävät, miten tämän aineen turvallista käyttöä voidaan helpottaa oikean annostelun, lääkkeiden yhteisvaikutusten ja haittavaikutusten seurannan osalta.
Johtopäätös
NMDA-antagonistit ovat loistava tutkimuskohde opioidiresistentin ja neuropaattisen kivun hoidossa. NMDA-antagonisteja, joita on tällä hetkellä testattu, ovat ketamiini, metadoni, memantiini, amantadiini ja dekstrometorfaani. Tähänastiset kliiniset tutkimukset ovat osoittaneet ketamiinin ja metadonin arvon neuropaattisen kivun ja opioidiresistentin kivun vähentämisessä. Keskushermostoon kohdistuvat haittavaikutukset ovat kuitenkin huolenaiheena erityisesti ketamiinin kohdalla. Memantiini, amantadiini ja dekstrometorfaani ovat heikompia NMDA-antagonisteja, joilla on turvallisempi toksisuusprofiili, mutta ne eivät ole osoittaneet johdonmukaista hyötyä näissä kiputiloissa.12 NMDA-antagonisteista tarvitaan lisää tutkimuksia, jotta voidaan määrittää niiden paras käyttö kivunhoidossa sekä hallita tehokkaasti niiden sivuvaikutuksia.
1. Weiner K. Kipuasiat. Kipu on epidemia. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Viitattu 4. lokakuuta 2010.
2. Turk DC. Kipu satuttaa – yksilöitä, läheisiä ja yhteiskuntaa! APS Bulletin. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Accessed October 4, 2010.
3. Chronic pain in America: roadblocks to relief. American Pain Society. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Accessed January 7, 2011.
4. Health Care Guidelines: Akuutin kivun arviointi ja hoito. Institute For Clinical Systems Improvement. 6. painos. March 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Luettu
8. huhtikuuta 2011.
5. Lussier D, Huskey AG, Portenoy RK. Adjuvanttiset kipulääkkeet syövän kivunhoidossa. Onkologi.
6. McCormick WC, Schreiner RL. Opiaattiresistentin kivun diagnostiikka ja hoito pitkälle edenneessä AIDSissa. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. NMDA-antagonistit ja neuropaattinen kipu – useita lääkekohteita ja useita käyttötarkoituksia. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadone in the treatment of neuropathic pain. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Päivitys kivun välittämisen ja modulaation neurofysiologiasta: keskitytään NMDA-reseptoriin. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Opioidien aiheuttaman toleranssin ja hyperalgesian mekanismit. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. NMDA-reseptoriantagonistien käyttö kroonisen kivun hoidossa. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Viitattu 8. huhtikuuta 2011.
12. Lexicomp Online. www.lexi.com. Käytetty 12. huhtikuuta 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Viitattu 8. huhtikuuta 2011.
14. Bhavani-Shankar K, Jasmeet SO. Postoperatiivisen kivun hoito. UptoDate. May 28, 2010. www.uptodate.com. Viitattu 4. lokakuuta 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Laskimonsisäisen ketamiinin analgeettinen vaikutus syöpäpotilailla, jotka saavat morfiinihoitoa: satunnaistettu, kontrolloitu, kaksoissokkoutettu, ristiintaulukoitu, kaksoisannostelututkimus. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. ”Burst” ketamine for refractory cancer pain: an open-label audit of 39 Patients. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Metadonihoito kiputiloissa. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Siirtyminen morfiinista analgesian ja siedettävyyden parantamiseksi syöpäpotilailla: prospektiivinen tutkimus. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Low-dose methadone has an analgesic effect in neuropathic pain: double-blind randomized controlled crossover trial. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Syövän kivunhoito: liitännäiskipulääkkeet. UptoDate. May 28, 2010. www.uptodate.com. Viitattu 4. lokakuuta 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantiinin (N-metyyli-d-aspartaattireseptorin antagonisti) käyttö amputoinnin tai leikkauksen jälkeisen neuropaattisen kivun hoidossa: satunnaistettu, kaksoissokkoutettu, ristikkäistutkimus. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. A placebo-controlled study of memantine for the treatment of human immunodeficiency virus-associated sensory neuropathy. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. NMDA-reseptoriantagonisti amantadiini vähentää kirurgista neuropaattista kipua syöpäpotilailla: kaksoissokkoutettu, satunnaistettu, plasebokontrolloitu tutkimus. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. NMDA-antagonisti amantadiinin kliininen käyttö neuropaattiseen kipuun. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Dekstromet-orfaniinin analgeettinen vaikutus neuropaattiseen kipuun. Acta Anaesthesiol Scand. 2004;48:328-336.