US Pharm. 2011;36(5):HS4-HS8.
A becslések szerint jelenleg 50 millió amerikai szenved krónikus fájdalomtól, valamint további 25 millióan akut fájdalomtól.1 Évente az amerikaiak közel fele fordul orvosához fájdalomra utaló fő panasszal.2 A közepesen súlyos és súlyos fájdalom kezelésének fő pillére az opioid analgetikumok, amelyekhez szükség esetén más fájdalomcsillapítók, például nem szteroid gyulladáscsökkentők (NSAID) és egyéb kiegészítő terápiák, köztük triciklikus antidepresszánsok (TCA), görcsoldók és helyi érzéstelenítők adhatók.3,4 Az Amerikai Fájdalom Társaság (APS) 1999-ben végzett felmérése szerint azonban 10-ből több mint négy közepes vagy súlyos fájdalomban szenvedő ember nem kap enyhülést.5 Azok közül, akik nem kapnak fájdalomcsillapítást, néhányan olyan fájdalmat tapasztalhatnak, amely az opioidok vagy más gyógyszeres terápiák megfelelő alkalmazása ellenére sem reagál az opioidrezisztencia és a neuropátiás fájdalom esetén.
Opioidrezisztencia és neuropátiás fájdalom
Az opioidrezisztenciát úgy határozzák meg, mint az óránként legalább 100 mg intravénás morfium-szulfátra (vagy más opioid egyenértékű adagjára) való nem reagálást, a tartósan magas fájdalomértékelést és az opioiddózis megduplázása után sem enyhülő fájdalmat. Opioidrezisztenciát számos betegségben találtak, többek között rákban, krónikus fájdalomban, neuropátiában, komplex regionális fájdalom szindrómában, posztherpeszes neuralgiában és pancreatitisben.6 A neuropátiás fájdalom a perifériás vagy központi idegek sérüléséből ered, és általában olyan szerekkel kezelik, mint a TCA-k és antikonvulzívumok. Sajnos a betegek többsége nem tapasztal jelentős enyhülést ezekkel a szerekkel.7,8 Mind az opioidrezisztencia, mind a neuropátiás fájdalom esetében az N-metil-d-aszpartát (NMDA) antagonisták jelenthetnek lehetőséget.
NMDA-receptor-antagonisták
Az NMDA a gerjesztő glutamát neurotranszmitter receptora, amely káros perifériás ingerek hatására szabadul fel.7,9 Az NMDA-receptorok aktiválódását hiperalgéziával, neuropátiás fájdalommal és az opioidreceptorok csökkent működésével hozták összefüggésbe. A hiperalgézia és a neuropátiás fájdalom a gerincvelői neuronok fokozott szenzitizációjának eredménye, ami a fájdalom fokozott szintjéhez vezet.7,9,10 Az opioidreceptorok csökkent funkcióját az opioidreceptor érzékenységének csökkenése okozza. Ez a csökkent érzékenység viszont opioid-toleranciához vezet, mivel a betegeknek nagyobb dózisú opioidokra van szükségük ugyanazon terápiás hatás eléréséhez.9 Ezért az NMDA-antagonistáknak szerepe lehet a fájdalomkezelés ezen területein.10
Az NMDA-receptor antagonisták közül többféle áll rendelkezésre: ketamin, metadon, memantin, amantadin és dextrometorfán (1. TÁBLÁZAT).11,12 Ezek mindegyike különbözik az NMDA-receptoron kifejtett aktivitásuk mértékében. A ketamin erős NMDA-antagonista, míg a többiek gyengébb NMDA-receptor-blokkolók.13 A mellékhatások súlyossága és gyakorisága az NMDA-receptor iránti affinitástól függ. Felnőtteknél az NMDA-antagonisták mellékhatásai főként központi idegrendszeri (CNS) mellékhatások, beleértve a hallucinációkat, szédülést, szédülést, fáradtságot, fejfájást, testen kívüli érzést, rémálmokat és érzékszervi változásokat. Mivel a ketamin erős NMDA-antagonista, a mellékhatások, különösen a hallucinációk és a disszociatív mentális állapot nagyobb előfordulása miatt kevésbé tolerálható, mint a többi antagonista.7
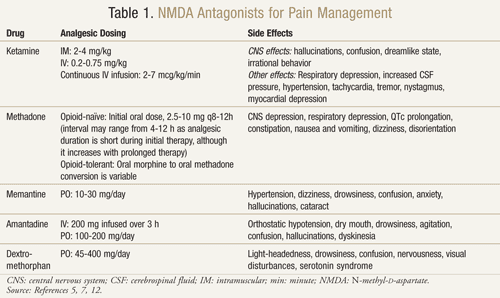
Ketamin: A ketamin több fájdalomhelyzetben is előnyösnek bizonyult. Egy klinikai vizsgálatban az alacsony dózisú intravénás ketamin hozzáadása az opioidokhoz, szemben az opioidokkal önmagukban, nagyobb hasi műtétet követően posztoperatívan jobb fájdalomcsillapítást, kevesebb szedációt eredményezett, és csökkent a morfium vagy az orvosi beavatkozás szükségessége a fájdalom kezelése érdekében14. Egy randomizált, kettős vak, keresztirányú, placebo-kontrollált vizsgálatot is végeztek, hogy megerősítsék azokat a korábbi eredményeket, amelyek szerint a ketamin hatékony a morfiummal szemben rezisztens rákos betegeknél.15 A 10 bevont beteg mindegyike 0,25 mg/kg, 0,50 mg/kg és placebo dózisban kapott ketamint 3 különböző napon, legalább 2 nap különbséggel, a morfium mellett. Az eredmények azt mutatták, hogy a ketamin mindkét dózisban jelentősen csökkentette a fájdalmat a placebóhoz képest. A 0,5 mg/kg-ot kapó betegek fájdalomcsillapító hatása jobb volt, mint a 0,25 mg/kg-ot kapó betegeké (P <,05). Jelentős mellékhatások négy betegnél jelentkeztek, akik hallucinációkat tapasztaltak, és két betegnél, akik kellemetlen érzést tapasztaltak, amelyre “üres fejként” hivatkoztak. A betegek 1 mg diazepámot kaptak, ami sikeresen megfordította ezeket a központi idegrendszeri mellékhatásokat. A betegek jelentős álmosságot tapasztaltak a ketamin mindkét dózisánál, bár ez a 0,5 mg/kg-os dózisnál volt a legkifejezettebb (P <.05).15
Egy prospektív, multicentrikus, nem vak, nyílt, 39 beteggel végzett vizsgálatban a “burst” ketamin infúzió jelentős hatást mutatott a rákbetegséggel kapcsolatos fájdalomra olyan betegeknél, akik vagy opioidrezisztensek voltak még az adjuváns analgetikumok hozzáadásával is, vagy intoleránsak voltak az opioidok mellékhatásaival szemben.16 A burst ketamint rövid ideig tartó (3-5 napos) szubkután infúziónak tekintették, amely 100 mg/24 órás kezdeti adaggal kezdődött, majd fokozatosan 300 mg/24 órára és 500 mg/24 órára emelkedett, ha a beteg fájdalma tartósan fennállt, elviselhetetlen mellékhatások nélkül. A fájdalomcsillapítást a fájdalom típusa (szomatikus, zsigeri vagy neuropátiás) szerint elemezték. Az egynél több fájdalomtípussal rendelkező betegek mindegyik fájdalmát külön-külön elemezték. A 39 beteg 43 kezelt fájdalmából 29 (67%) legalább 50%-os csökkenést mutatott a verbális értékelő skálán (0 = nincs fájdalom, 10 = a lehető legrosszabb fájdalom), amit az opioidhasználat jelentős csökkenése támogatott 24 óra alatt és/vagy a mobilitás vagy a funkcionális állapot javulása. Tizenkét beteg számolt be a központi idegrendszeri mellékhatásokról, beleértve a “kiesett” érzést, hallucinációkat, álmosságot és szédülést.16
Methadon: A metadon egy másik NMDA-antagonista, amelyet opioidrezisztencia és neuropátiás fájdalom esetén vizsgáltak. Kimutatták, hogy jó lehetőség opioid helyettesítésére olyan betegeknél, akik rosszul kontrolláltak vagy más opioidok szedése közben dózist korlátozó mellékhatásokat tapasztalnak.17 A kontrollálatlan fájdalommal vagy jelentős mellékhatásokkal küzdő rákos betegek 80%-ánál a metadon a morfiumról metadonra való átállást követően a fájdalom és a mellékhatások csökkenését mutatta ki.18
A metadon szintén bizonyította hatékonyságát a refrakter neuropátiás fájdalomban szenvedő betegeknél. Egy kettős vak, randomizált, kontrollált, keresztirányú vizsgálatban, amelyet 18 olyan betegen végeztek, akik krónikus neuropátiás fájdalmuk miatt nem reagáltak a hagyományos fájdalomcsillapító kezelésre, a naponta kétszer 10 mg szájon át szedhető metadon statisztikailag szignifikáns fájdalomcsillapítást mutatott a maximális fájdalomintenzitás (P = .013), az átlagos fájdalomintenzitás (P = .020) és a fájdalomcsillapítás (P = .015) tekintetében a placebóhoz képest.19 A naponta kétszer 5 mg metadon szintén analgetikus javulást mutatott a maximális fájdalomintenzitás és a fájdalomcsillapítás tekintetében; ez azonban nem ért el statisztikai jelentőséget. Hat beteg visszalépett a vizsgálatból olyan nemkívánatos események miatt, mint hányinger, hányás, szédülés, izzadás és súlyos fejfájással járó dezorientáció. Mások, akik befejezték a vizsgálatot, csak enyhe vagy közepes mértékű mellékhatásokról számoltak be.19
Gagnon és munkatársai vizsgálatot végeztek a metadonnal neuropátiás fájdalom kezelésében 18 olyan betegnél, akik vagy nem kaptak opioidokat a fájdalmukra, vagy napi 120 mg orális morfinnak megfelelő mennyiségű opioidot nem kaptak a további dózisemelést megakadályozó mellékhatások miatt.8 A metadon adagját az életkortól függően napi háromszor 2 mg és 5 mg között kezdték, és a klinikai válasz és a mellékhatások alapján stabil dózisig titrálták. Szükség szerint 4-6 óránként 2 mg metadont engedélyeztek áttörési fájdalom esetén. A betegeket átlagosan 106 napig (16-466 nap) követték nyomon. Minden betegnél javult a vizuális analóg skála (VAS; 0-10 cm, ahol 0 = nincs fájdalom és 10 = a lehető legrosszabb fájdalom) fájdalomértéke a metadonkezelés hatására. A kezelés előtti átlagos VAS ± standard eltérés (SD) 7,7 ± 1,5 cm volt, és a metadonkezelés alatt 1,4 ± 1,7 cm-re csökkent (P <.0001). A 18-ból kilencnek (50%) egyáltalán nem volt fájdalma, amíg stabil metadonadagot kaptak. A 13 beteg közül, akiknél a neuropátiás fájdalom részeként allodinia is jelentkezett, 9 betegnél (70%) teljes feloldódást (klinikailag kimutatható allodinia nem volt), 4 betegnél (30%) pedig részleges feloldódást (allodinia a felület <50%-án) tapasztaltak. A 8 beteg közül, akiknek nyilalló fájdalma volt, mind a 8 (100%) stabil metadonadag mellett tünetkontrollról számolt be. A mellékhatások között szerepelt enyhe álmosság és hányinger, amely átmeneti volt, valamint székrekedés, amely hashajtókkal megszűnt.8
A metadon alkalmazása sajnos gyakran kihívást jelent, tekintettel hosszú és változó, körülbelül 8-59 órás felezési idejére, az esetleges QTc-meghosszabbodás miatt szükséges EKG-monitorozásra, valamint az egyéb QTc-meghosszabbító szerekkel, valamint a CYP3A4 és CYP2D6 gátlókkal való számos gyógyszerkölcsönhatásra.12 Emellett az opioidkonverzió nehézkes, mivel a metadon hatékonysága a morfin növekvő dózisával nő. Ezért a morfium és a metadon között nem lehet egységes arányt találni az ekvianalgetikus adagolásra.17
Memantin: Más NMDA-receptor-antagonisták, mint a memantin, az amantadin és a dextrometorfán vegyes eredményeket mutattak neuropátiás fájdalomban.20 A memantin biztonságos mellékhatásprofillal és gyors hatáskezdetű szerrel rendelkezik; azonban egy randomizált, kettős vak, keresztirányú vizsgálatban, amelyben memantint adtak egy 19 betegből álló, műtét utáni idegsérülésből eredő krónikus fájdalomban szenvedő betegcsoportnak, nem volt különbség a fájdalomcsökkentésben a memantin és a placebo között.21 Emellett a memantinnal HIV-asszociált szenzoros neuropátiában szenvedő betegeknél végzett vizsgálat nem mutatott pozitív eredményeket.22
Amantadin: Az amantadin egy másik gyógyszer, amely vegyes eredményeket mutatott a klinikai vizsgálatokban. Egy kettős vak, randomizált, placebo-kontrollált vizsgálatot végeztek 15 rákos beteggel, akiknek műtéti neuropátiás fájdalma volt.23 A betegek randomizált sorrendben, egymástól 1 hét eltéréssel 200 mg amantadin vagy placebo infúziót kaptak. A spontán és kiváltott fájdalmat 48 órával a kezelés előtt, alatt és után mértük. Az infúzió végén átlagosan 85%-os fájdalomcsökkenés következett be az amantadinnal szemben a placebóval elért 45%-os csökkenéssel (P = .009). A kezelés előtt és után 48 órával végzett átlagos fájdalomintenzitás összehasonlításakor az amantadin 31%-os fájdalomcsökkenést mutatott (P = .006), míg a placebo jelentéktelen, 6%-os fájdalomcsökkenést (P = .40).23
A pozitív eredményekkel ellentétben Fukui és munkatársai 19 olyan betegnél végeztek vizsgálatot az amantadinnal, akik nem reagáltak a neuropátiás fájdalom hagyományos kezelésére, beleértve az antikonvulzánsokat, antidepresszánsokat és idegblokkolást.24 A betegeket 1 hétig 100 mg/nap szájon át szedhető amantadinnal kezdték, majd 200 mg/napra titrálták. Az eredmények a 19 beteg közül csak 2-nél (10,5%) mutattak fájdalomcsökkenést. A betegek 52,6%-ánál tapasztaltak mellékhatásokat, köztük szájszárazságot, álmosságot, hallucinációkat, izgatottságot, irritációt, szédülést, diszkinéziát és hajhullást.24
Dextrometorfán: A vény nélkül kapható köhögéscsillapítókban gyakran megtalálható dextrometorfánt a neuropátiás fájdalomban való alkalmazása szempontjából is áttekintették. Egy placebokontrollált, kettős vak, randomizált crossover vizsgálatban 15 neuropátiás fájdalomban szenvedő beteg kapott 270 mg dextrometorfánt és placebót véletlenszerű sorrendben, egymástól 1 hetes kimosási időszakkal elválasztva.25 Az eredmények a fájdalom 30%-os csökkenését mutatták egyetlen dextrometorfán adag után a placebóhoz képest. A gyógyszerszedéstől számított 1,5 óra és 2,5-4 óra elteltével statisztikailag szignifikáns különbség mutatkozott a dextrometorfán és a placebo fájdalomcsökkentésében (P <.05 és P <.002, illetve). A mellékhatások közé tartozott a szédülés, álmosság, látászavarok és hőhullámok; egyik sem volt súlyos.25
Mivel a dextrometorfán a CYP2D6-on keresztül metabolizálódik az aktív metabolit dextrofánná, a kiterjedt és a gyenge metabolizálók összehasonlítására is sor került. A dextrometorfán extenzív metabolizálói közé tartozó betegeknél jobb fájdalomcsillapítást tapasztaltak, mint a gyenge metabolizálóknál. Arra a következtetésre jutottak, hogy a dextrometorfánnak van potenciálja a neuropátiás fájdalom kezelésében, de szélesebb körű vizsgálatokra van szükség alkalmazásának validálásához.25
A gyógyszerész szerepe
A gyógyszerészek az NMDA-antagonisták jelenlegi szerepének megértésével nagyban befolyásolhatják a betegellátást azoknál a személyeknél, akik az opioidrezisztencia és az általánosan használt szerekkel nem megfelelően kontrollált neuropátiás fájdalom miatt nem kapnak megfelelő fájdalomcsillapítást. Mivel a metadon jelenleg nagyon ígéretesnek bizonyult ezen a területen, fontos, hogy a gyógyszerészek megértsék, hogyan lehet elősegíteni e szer biztonságos használatát a megfelelő adagolás, a gyógyszerkölcsönhatások és a mellékhatások nyomon követése tekintetében.
Következtetés
Az NMDA-antagonisták nagyszerű helyszínt jelentenek az opioidrezisztens és neuropátiás fájdalom kezelésében. A jelenleg tesztelt NMDA-antagonisták közé tartozik a ketamin, a metadon, a memantin, az amantadin és a dextrometorfán. Az eddigi klinikai vizsgálatok bizonyították a ketamin és a metadon értékét a neuropátiás fájdalom és az opioidrezisztens fájdalom csökkentésében. A központi idegrendszeri mellékhatások azonban aggodalomra adnak okot, különösen a ketamin esetében. A memantin, az amantadin és a dextrometorfán gyengébb, biztonságosabb toxicitási profillal rendelkező NMDA-antagonisták, de nem mutattak következetes előnyöket ezekben a fájdalomhelyzetekben.12 Az NMDA-antagonistákkal kapcsolatos további vizsgálatokra van szükség, hogy meghatározzuk a fájdalomkezelésben való legjobb alkalmazásukat, valamint a mellékhatásaik hatékony kezelését.
1. Weiner K. Fájdalommal kapcsolatos kérdések. A fájdalom egy járvány. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Hozzáférés 2010. október 4.
2. Turk DC. A fájdalom fáj – az egyénnek, a jelentős személyeknek és a társadalomnak! APS Bulletin. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Hozzáférés: 2010. október 4.
3. Chronic pain in America: roadblocks to relief. Amerikai Fájdalom Társaság. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Hozzáférés: 2011. január 7.
4. Health Care Guidelines: Az akut fájdalom értékelése és kezelése. Institute For Clinical Systems Improvement. 6. kiadás. Március 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Hozzáférés
2011. április 8.
5. Lussier D, Huskey AG, Portenoy RK. Adjuváns fájdalomcsillapítók a rákos fájdalom kezelésében. Onkológus.
6. McCormick WC, Schreiner RL. Az ópiátrezisztens fájdalom diagnózisa és kezelése előrehaladott AIDS-ben. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. NMDA-antagonisták és neuropátiás fájdalom – többféle gyógyszercélpont és többféle felhasználás. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Metadon a neuropátiás fájdalom kezelésében. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. A fájdalom átvitelének és modulációjának neurofiziológiája: középpontban az NMDA-receptor. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Az opioidok által kiváltott tolerancia és hiperalgézia mechanizmusai. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. Az NMDA-receptor-antagonisták alkalmazása a krónikus fájdalom kezelésében. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Hozzáférés 2011. április 8.
12. Lexicomp Online. www.lexi.com. Hozzáférés: 2011. április 12.
13. Feinberg S, Provenzano D. ACPA fogyasztói útmutató a fájdalomcsillapító gyógyszeres & kezeléshez. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Hozzáférés 2011. április 8.
14. Bhavani-Shankar K, Jasmeet SO. A posztoperatív fájdalom kezelése. UptoDate. 2010. május 28. www.uptodate.com. Hozzáférés: 2011. október 4.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Az intravénás ketamin fájdalomcsillapító hatása morfiumterápián lévő rákos betegeknél: randomizált, kontrollált, kettős vak, keresztirányú, kettős adagolású vizsgálat. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. “Burst” ketamin refrakter rákos fájdalom kezelésére: 39 beteg nyílt auditja. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. A fájdalomállapotok metadonkezelése. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. A morfiumról való átállás az analgézia és a tolerálhatóság javítása érdekében rákos betegeknél: prospektív vizsgálat. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Alacsony dózisú metadon fájdalomcsillapító hatása neuropátiás fájdalomban: kettős vak, randomizált, kontrollált crossover vizsgálat. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. A rákos fájdalom kezelése: adjuváns fájdalomcsillapítók. UptoDate. May 28, 2010. www.uptodate.com. Hozzáférés: 2011. október 4.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantin (egy N-metil-d-aszpartát receptor antagonista) az amputációt vagy műtétet követő neuropátiás fájdalom kezelésében: randomizált, kettős vak, keresztirányú vizsgálat. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. A memantin placebo-kontrollált vizsgálata a humán immunhiányos vírus okozta szenzoros neuropátia kezelésére. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. Az NMDA receptor antagonista amantadin csökkenti a műtéti neuropátiás fájdalmat rákos betegeknél: kettős vak, randomizált, placebóval kontrollált vizsgálat. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Az NMDA-antagonista amantadin klinikai alkalmazása neuropátiás fájdalomban. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. A dextromet-orfanin fájdalomcsillapító hatása neuropátiás fájdalomban. Acta Anaesthesiol Scand. 2004;48:328-336.