US Pharm. 2011;36(5):HS4-HS8.
Omkring 50 millioner amerikanere lider i øjeblikket af kroniske smerter sammen med yderligere 25 millioner, der lider af akutte smerter.1 Hvert år henvender næsten halvdelen af alle amerikanere sig til deres læge med en hovedlidelse om smerter.2 Den vigtigste behandling af moderat til alvorlig smerte er opioidanalgetika, med tilføjelse af andre analgetika såsom ikke-steroide antiinflammatoriske lægemidler (NSAID) og andre adjuvante behandlinger, herunder tricykliske antidepressiva (TCA), antikonvulsiva og topiske anæstetika efter behov.3,4 Mere end fire ud af 10 personer med moderate til svære smerter får imidlertid ikke lindring ifølge en undersøgelse fra American Pain Society (APS) fra 1999.5 Af dem, der ikke får smertelindring, kan nogle af dem opleve smerter, der ikke reagerer på opioider eller andre lægemiddelbehandlinger på trods af passende brug af disse midler, som i forbindelse med opioidresistens og neuropatiske smerter.
Opioidresistens og neuropatiske smerter
Opioidresistens defineres som manglende respons på IV morfinsulfat på mindst 100 mg pr. time (eller tilsvarende dosering af et andet opioid), konsekvent høje smertevurderinger og uudbedret smerte, selv efter at opioiddosis er fordoblet. Opioidresistens er blevet fundet i en lang række sygdomstilstande, herunder kræft, kroniske smerter, neuropati, komplekst regionalt smertesyndrom, postherpetisk neuralgi og pancreatitis.6 Neuropatiske smerter skyldes skader på perifere eller centrale nerver og behandles almindeligvis med midler som TCA’er og antikonvulsiva. Desværre oplever størstedelen af patienterne ikke nogen væsentlig lindring med disse midler.7,8 Ved både opioidresistens og neuropatiske smerter kan N-methyl-d-aspartat (NMDA)-antagonister være en mulighed.
NMDA-receptorantagonister
NMDA er en receptor for den excitatoriske neurotransmitter glutamat, som frigives ved skadelige perifere stimuli.7,9 Aktivering af NMDA-receptorer er blevet associeret med hyperalgesi, neuropatiske smerter og nedsat funktionalitet af opioidreceptorer. Hyperalgesi og neuropatiske smerter er et resultat af øget sensibilisering af rygmarvsneuroner, hvilket fører til et øget smerteniveau.7,9,10 Den reducerede funktion af opioidreceptorer skyldes et fald i opioidreceptorens følsomhed. Denne nedsatte følsomhed udmønter sig igen i opioidtolerance, idet patienterne vil kræve højere doser af opioider for at opnå de samme terapeutiske virkninger.9 Derfor kan NMDA-antagonister have en rolle på disse områder af smertebehandling.10
Der findes flere NMDA-receptorantagonister: ketamin, metadon, memantin, amantadin og dextromethorphan (TABEL 1).11,12 De adskiller sig hver især i deres aktivitetsniveau på NMDA-receptoren. Ketamin er en stærk NMDA-antagonist, mens de andre er svagere NMDA-receptorblokkere.13 Sværhedsgrad og hyppighed af bivirkninger afhænger af affiniteten for NMDA-receptoren. Hos voksne er bivirkningerne af NMDA-antagonister hovedsageligt bivirkninger ved centralnervesystemet (CNS), herunder hallucinationer, svimmelhed, svimmelhed, træthed, hovedpine, fornemmelse af at være uden for kroppen, mareridt og sanseændringer. Da ketamin er en stærk NMDA-antagonist, er det mindre tolerabelt end de andre antagonister på grund af en højere forekomst af bivirkninger, især hallucinationer og en dissociativ mental tilstand.7
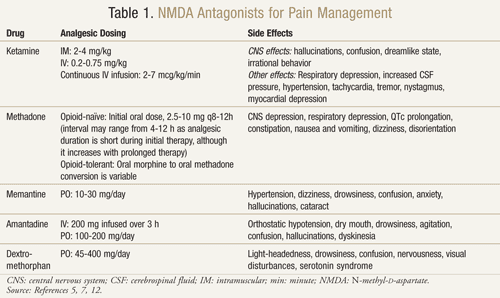
Ketamin: Ketamin har vist sig at være gavnligt i flere forskellige smertesituationer. I et klinisk forsøg gav tilføjelse af lav dosis IV ketamin til opioider sammenlignet med opioider alene postoperativt efter større abdominal kirurgi bedre analgesi, mindre sedation og mindre behov for morfin eller lægeindgreb til smertebehandling14 . Der blev også gennemført et randomiseret, dobbeltblindet, crossover, placebokontrolleret forsøg for at bekræfte tidligere resultater, der tydede på, at ketamin var effektivt hos kræftpatienter, der var resistente over for morfin.15 Hver af de 10 tilmeldte patienter modtog ketamin i en dosis på 0,25 mg/kg, 0,50 mg/kg og placebo på 3 forskellige dage med mindst 2 dages mellemrum som supplement til deres morfin. Resultaterne viste, at ketamin reducerede smerten signifikant ved begge doser sammenlignet med placebo. Patienter, der fik 0,5 mg/kg, havde en bedre smertestillende virkning end patienter, der fik 0,25 mg/kg (P <.05). Signifikante bivirkninger opstod hos fire patienter, der oplevede hallucinationer, og to patienter, der oplevede en ubehagelig fornemmelse, som de omtalte som “tomt hoved”. Patienterne fik diazepam 1 mg for en vellykket reversering af disse CNS-bivirkninger. Patienterne oplevede betydelig døsighed med begge ketamindoser, selv om den var mest udtalt ved 0,5 mg/kg-dosis (P <.05).15
I et prospektivt, multicenter, ublindet, åbent forsøg med 39 patienter viste “burst”-ketamininfusion sig at have en betydelig effekt på kræftrelaterede smerter hos patienter, som enten var opioidresistente selv med tilføjelse af adjuverende analgetika eller intolerante over for de negative virkninger af opioider.16 Burst ketamin blev defineret som en subkutan infusion af kort varighed (3-5 dage), der begyndte med en initial dosis på 100 mg/24 h og derefter eskalerede til 300 mg/24 h og 500 mg/24 h trinvis, hvis patientens smerter var vedvarende uden intolerable bivirkninger. Smertelindring blev analyseret efter type smerte (somatisk, visceral eller neuropatisk). De patienter, der havde mere end én smertetype, fik hver af deres smerter analyseret separat. Af 43 smerter behandlet hos 39 patienter viste 29 (67 %) mindst et fald på 50 % på den verbale vurderingsskala (0 = ingen smerte, 10 = værst mulige smerte) understøttet af en betydelig reduktion i opioidforbruget i løbet af 24 timer og/eller forbedret mobilitet eller funktionel status. Tolv patienter rapporterede om bivirkninger på CNS, herunder følelse af at være “spaced out”, hallucinationer, døsighed og svimmelhed.16
Methadon: Metadon: Metadon er en anden NMDA-antagonist, der er blevet undersøgt i forbindelse med opioidresistens og neuropatiske smerter. Det har vist sig at være en god mulighed for at bruge som erstatningsopioid hos patienter, der er dårligt kontrollerede eller oplever dosisbegrænsende bivirkninger, mens de er på andre opioider.17 Hos 80 % af kræftpatienter med ukontrollerede smerter eller betydelige bivirkninger har metadon vist en reduktion af smerter og bivirkninger efter et skift fra morfin til metadon.18
Methadon har også vist sig at være effektivt hos patienter med refraktære neuropatiske smerter. I et dobbeltblindet, randomiseret, kontrolleret, crossover-forsøg udført på 18 patienter, der ikke reagerede på traditionelle analgetiske regimer for deres kroniske neuropatiske smerter, viste 10 mg to gange dagligt oral metadon statistisk signifikant smertelindring i maksimal smerteintensitet (P = .013), gennemsnitlig smerteintensitet (P = .020) og smertelindring (P = .015) sammenlignet med placebo.19 Metadon på 5 mg to gange dagligt viste også analgetisk forbedring i maksimal smerteintensitet og smertelindring; det nåede dog ikke statistisk signifikans. Seks patienter trak sig fra undersøgelsen på grund af bivirkninger, herunder kvalme, opkastning, svimmelhed, svedtendens og desorientering med alvorlig hovedpine. Andre, der gennemførte forsøget, rapporterede kun, at de havde milde til moderate bivirkninger.19
Gagnon et al gennemførte et forsøg med metadon til behandling af neuropatiske smerter hos 18 patienter, der enten ikke modtog opioider mod deres smerter eller modtog en daglig dosis opioider, der ikke var større end svarende til 120 mg oral morfin på grund af bivirkninger, der forhindrede yderligere dosisoptrapning.8 Metadondoserne blev startet mellem 2 mg og 5 mg tre gange om dagen afhængigt af alder og titreret op til en stabil dosis baseret på klinisk respons og bivirkninger. Metadon 2 mg hver 4. til 6. time blev tilladt til gennembrudssmerter efter behov. Patienterne blev fulgt i en median på 106 dage (16 til 466 dage). Alle patienter oplevede en forbedring af deres smertescore på den visuelle analogskala (VAS; 0-10 cm, hvor 0 = ingen smerte og 10 = værst mulige smerte) med metadonbehandling. Den gennemsnitlige VAS ± standardafvigelse (SD) før behandling var 7,7 ± 1,5 cm og faldt til 1,4 ± 1,7 cm, når de var på metadon (P <.0001). Ni ud af 18 (50 %) havde ingen smerter overhovedet, mens de var på en stabil dosis metadon. Af de 13 patienter, der havde allodyni som en del af deres neuropatiske smerter, viste 9 (70 %) fuldstændig opløsning (ingen klinisk påviselig allodyni), og 4 (30 %) havde delvis opløsning (allodyni i <50 % af overfladen). Af de 8 patienter, der havde skydesmerter, rapporterede alle 8 (100 %) symptomkontrol på en stabil metadondosis. Bivirkningerne omfattede mild døsighed og kvalme, der var forbigående, sammen med forstoppelse, der blev løst med afføringsmidler8 .
Metadon er desværre ofte en udfordring at anvende på grund af dets lange og variable halveringstid på ca. 8 til 59 timer, den nødvendige EKG-overvågning for mulig QTc-forlængelse og de mange lægemiddelinteraktioner med andre QTc-forlængende midler samt CYP3A4- og CYP2D6-hæmmere.12 Desuden er opioidkonvertering vanskelig, da metadon stiger i styrke med stigende doser morfin. Derfor kan der ikke findes et enkelt forhold for ækvivalensalgesisk dosering mellem morfin og metadon.17
Memantine: Andre NMDA-receptorantagonister såsom memantin, amantadin og dextromethorphan har vist blandede resultater i forbindelse med neuropatiske smerter.20 Memantin har en sikker bivirkningsprofil og hurtig virkning; i en randomiseret, dobbeltblind, crossover-undersøgelse, hvor memantin blev administreret til en gruppe på 19 patienter med kroniske smerter på grund af nerveskader efter kirurgi, var der imidlertid ingen forskel i smertelindring med memantin i forhold til placebo.21 Desuden viste en undersøgelse med memantin hos patienter med HIV-associeret sensorisk neuropati ikke positive resultater.22
Amantadin: Amantadin er et andet lægemiddel, der har vist blandede resultater i kliniske forsøg. Et dobbeltblindet, randomiseret, placebokontrolleret forsøg blev udført på 15 kræftpatienter, der havde kirurgiske neuropatiske smerter.23 I en randomiseret rækkefølge fik patienterne en 200 mg infusion af amantadin eller placebo med 1 uges mellemrum. Spontane og fremkaldte smerter blev målt 48 timer før, under og efter behandlingen. I gennemsnit var der en smertereduktion på 85 % med amantadin mod 45 % med placebo (P = .009) ved afslutningen af infusionen. Ved sammenligning af den gennemsnitlige smerteintensitet 48 timer før og efter behandlingen havde amantadin en smertereduktion på 31 % (P = .006), mens placebo viste en insignifikant smertereduktion på 6 % (P = .40).23
I modsætning til disse positive resultater gennemførte Fukui et al. en undersøgelse af amantadin hos 19 patienter, der ikke reagerede på de konventionelle behandlinger for neuropatiske smerter, herunder antikonvulsiva, antidepressiva og nerveblokader.24 Patienterne blev startet på oral amantadin 100 mg/dag i 1 uge og titreret til 200 mg/dag. Resultaterne viste smertelindring hos kun 2 (10,5 %) af de 19 patienter. Der blev oplevet bivirkninger hos 52,6 % af patienterne, herunder mundtørhed, døsighed, hallucinationer, ophidselse, irritation, svimmelhed, dyskinesi og hårtab.24
Dextromethorphan: Dextromethorphan, der almindeligvis findes i håndkøbsmedicin mod hoste, er også blevet gennemgået for dets anvendelse ved neuropatiske smerter. I en placebokontrolleret, dobbeltblind, randomiseret crossover-undersøgelse fik 15 patienter med neuropatiske smerter 270 mg dextromethorphan og placebo i tilfældig rækkefølge adskilt af en 1-ugers vaskeperiode.25 Resultaterne viste en 30 % reduktion i smerte efter en enkelt dextromethorphandosis sammenlignet med placebo. Efter 1,5 time og 2,5 til 4 timer fra medicineringstidspunktet var der en statistisk signifikant forskel i smertereduktion af dextromethorphan i forhold til placebo (P <.05 og P <.002, henholdsvis). Bivirkninger omfattede svimmelhed, døsighed, synsforstyrrelser og hedeture; ingen var alvorlige.25
Da dextromethorphan metaboliseres via CYP2D6 til den aktive metabolit dextrorphan, blev omfattende versus dårlige metabolisatorer også sammenlignet. Patienter, der var omfattende metabolisatorer af dextromethorphan, oplevede bedre analgesi end dårlige metabolisatorer. Det blev konkluderet, at dextromethorphan har potentiale til behandling af neuropatiske smerter, men der er behov for mere omfattende undersøgelser for at validere brugen heraf.25
Apotekerens rolle
Apotekere kan påvirke patientbehandlingen i høj grad hos personer, der ikke får tilstrækkelig smertelindring på grund af opioidresistens og neuropatiske smerter, der ikke kontrolleres tilstrækkeligt af almindeligt anvendte midler, ved at forstå den nuværende rolle for NMDA-antagonister. Da metadon i øjeblikket har vist sig at være meget lovende på dette område, er det vigtigt, at farmaceuter forstår, hvordan de kan fremme en sikker anvendelse af dette middel med hensyn til korrekt dosering, lægemiddelinteraktioner og overvågning af bivirkninger.
Konklusion
NMDA-antagonister er et godt sted at udforske i behandlingen af opioidresistente og neuropatiske smerter. De NMDA-antagonister, der i øjeblikket er blevet afprøvet, omfatter ketamin, metadon, memantin, amantadin og dextromethorphan. De hidtidige kliniske forsøg har vist værdien af ketamin og metadon med hensyn til reduktion af neuropatiske smerter og opioidresistente smerter. Der er imidlertid bekymring for bivirkninger ved CNS, især med ketamin. Memantin, amantadin og dextromethorphan er svagere NMDA-antagonister med en sikrere toksicitetsprofil, men har ikke vist konsekvente fordele i disse smertetilstande.12 Der er behov for flere undersøgelser af NMDA-antagonister for at fastslå deres bedste anvendelse i smertebehandling samt for effektivt at håndtere deres bivirkninger.
1. Weiner K. Smerteproblemer. Smerter er en epidemi. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Tilgået den 4. oktober 2010.
2. Turk DC. Smerter gør ondt – enkeltpersoner, vigtige andre og samfundet! APS Bulletin. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Tilgået den 4. oktober 2010.
3. Kroniske smerter i Amerika: vejspærringer til lindring. American Pain Society. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Tilgået den 7. januar 2011.
4. Retningslinjer for sundhedspleje: Vurdering og behandling af akutte smerter. Institute For Clinical Systems Improvement. 6th ed. marts 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Besøgt
8. april 2011.
5. Lussier D, Huskey AG, Portenoy RK. Adjuverende analgetika i forbindelse med smertebehandling ved kræft. Onkolog.
6. McCormick WC, Schreiner RL. Diagnosticering og behandling af opiatresistente smerter ved avanceret aids. West J Med. 2001;175;175:408-411.
7. Chizh BA, Headley PM. NMDA-antagonister og neuropatiske smerter – flere lægemiddelmål og flere anvendelsesmuligheder. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Metadon til behandling af neuropatiske smerter. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Opdatering af neurofysiologien i forbindelse med smerteoverførsel og -modulering: fokus på NMDA-receptoren. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Mekanismer for opioidinduceret tolerance og hyperalgesi. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. Anvendelse af NMDA-receptorantagonister i behandlingen af kroniske smerter. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Tilgået den 8. april 2011.
12. Lexicomp Online. www.lexi.com. Tilgået den 12. april 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Besøgt den 8. april 2011.
14. Bhavani-Shankar K, Jasmeet SO. Håndtering af postoperative smerter. UptoDate. 28. maj 2010. www.uptodate.com. Tilgået den 4. oktober 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgetisk virkning af intravenøs ketamin hos kræftpatienter i morfinbehandling: en randomiseret, kontrolleret, dobbeltblind, crossover, dobbeltdosisundersøgelse. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. “Burst” ketamin til behandling af refraktære kræftsmerter: en åben revision af 39 patienter. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Metadonbehandling af smertetilstande. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Skift fra morfin for at forbedre analgesi og tolerabilitet hos kræftpatienter: en prospektiv undersøgelse. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Lavdosis metadon har en analgetisk virkning ved neuropatiske smerter: et dobbeltblindet randomiseret kontrolleret crossover-forsøg. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Ahmed E, Keilson YY. Behandling af kræftsmerter: adjuvante analgetika. UptoDate. May 28, 2010. www.uptodate.com. Besøgt den 4. oktober 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantine (en N-methyl-d-aspartatreceptorantagonist) til behandling af neuropatiske smerter efter amputation eller kirurgi: en randomiseret, dobbeltblindet cross-over-undersøgelse. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. A placebo-controlled study of memantine for the treatment of human immunodeficiency virus-associated sensory neuropathy. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. NMDA-receptorantagonisten amantadin reducerer kirurgiske neuropatiske smerter hos kræftpatienter: et dobbeltblindet, randomiseret, placebokontrolleret forsøg. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Klinisk anvendelse af amantadin, en NMDA-antagonist, til behandling af neuropatiske smerter. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Analgetisk virkning af dextrometh-orphanin neuropatiske smerter. Acta Anaesthesiol Scand. 2004;48:328-336.