- Introducere: Reacția lactat-dehidrogenazei
- Transportul malat-aspartat
- Glicoliza (an)aerobă convențională
- Conceptul de navetă a lactatului
- Compartimentarea intracelulară a LDH: lecții de la naveta fosfocreatinei
- Compartimentarea intercelulară a metabolismului lactatului: naveta lactatului dintre astrocite și neuroni
- Regenerarea NAD+ citosolic
- Shuttling-ul de protoni și transportul mitocondrial al substratului
- Considerații metodologice
- Rezumat
- Declarație privind conflictul de interese
- Recunoștințe
Introducere: Reacția lactat-dehidrogenazei
Reacția de reducere a piruvatului la lactat, catalizată de lactat-dehidrogenază (LDH; Piruvat + NADH + H+ ⇌ Lactat + NAD+) în citosolul multor celule, a fost considerată o „fundătură” metabolică (Luft, 2001; Quistorff și Grunnet, 2011a), sau, poate mai potrivit, un cul de sac metabolic (Barros, 2013), deoarece lactatul poate reintra în rețeaua metabolică doar prin intermediul piruvatului. La mamifere, reacția LDH este, de asemenea, considerată a fi „aproape de echilibru” (Spriet et al., 2000; Quistorff și Grunnet, 2011a,b), ceea ce înseamnă că reacția este reglată în principal de concentrațiile reactanților și produselor sale, mai degrabă decât de mijloace mai sofisticate de reglare alosterică sau de modificare covalentă (Crabtree și Newsholme, 1978). Deoarece echilibrul pentru reacția LDH se află mult spre dreapta (adică favorizează formarea lactatului) (Williamson et al., 1967), indiferent de izoforma LDH (Quistorff și Grunnet, 2011a,b), implicația ar putea fi că LDH rareori favorizează reacția inversă (adică oxidarea lactatului) in vivo. Într-adevăr, raportul de acțiune de masă (/) necesar pentru o oxidare apreciabilă a lactatului ar trebui să depășească constanta de echilibru pentru LDH. Cu toate acestea, dovezile experimentale infirmă din ce în ce mai mult orice noțiune că LDH funcționează unidirecțional in vivo și susține că lactatul servește ca un combustibil metabolic important pentru multe țesuturi, inclusiv pentru cele scheletice (Brooks și colab., 1991; Bergman și colab, 1999; Donovan și Pagliassotti, 2000) și mușchiul cardiac (Gertz și colab., 1988; Chatham și colab., 2001), ficatul (Skilleter și Kun, 1972; Kline și colab., 1986) și creierul (Schurr și colab., 1988; Bouzier-Sore și colab., 2006; Wyss și colab., 2011; Funfschilling și colab., 2012; revizuit în Barros, 2013). Scopul Perspectivei actuale este de a înainta un model în care lactatul este esențial pentru transferul de substrat energetic între citosol (glicoliză) și mitocondrii (fosforilarea oxidativă). Componentele unui astfel de concept au fost demonstrate în inimă (Safer et al., 1971) și în mușchiul scheletic (Schantz, 1986), au fost ulterior extinse la o perspectivă de navetă a lactatului (Stainsby și Brooks, 1990; Brooks et al., 1999) și au fost analizate în mod cuprinzător (Gladden, 2004) și comentate din nou (Gladden, 2007). Conceptul este susținut în special de cercetările recente în celulele neuronale (Gellerich et al., 2012, 2013; Rueda et al., 2014). Deși conceptul prezentat în prezenta perspectivă nu este nou, în sine (Safer et al., 1971), o aparentă lipsă de recunoaștere convențională sau de acceptare a fundamentelor sale teoretice, justifică o atenție suplimentară.
Transportul malat-aspartat
Datorită impermeabilității membranei mitocondriale interne la NAD+ și NADH, NADH generat de glicoliză în condiții aerobe depinde de transferul indirect de echivalenți reducători în mitocondrie prin intermediul transferului de malat-aspartat (MAS) și al transferului de glicerol-fosfat. Se crede că aceste navete regenerează, de asemenea, NAD+ citosolic necesar pentru a susține fluxul glicolitic la reacția gliceraldehidei 3-fosfat dehidrogenazei care necesită NAD+. S-a demonstrat că MAS este mijlocul predominant prin care se produce acest lucru în majoritatea țesuturilor oxidative și pare să constituie principala navetă de NADH în neuronii maturi (Kauppinen et al., 1987; Ramos et al., 2003; Contreras și Satrustegui, 2009; Gellerich et al., 2012). De asemenea, este bine stabilit faptul că, în condiții de cerere crescută de energie celulară și/sau de flux glicolitic crescut (de exemplu, în timpul exercițiilor fizice intense), precum și în timpul hipoxiei, concentrația de lactat va crește, deoarece reacția LDH facilitează rate crescute de regenerare citosolică a NAD+ (Robergs et al., 2004). Cu toate acestea, în creier, creșterea concentrației de lactat în circulație (de exemplu, ca în timpul exercițiilor fizice) duce la o creștere a eliminării lactatului în creier (Quistorff et al., 2008; van Hall et al., 2009; Boumezbeur et al., 2010; Dienel, 2012). De asemenea, s-a sugerat că activitatea crescută a LDH (și, la rândul său, producția de lactat) compensează pur și simplu incapacitatea MAS de a ține pasul cu cererea citosolică de NAD+ (Schantz, 1986). În neuroni, activarea cu Ca+2 a MAS și a ciclului TCA sunt competitive, astfel încât nivelurile mai scăzute de Ca+2 stimulează activitatea MAS prin activarea transportatorului glutamat/aspartat (Contreras și Satrustegui, 2009), în timp ce concentrațiile mai mari de Ca+2 activează α-cetoglutarat dehidrogenază în matricea mitocondrială, limitând α-cetoglutaratul disponibil pentru MAS (Contreras și Satrustegui, 2009). De asemenea, este posibil ca lactatul să se formeze continuu în citosol, indiferent de starea metabolică, și ca lactatul oxidat la nivelul mitocondriilor să fie cuplat la MAS. În mitocondriile cardiace izolate, de exemplu, MAS prezintă o capacitate excesivă, ceea ce sugerează că activitatea MAS este suficientă pentru a menține regenerarea NAD+ citosolic (Digerness și Reddy, 1976). Atunci, de ce, în repaus și în condiții complet aerobe, s-ar produce lactat în timpul glicolizei, dacă tot piruvatul ar trebui să ajungă la mitocondrii pentru fosforilarea oxidativă, iar MAS ar trebui să regenereze suficient NAD+?
Glicoliza (an)aerobă convențională
Apararea și dispariția lactatului în timpul diferitelor stări metabolice a fost un subiect de multe conjecturi istorice, controverse și intrigi. Au existat multe recenzii ale literaturii care examinează metabolismul lactatului, către care cititorii pot fi îndrumați. Unele dintre cele mai recente includ (Cruz et al., 2012; Dienel, 2012; Kitaoka et al., 2012; Doherty și Cleveland, 2013; Newington et al., 2013; Brooks, 2014; Schurr, 2014; Todd, 2014). Din păcate, multe manuale contemporane încă folosesc soarta metabolică a piruvatului pentru a distinge două tipuri de glicoliză: aerobă (adică, care necesită oxigen) și anaerobă (adică, fără oxigen). În prezența oxigenului, s-a spus că piruvatul se va îndrepta spre mitocondrii pentru a-și găsi sfârșitul metabolic prin fosforilare oxidativă, rezultatul net fiind resinteza ATP mitocondrială și consumul de oxigen (adică respirația) (Voet et al., 2011). În schimb, atunci când oxigenul este limitativ, piruvatul este redus la lactat în citosol de către LDH, oxidând cofactorul său NADH în acest proces (Voet et al., 2011). O problemă cu această construcție tradițională este că nu se împacă bine cu unele observații științifice recurente. De exemplu, este bine stabilit faptul că lactatul este produs, și consumat, în condiții complet aerobe. Într-adevăr, la indivizii sănătoși, normoxici, aflați în repaus în stare postabsorbție, este de așteptat ca aproximativ 50 μmol-min-1 de lactat să fie eliberat numai din creier (van Hall et al., 2009; van Hall, 2010). În mod clar, lactatul este mai mult decât un metabolit rezidual fără ieșire al glicolizei anaerobe; mai degrabă, naveta lactatului în tot organismul oferă o perspectivă utilă pentru interpretarea observațiilor experimentale.
Au fost înaintate două concepte de navetă a lactatului care descriu mișcarea și utilizarea lactatului în interiorul și între celule (Brooks, 1998). Ipoteza navetei intracelulare a lactatului postulează că lactatul format în timpul glicolizei poate fi utilizat continuu ca sursă de energie în cadrul aceleiași celule (Brooks, 1998). Naveta lactatului intercelular, sau celulă-celulă, implică lactatul generat și exportat dintr-o celulă pentru a fi preluat și utilizat de o altă celulă (Brooks, 1998). Transferul lactatului celulă-celulă a câștigat acceptarea generală; cu toate acestea, detaliile mai fine ale transferului lactatului intracelular continuă să fie investigate. Recent, am demonstrat atât o asociere fizică, cât și funcțională a LDH cu mitocondriile din mușchii scheletici (Elustondo et al., 2013). Folosind microscopia confocală cu scanare laser, am confirmat colocalizarea LDH cu proteinele membranare mitocondriale în mușchiul scheletic de șobolan. Am constatat că mitocondriile din fibrele musculare scheletice permeabilizate cu saponină de la șobolani au oxidat lactatul în prezența NAD+, a malatului și a ADP (Elustondo et al., 2013); acest lucru a fost constatat în mod similar de un alt grup în fibrele umane (Jacobs et al., 2013). Piruvatul a fost apoi transportat în mitocondrii, unde a fost oxidat în continuare de piruvatul dehidrogenază (PDH), apoi de ciclul TCA, echivalenții reducători stimulând respirația (Elustondo et al., 2013; Jacobs et al., 2013). Am reușit să inhibăm respirația cu doar 5μM de alfa-ciano-hidroxichinnamat, un inhibitor al transportului mitocondrial de piruvat, susținând în continuare faptul că piruvatul, dar nu și lactatul, este transportat în matricea mitocondrială. Aceste constatări susțin faptul că LDH este poziționată strategic pentru a interacționa funcțional cu mitocondriile și sugerează că oxidarea lactatului are loc în apropierea suprafeței exterioare a membranei mitocondriale interioare. Cum ar putea funcționa o navetă intracelulară de lactat într-o celulă intactă? Să ne întoarcem la MAS.
In vivo, NAD+ citosolic ar putea, în teorie, să fie regenerat de malat dehidrogenază în afara matricei mitocondriale, ca parte a MAS. Literatura de specialitate oferă câteva informații despre diferite țesuturi și activitățile lor de navetă mitocondrială. În creier, MAS a fost considerat cel mai important sistem de navetă pentru a introduce NADH citosolic în mitocondrii (McKenna et al., 2006 și referințele din acestea); în schimb, naveta glicerol-fosfat pare a fi de o importanță mai mică (Nguyen et al., 2003). Într-adevăr, a fost raportată asocierea intimă dintre MAS și biosinteza neurotransmițătorului glutamat (Palaiologos et al., 1988). Activitățile publicate ale MAS măsurate în mitocondriile izolate din creierul de șobolan sunt de ordinul a 26,7 nmol-min-1-mg-1 (Pardo et al., 2006). În sinaptosomi, inhibarea farmacologică a MAS duce la o scădere pronunțată (de exemplu, 50%) a oxidării lactatului (McKenna et al., 1993), susținând modelul ilustrat în figura 1. Producția intracerebrală de lactat din glucoza marcată cu 13C susține și mai mult ideea că lactatul este un combustibil important pentru neuroni (Sampol et al., 2013).
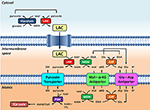
Figura 1. Reprezentarea schematică a legăturii dintre glicoliză și oxidarea lactatului la nivelul mitocondriilor prezentate în această Perspectivă. În general, glicoliza produce piruvat și NADH, în plus față de ATP. NAD+ poate fi regenerat pentru glicoliză prin reducerea piruvatului în lactat (LAC) de către lactat dehidrogenază (LDH). LAC poate difuza în mitocondrii, unde este oxidat în piruvat de către LDH. NAD+ este regenerat de către malatul dehidrogenază extra-matrixă (MDH) a navetei malat-aspartat. Ulterior, piruvatul este transportat prin membrana mitocondrială internă în matrice, unde este apoi oxidat de piruvatul dehidrogenază (PDH) în acetil CoA. Abrevieri: α-KG, alfa-cetoglutarat; Glu, glutamat; AAT, aspartat-aminotransferaza; OAA, oxaloacetat; Mal, malat.
Ar trebui remarcat faptul că MAS poate avea limitele sale. La sarcini cardiace mari de lucru, s-a demonstrat că transportatorul de α-cetoglutarat/malat al membranei mitocondriale interne nu poate concura cu α-cetoglutarat dehidrogenaza matriceală pentru substratul lor comun, α-cetoglutaratul (O’Donnell et al., 2004). Acest lucru are ca rezultat un efect de limitare a MAS și a transferului său de NADH în mitocondrie. Efectul net al acestei limitări a MAS ar fi o creștere a concentrației citosolice de lactat, deoarece regenerarea NAD+ prin reacția LDH ar contribui la menținerea raportului homeostatic NAD+/NADH, chiar și în prezența unui nivel adecvat de oxigen. Într-adevăr, acesta este fenomenul clasic observat în timpul exercițiilor fizice deosebit de intense, în care lactatul se poate acumula în sânge, în ciuda disponibilității adecvate a oxigenului.
Noțiunea de navetă a compușilor între mitocondrie și citosol pentru a satisface cerințele energetice ale celulei, folosind enzime aproape de echilibru, nu este cu siguranță nouă. Naveta fosfocreatinei (PCr) implică izoforme distincte de creatin-kinază (CK) mitocondrială și citosolică pentru a face, în esență, naveta fosfatului „de înaltă energie” din mitocondrie în citosol. Ca și reacția LDH, reacția CK (fosfocreatină + ADP + H+ ⇌ creatină + ATP), este considerată a fi „aproape de echilibru”, favorizând resinteza ATP. Cu toate acestea, dovezile experimentale demonstrează că, în celulele miocardice, numai CK citosolică este de fapt la echilibru sau aproape de echilibru (revizuit în Joubert et al., 2004). Pe de altă parte, CK mitocondrială, localizată în spațiul intermembranar, este deplasată de la echilibru, favorizând resinteza netă de PCr. Prin analogie, se consideră că două populații distincte de LDH sunt implicate în naveta intracelulară de lactat: citosolică și mitocondrială. LDH citosolică ar fi la echilibru sau aproape de echilibru, în timp ce LDH mitocondrială ar fi deplasată de la echilibru. LDH citosolic ar favoriza producția netă de lactat, în timp ce LDH mitocondrial ar favoriza oxidarea lactatului. Și la fel cum translocaza adenin nucleotidelor de adenină (ANT), care transportă ADP în matrice prin membrana mitocondrială internă în schimbul ATP, facilitează deplasarea de la echilibru pentru CK mitocondrială în spațiul intermembranar, la fel și transportatorul de piruvat ar transporta continuu piruvatul, deplasând reacția LDH mitocondrială de la echilibru (figura 1). O astfel de navetă a lactatului ar beneficia de localizarea LDH în spațiul intermembranar în apropierea membranei mitocondriale interioare, legată de exteriorul membranei mitocondriale exterioare la locurile de contact ale membranei mitocondriale exterioare și interioare, sau ambele. În cazul în care oxidarea lactatului intracelular are loc la nivelul mitocondriilor prin compartimentare, ca și în cazul navetei PCr, localizarea celulară a LDH în, la sau în jurul mitocondriilor ar fi o caracteristică importantă.
Un corp bogat și în creștere de cercetări neuroenergetice susține, de asemenea, existența metabolismului lactatului compartimentat între celulele cerebrale vecine – și anume, astrocitele și neuronii (revizuit în Pellerin și Magistretti, 2012). O variantă a navetei intercelulare de lactat în general (Brooks, 2009), naveta de lactat astrocit-neuron (Pellerin și Magistretti, 2012) se bazează pe ideea că astrocitele sunt predominant glicolitice, în timp ce neuronii sunt mai mult oxidativi (Bouzier-Sore și Pellerin, 2013 și referințele din acestea). Folosind o abordare de modelare metabolică, s-a argumentat că un flux metabolic mai mare prin PDH și prin navetele mitocondriale NADH în neuroni în comparație cu astrocitele dictează în mod necesar eliberarea netă de lactat de către astrocite și oxidarea de către neuroni (Neves et al., 2012), susținând numeroase observații experimentale (revizuite în Bouzier-Sore și Pellerin, 2013). După cum s-a menționat anterior, MAS constituie principala navetă mitocondrială de NADH în neuronii maturi (Kauppinen et al., 1987; Ramos et al., 2003; Contreras și Satrustegui, 2009; Gellerich et al., 2012). Prin urmare, o caracteristică importantă a neuronului consumator de lactat ar putea fi activitatea sa ridicată de MAS (Neves et al., 2012). Este timpul pentru o navetă lactat-malat-aspartat? Există un sprijin teoretic suplimentar pentru un astfel de model în care lactatul servește ca echivalent reducător?
Regenerarea NAD+ citosolic
Oxidarea lactatului la nivelul mitocondriei dă mai mult sens glicolizei aerobe, permițând regenerarea NAD+ citosolic de către LDH citosolic. Într-adevăr, dovezile din celulele cultivate indică un raport lactat/piruvat extrem de labil care variază pentru a păstra raportul homeostatic NAD+/NADH (Sun et al., 2012). Acest lucru ar fi avantajos pentru celulă din mai multe motive. În primul rând, ar oferi un mijloc imediat prin care să se regenereze NAD+ la nivel local (adică în citosol, unde are loc glicoliza); difuzabilitatea relativă mai mare a lactatului (greutate moleculară = 89,07 g/mol) față de NAD+ (greutate moleculară = 663,43 g/mol) înseamnă că lactatul poate difuza cu ușurință din celulă în condiții de flux glicolitic crescut (de exemplu, exerciții fizice intense, stres hipoxic), fiind în același timp direcționat către mitocondrii. În perioadele de cerere redusă de energie celulară, producția continuă de lactat în timpul ratelor mult mai scăzute ale fluxului glicolitic ar fi în continuare utilizată pentru a menține NAD+/NADH homeostatic în interiorul celulei, precum și pentru cuplarea continuă a transferului lactatului intracelular către MAS.
Shuttling-ul de protoni și transportul mitocondrial al substratului
Oxidarea lactatului la nivelul mitocondriei dă sens glicolizei aerobe deoarece producția de lactat în citosol consumă efectiv un proton (Robergs et al., 2004), ceea ce se crede că ajută la atenuarea acidozei metabolice asociate cu o rotație crescută a ATP și cu rate ridicate de glicoliză (Robergs et al., 2004). Concentrația citosolică de lactat o depășește de obicei pe cea de piruvat de cel puțin 10 ori, ceea ce înseamnă că lactatul, și nu piruvatul, este monocarboxilatul predominant care intră în spațiul intermembranar al mitocondriei (Brooks et al., 1999). Prin oxidarea lactatului în spațiul intermembranar mitocondrial, protonii ar fi eliberați unde ar putea contribui la componenta ΔpH a forței motrice protonice mitocondriale prin membrana internă (Santo-Domingo și Demaurex, 2012) și/sau ar fi transportați indirect în mitocondrie de către MAS. La fel ca în cazul transportului fosfatului anorganic și al unor alte substraturi și ioni (Santo-Domingo și Demaurex, 2012), transportul mediat de purtător al piruvatului prin membrana mitocondrială interioară în mitocondriile ficatului de șobolan pare să fie direct cuplat la simportul de protoni (sau antiportul OH-) (Papa et al., 1971; Halestrap, 1975). Oxidarea lactatului în apropierea suprafeței exterioare a membranei mitocondriale interioare, care eliberează un proton, ar contribui la ΔpH și, la rândul său, la transportul piruvatului în matrice. Adiacent membranei interne mitocondriale, raportul de acțiune masică a LDH (adică concentrațiile de produse/concentrațiile reacțiilor) ar putea fi facilitat în mare măsură de „sângerarea” piruvatului, pe măsură ce acesta este transportat în mod continuu prin membrana internă mitocondrială impermeabilă la lactat, precum și de o regenerare generoasă a NAD+ de către malatul dehidrogenază extramatrială a MAS. În acest model, transportul piruvatului prin membrana mitocondrială internă ar influența direct rata de oxidare a lactatului în afara matricei. Prin urmare, este de așteptat ca oxidarea lactatului la nivelul mitocondriilor să fie reglată indirect la nivelul reacției PDH din matrice. Acest lucru ar fi avantajos, deoarece, spre deosebire de LDH, PDH este foarte bine reglată prin alosterie și modificare covalentă. După cum s-a menționat, modelarea prezice că o activitate ridicată a PDH dictează consumul neuronal de lactat in vivo (Neves et al., 2012); iar o activitate ridicată a PDH caracterizează, de asemenea, neuronii consumatori de lactat în cultură (Halim et al., 2010).
Considerații metodologice
Dacă oxidarea lactatului mitocondrial este legată funcțional de activitatea MAS, atunci ar fi important să se includă componente ale MAS în analizele in vitro ale oxidării lactatului mitocondrial, cum ar fi malatul însuși sau oxaloacetatul. Malatul este alegerea probabilă, deoarece este inclus în mod obișnuit pentru a stimula respirația in vitro, unde este transportat în matrice și oxidat de malatul dehidrogenază mitocondrială în oxaloacetat. Acest oxaloacetat se poate apoi condensa cu acetil coA format, de exemplu, atunci când se adaugă piruvat. Includerea glutamatului, în plus față de malat, permite funcționarea completă a MAS la nivelul respirației mitocondriale. Un aspect important, dar uneori trecut cu vederea în evaluarea adecvată a oxidării lactatelor mitocondriale este includerea NAD+ ca și cofactor necesar pentru reacția LDH și a ADP ca și acceptor de fosfat pentru a stimula fosforilarea oxidativă (adică respirația de stare 3). De asemenea, componenta extramatrială a MAS implică reacția malat-dehidrogenazei: oxaloacetat + NADH + H+ ⇌ malat + NAD+. Protocoalele experimentale care examinează consumul respirator de oxigen în mitocondriile izolate din mușchi folosind concentrații mari de malat (de exemplu, 4 mM; Rasmussen et al., 2002), pot favoriza reacția malat-dehidrogenazei în sens invers (adică oxidarea malatului și producerea de NADH + H+) atunci când este adăugat la proba mitocondrială în combinație cu NAD+. Într-adevăr, reversibilitatea MAS a fost observată în hepatocite izolate (Berry, 1971) și în mitocondrii cu MAS reconstituită (Kunz și Davis, 1991). Efectul net al acestei inversări a MAS asupra respirației ar fi acela de a reduce intrarea malatului în mitocondrii, formând oxaloacetat. Mai important, inversarea ar împiedica oxidarea lactatului în piruvat, precum și transportul și oxidarea ulterioară a piruvatului în matrice. Soluțiile la aceste obstacole metodologice în calea observării oxidării lactatului mitocondrial in vitro implică includerea a cel puțin unei componente a MAS. În cazul în care se adaugă malat, concentrația adecvată trebuie să fie determinată experimental. Includerea ADP și NAD+ sau NADH (reamintim, MAS va genera NAD+ pentru reacția LDH) este necesară, de asemenea, pentru a observa o oxidare apreciabilă a lactatului mitocondrial.
Rezumat
Un lactat-MAS este interacțiunea dintre navetele lactat și malat-aspartat pentru a transloca puterea reducătoare către mitocondrii, în special în cadrul celulelor oxidative, metabolic active.
Declarație privind conflictul de interese
Autorul declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Multe mulțumiri doctorului Erich Gnaiger (Universitatea de Medicină din Innsbruck) și doctorului George Brooks (Universitatea din California, Berkeley) pentru că au criticat fiecare versiunile anterioare ale acestei lucrări.
Barros, L. F. (2013). Semnalizarea metabolică prin lactat în creier. Trends Neurosci. 36, 396-404. doi: 10.1016/j.tins.2013.04.002
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Bergman, B. C., Wolfel, E. E., Butterfield, G. E. E., Lopaschuk, G. D., Casazza, G. A., Horning, M. A., et al. (1999). Cinetica activă a mușchilor și a lactatului întregului corp după antrenamentul de anduranță la bărbați. J. Appl. Physiol. (1985) 87, 1684-1696.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Berry, M. N. (1971). Reducerea dependentă de energie a piruvatului la lactat de către celulele parenchimatoase izolate intacte din ficatul de șobolan. Biochimie. Biophys. Res. Commun. 44, 1449-1456. doi: 10.1016/S0006-291X(71)80248-6
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Ref Full Text | Google Scholar
Boumezbeur, F., Petersen, K. F., Cline, G. W., Mason, G. F., Behar, K. L., Shulman, G. I., et al. (2010). Contribuția lactatului din sânge la metabolismul energetic al creierului la om, măsurată prin spectroscopie dinamică de rezonanță magnetică nucleară 13C. J. Neurosci. 30, 13983-13991. doi: 10.1523/JNEUROSCI.2040-10.2010
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Bouzier-Sore, A. K., și Pellerin, L. (2013). Deslușirea naturii metabolice complexe a astrocitelor. Front. Cell. Neurosci. 7:179. doi: 10.3389/fncel.2013.00179
Pubmed Abstract | Pubmed Full Text | Refef Full Text | Google Scholar
Bouzier-Sore, A. K., Voisin, P., Bouchaud, V., Bezancon, E., Franconi, J. M., și Pellerin, L. (2006). Competiția dintre glucoză și lactat ca substraturi de energie oxidativă atât în neuroni, cât și în astrocite: un studiu RMN comparativ. Eur. J. Neurosci. 24, 1687-1694. doi: 10.1111/j.1460-9568.2006.05056.x
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Brooks, G. A. (1998). Utilizarea combustibilului la mamifere în timpul exercițiului susținut. Comp. Biochem. Fiziologie B Biochimie. Mol. Biol. 120, 89-107. doi: 10.1016/S0305-0491(98)00025-X
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Brooks, G. A. (2009). Navetele de lactat celulare și intracelulare. J. Physiol. 587, 5591-5600. doi: 10.1113/jphysiol.2009.178350
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Brooks, G. A. (2014). „Sisteme metabolice: formarea și utilizarea lactatului”, în History of Exercise Physiology. Human Kinetics, ed C. M. Tipton (Champaign, IL: Human Kinetics), 447-475.
Google Scholar
Brooks, G. A., Butterfield, G. E., Wolfe, R. R. R., Groves, B. M., Mazzeo, R. S., Sutton, J. R., et al. (1991). Scăderea dependenței de lactat în timpul exercițiilor fizice după aclimatizarea la 4.300 m. J. Appl. Physiol. (1985). 71, 333-341.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Brooks, G. A., Dubouchaud, H., Brown, M., Sicurello, J. P., și Butz, C. E. (1999). Rolul lactatului dehidrogenazei mitocondriale și al oxidării lactatului în naveta intracelulară a lactatului. Proc. Natl. acad. Sci. U.S.A. 96, 1129-1134. doi: 10.1073/pnas.96.3.1129
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Chatham, J. C., Des Rosiers, C., și Forder, J. R. (2001). Dovezi ale unor căi separate pentru absorbția și eliberarea lactatului de către inima de șobolan perfuzată. Am. J. Physiol. Endocrinol. Metab. 281, E794-E802.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Contreras, L., și Satrustegui, J. (2009). Semnalizarea calciului în mitocondriile creierului: interacțiunea căilor de transfer al malatului aspartat NADH și al uniportorului de calciu / dehidrogenazei mitocondriale. J. Biol. Chem. 284, 7091-7099. doi: 10.1074/jbc.M808066200
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Ref Full Text | Google Scholar
Crabtree, B., și Newsholme, E. A. (1978). Sensibilitatea unei reacții apropiate de echilibru într-o cale metabolică la modificări ale concentrației de substrat. Eur. J. Biochem. 89, 19-22. doi: 10.1111/j.1432-1033.1978.tb20891.x
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Cruz, R. S., de Aguiar, R. A., Turnes, T., Penteado Dos Santos, R., de Oliveira, M. F., și Caputo, F. (2012). Naveta intracelulară: metabolismul aerobic lactat. ScientificWorldJournal 2012:420984. doi: 10.1100/2012/420984
Pubmed Abstract | Pubmed Full Text |Ref Full Text | Google Scholar
Dienel, G. A. (2012). Metabolismul lactatului cerebral: descoperirile și controversele. J. Cereb. Blood Flow Metab. 32, 1107-1138. doi: 10.1038/jcbfm.2011.175
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Digerness, S. B., și Reddy, W. J. (1976). Naveta malat-aspartat în mitocondriile inimii. J. Mol. Cell. Cardiol. 8, 779-785. doi: 10.1016/0022-2828(76)90084-5
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Doherty, J. R., and Cleveland, J. L. (2013). Direcționarea metabolismului lactatului pentru terapeutica cancerului. J. Clin. Invest. 123, 3685-3692. doi: 10.1172/JCI69741
Pubmed Abstract | Pubmed Full Text |Ref Full Text | Google Scholar
Donovan, C. M. și Pagliassotti, M. J. (2000). Evaluarea cantitativă a căilor de eliminare a lactatului în tipurile de fibre musculare scheletice. Med. Sci. Sports Exerc. 32, 772-777. doi: 10.1097/00005768-200004000-00009
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Elustondo, P. A., White, A. E., White, A. E., Hughes, M. E., Brebner, K., Pavlov, E., și Kane, D. A. (2013). Asocierea fizică și funcțională a lactat dehidrogenazei (LDH) cu mitocondriile mușchilor scheletici. J. Biol. Chem. 288, 25309-25317. doi: 10.1074/jbc.M113.476648
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Funfschilling, U., Supplie, L. M., Mahad, D., Boretius, S., Saab, A. S., Edgar, J., et al. (2012). Oligodendrocitele glicolitice mențin mielina și integritatea axonală pe termen lung. Nature 485, 517-521. doi: 10.1038/nature11007
Pubmed Abstract | Pubmed Full Text | Refef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Gainutdinov, T., Muth, K., Seppet, E., Orynbayeva, Z., et al. (2013). Controlul energizării mitocondriale a creierului prin calciu citosolic: pedala de gaz mitocondrială. IUBMB Life 65, 180-190. doi: 10.1002/iub.1131
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Gellerich, F. N., Gizatullina, Z., Trumbekaite, S., Korzeniewski, B., Gaynutdinov, T., Seppet, E., et al. (2012). Ca2+ citosolic reglează energizarea mitocondriilor cerebrale izolate prin formarea de piruvat prin intermediul navetei malat-aspartat. Biochem. J. 443, 747-755. doi: 10.1042/BJ20110765
Pubmed Abstract | Pubmed Full Text |Ref Full Text | Google Scholar
Gertz, E. W., Wisneski, J. A., Stanley, W. C., și Neese, R. A. (1988). Utilizarea substratului miocardic în timpul exercițiilor fizice la om. Experimente cu izotopi de carbohidrați marcați cu carbon dublu. J. Clin. Invest. 82, 2017-2025. doi: 10.1172/JCI113822
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Gladden, L. B. (2004). Metabolismul lactatului: o nouă paradigmă pentru al treilea mileniu. J. Physiol. 558, 5-30. doi: 10.1113/jphysiol.2003.058701
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Gladden, L. B. (2007). Există o navetă intracelulară de lactat în mușchiul scheletic? J. Physiol. 582, 899. doi: 10.1113/jphysiol.2007.138487
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Halestrap, A. P. (1975). Transportatorul mitocondrial de piruvat. Cinetică și specificitate pentru substraturi și inhibitori. Biochimie. J. 148, 85-96.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Halim, N. D., McFate, T., Mohyeldin, A., Okagaki, P., Korotchkina, L. G., Patel, M. S., et al. (2010). Starea de fosforilare a piruvat dehidrogenazei distinge fenotipurile metabolice ale astrocitelor și neuronilor din creierul de șobolan cultivat. Glia 58, 1168-1176. doi: 10.1002/glia.20996
Pubmed Abstract | Pubmed Full Text | Refef Full Text | Google Scholar
Jacobs, R. A., Meinild, A. K., Nordsborg, N. B., și Lundby, C. (2013). Oxidarea lactatului în mitocondriile musculare scheletice umane. Am. J. Physiol. Endocrinol. Metab. 304, E686-E689. doi: 10.1152/ajpendo.00476.2012
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Joubert, F., Mateo, P., Gillet, B., Beloeil, J. C., Mazet, J. L., și Hoerter, J. A. (2004). Fluxul CK sau transferul direct de ATP: versatilitatea căilor de transfer de energie evidențiată prin RMN în inima perfuzată. Mol. Cell. Biochimie. 256-257, 43-58. doi: 10.1023/B:MCBI.0000009858.41434.fc
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Kauppinen, R. A., Sihra, T. S., și Nicholls, D. G. (1987). Acidul aminooxiacetic inhibă naveta malat-aspartat în terminalele nervoase izolate și împiedică mitocondriile să utilizeze substraturile glicolitice. Biochim. Biophys. Acta 930, 173-178. doi: 10.1016/0167-4889(87)90029-2
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Kitaoka, Y., Hoshino, D., și Hatta, H. (2012). Transportatorul de monocarboxilat și metabolismul lactatului. J. Phys. Fitness Fitness Sports Med. 1, 247-252. doi: 10.7600/jpfsm.1.247
CrossRef Full Text | Google Scholar
Kline, E. S., Brandt, R. B., Laux, J. E., Spainhour, S. E., Higgins, E. S. S., Rogers, K. S., et al. (1986). Localizarea L-lactat dehidrogenazei în mitocondrii. Arch. Biochem. Biophys. 246, 673-680. doi: 10.1016/0003-9861(86)90323-1
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Kunz, W. S., and Davis, E. J. (1991). Controlul transferului intracelular reversibil al potențialului reducător. Arch. Biochem. Biophys. 284, 40-46. doi: 10.1016/0003-9861(91)90260-P
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Luft, F. C. (2001). Actualizarea acidozei lactice pentru clinicienii de terapie intensivă. J. Am. Soc. Nephrol. 12 Suppl 17: S15-S19.
Pubmed Abstract | Pubmed Full Text | Google Scholar
McKenna, M. C., Tildon, J. T., Stevenson, J. H., Boatright, R., și Huang, S. (1993). Reglarea metabolismului energetic în terminalele sinaptice și în astrocitele din creierul de șobolan cultivat: diferențe dezvăluite cu ajutorul aminooxiacetatului. Dev. Neurosci. 15, 320-329. doi: 10.1159/000111351
Pubmed Abstract | Pubmed Full Text | Refef Full Text | Google Scholar
McKenna, M. C., Waagepetersen, H. S., Schousboe, A., și Sonnewald, U. (2006). Mecanisme de navetă neuronală și astrocitară pentru transferul citosolic-mitochondrial de echivalenți reducători: dovezi actuale și instrumente farmacologice. Biochem. Pharmacol. 71, 399-407. doi: 10.1016/j.bcp.2005.10.011
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Neves, A., Costalat, R., și Pellerin, L. (2012). Determinanții fenotipurilor metabolice ale celulelor cerebrale și utilizarea substratului energetic deslușite cu o abordare de modelare. PLoS Comput. Biol. 8:e1002686. doi: 10.1371/journal.pcbi.1002686
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Ref Full Text | Google Scholar
Newington, J. T., Harris, R. A., și Cumming, R. C. (2013). Reevaluarea metabolismului în boala Alzheimer din perspectiva modelului de navetă de lactat astrocit-neuron. J. Neurodegener. Dis. 2013, 13. doi: 10.1155/2013/234572
CrossRef Full Text | Google Scholar
Nguyen, N. H., Brathe, A., și Hassel, B. (2003). Absorbția și metabolismul neuronal al glicerolului și expresia neuronală a glicerol-3-fosfat dehidrogenazei mitocondriale. J. Neurochem. 85, 831-842. doi: 10.1046/j.1471-4159.2003.01762.x
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Ref Full Text | Google Scholar
O’Donnell, J. M., Kudej, R. K. K., LaNoue, K. F., Vatner, S. F., și Lewandowski, E. D. (2004). Transferul limitat de NADH citosolic în mitocondrii la o sarcină de lucru cardiacă ridicată. Am. J. Physiol. Heart Circ. Physiol. 286, H2237-H2242. doi: 10.1152/ajpheart.01113.2003
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Palaiologos, G., Hertz, L., și Schousboe, A. (1988). Dovezi că activitatea aspartat aminotransferazei și funcția de transportator cetodicarboxilat sunt esențiale pentru biosinteza glutamatului transmițător. J. Neurochem. 51, 317-320. doi: 10.1111/j.1471-4159.1988.tb04872.x
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Papa, S., Francavilla, A., Paradies, G., și Meduri, B. (1971). Transportul de piruvat în mitocondriile ficatului de șobolan. FEBS Lett. 12, 285-288. doi: 10.1016/0014-5793(71)80200-4
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Pardo, B., Contreras, L., Serrano, A., Ramos, M., Kobayashi, K., Iijima, M., et al. (2006). Rolul esențial al lui aralar în transducția semnalelor mici de Ca2+ către mitocondriile neuronale. J. Biol. Chem. 281, 1039-1047. doi: 10.1074/jbc.M507270200
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Pellerin, L., and Magistretti, P. J. (2012). Sweet sixteen pentru ANLS. J. Cereb. Blood Flow Metab. 32, 1152-1166. doi: 10.1038/jcbfm.2011.149
Pubmed Abstract | Pubmed Full Text | Pubmed Full CrossRef Full Text | Google Scholar
Quistorff, B., și Grunnet, N. (2011a). Lactatul cerebral ridicat nu este cauzat de o schimbare a raportului lactat dehidrogenază A/B. Proc. Natl. Acad. Sci. U.S.A. 108, E21. răspuns autor: E22. doi: 10.1073/pnas.1017750108
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Quistorff, B., și Grunnet, N. (2011b). Modelul izoenzimatic al LDH nu joacă un rol fiziologic; cu excepția, poate, în timpul tranzițiilor rapide în metabolismul energetic. Aging (Albany, NY) 3, 457-460.
Google Scholar
Quistorff, B., Secher, N. H., și Van Lieshout, J. J. (2008). Lactatul alimentează creierul uman în timpul exercițiilor fizice. FASEB J. 22, 3443-3449. doi: 10.1096/fj.08-106104
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Ramos, M., del Arco, A., Pardo, B., Martinez-Serrano, A., Martinez-Morales, J. R., Kobayashi, K., et al. (2003). Modificări de dezvoltare ale transportatorului mitocondrial de aspartat-glutamat aralar1 reglat de Ca2+ în creier și expresie proeminentă în măduva spinării. Brain Res. Dev. Brain Res. 143, 33-46. doi: 10.1016/S0165-3806(03)00097-X
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Ref Full Text | Google Scholar
Rasmussen, H. N., van Hall, G., și Rasmussen, U. F. (2002). Lactat dehidrogenaza nu este o enzimă mitocondrială în mușchiul vastus lateralis uman și de șoarece. J. Physiol. 541, 575-580. doi: 10.1113/jphysiol.2002.019216
Pubmed Abstract | Pubmed Full Text | Ref Full Text | Google Scholar
Robergs, R. A., Ghiasvand, F., și Parker, D. (2004). Biochimia acidozei metabolice induse de exerciții fizice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 287, R502-R516. doi: 10.1152/ajpregu.00114.2004
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Rueda, C. B., Llorente-Folch, I., Amigo, I., Contreras, L., Gonzalez-Sanchez, P., Martinez-Valero, P., et al. (2014). Reglarea Ca2+ a funcției mitocondriale în neuroni. Biochim. Biophys. Acta 1837, 1637, 1617-1624. doi: 10.1016/j.bbabio.2014.04.010
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Safer, B., Smith, C. M., și Williamson, J. R. (1971). Controlul transportului de echivalenți reducători prin membrana mitocondrială în inima de șobolan perfuzată. J. Mol. Cell. Cardiol. 2, 111-124. doi: 10.1016/0022-2828(71)90065-4
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text | Google Scholar
Sampol, D., Ostrofet, E., Jobin, M. L., Raffard, G., Sanchez, S., Bouchaud, V., et al. (2013). Metabolismul glucozei și lactatului la șobolanul treaz și stimulat: un studiu (13)C-NMR. Front. Neuroenergetics 5:5. doi: 10.3389/fnene.2013.00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Santo-Domingo, J., și Demaurex, N. (2012). Perspective privind: Simpozionul SGP privind fiziologia și medicina mitocondrială: renașterea pH-ului mitocondrial. J. Gen. Physiol. 139, 415-423. doi: 10.1085/jgp.201110767
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Schantz, P. G. (1986). Plasticitatea mușchiului scheletic uman cu referire specială la efectele antrenamentului fizic asupra nivelurilor enzimatice ale navetelor NADH și a expresiei fenotipice a proteinelor miofibrilare lente și rapide. Acta Physiol. Scand. Suppl. 558, 1-62.
Pubmed Abstract | Pubmed Full Text | Google Scholar
Schurr, A. (2014). Glicoliza cerebrală: un secol de neînțelegeri și concepții greșite persistente. Front. Neurosci. 8:360. doi: 10.3389/fnins.2014.00360
CrossRef Full Text | Google Scholar
Schurr, A., West, C. A., și Rigor, B. M. (1988). Funcția sinaptică susținută de lactat în preparatul de felie de hipocampal de șobolan. Science 240, 1326-1328. doi: 10.1126/science.3375817
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
Skilleter, D. N., and Kun, E. (1972). Oxidarea L-lactatului de către mitocondriile hepatice. Arch. Biochem. Biophys. 152, 92-104. doi: 10.1016/0003-9861(72)90197-X
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Spriet, L. L., Howlett, R. A., și Heigenhauser, G. J. (2000). O abordare enzimatică a producției de lactat în mușchiul scheletic uman în timpul exercițiilor fizice. Med. Sci. Sports Exerc. 32, 756-763. doi: 10.1097/00005768-200004000-00007
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Stainsby, W. N., and Brooks, G. A. (1990). Controlul metabolismului acidului lactic în mușchii contractanți și în timpul exercițiilor fizice. Exerc. Sport Sci. Rev. Rev. 18, 29-63. doi: 10.1249/00003677-199001000-00005
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
Sun, F., Dai, C., Xie, J., și Hu, X. (2012). Aspecte biochimice în estimarea raportului NAD/NADH liber citosolic. PLoS ONE 7:e34525. doi: 10.1371/journal.pone.0034525
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text | Google Scholar
Todd, J. J. (2014). Lactatul: valoros pentru performanța fizică și menținerea funcției cerebrale în timpul exercițiilor fizice. Biosci. Orizonturi. 7, 1-7. doi: 10.1093/biohorizons/hzu001
CrossRef Full Text | Google Scholar
van Hall, G. (2010). Cinetica lactatului în țesuturile umane în repaus și în timpul exercițiilor fizice. Acta Physiol. (Oxf.) 199, 499-508. doi: 10.1111/j.1748-1716.2010.02122.x
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text | Google Scholar
van Hall, G., Stromstad, M., Rasmussen, P., Jans, O., Zaar, M., Gam, C., et al. (2009). Lactatul din sânge este o sursă importantă de energie pentru creierul uman. J. Cereb. Blood Flow Metab. 29, 1121-1129. doi: 10.1038/jcbfm.2009.35
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Google Scholar
Voet, D., Voet, J. G., și Pratt, C. W. (2011). Fundamentals of Biochemistry: Life at the Molecular Level (Viața la nivel molecular). Hoboken, NJ: Wiley.
Google Scholar
Williamson, D. H., Lund, P., și Krebs, H. A. (1967). The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver. Biochem. J. 103, 514-527.
Pubmed Abstract | Pubmed Full Text | Google Scholar
.