US Pharm. 2011;36(5):hs4-hs8.
現在、5000万人のアメリカ人が慢性痛に苦しんでおり、さらに2500万人が急性痛に苦しんでいると推定されています1。毎年、アメリカ人の約半数が痛みを主訴に医師の診察を受けています2。 中等度から重度の疼痛に対する治療の中心はオピオイド鎮痛剤で、必要に応じて非ステロイド性抗炎症薬(NSAIDs)などの他の鎮痛剤や三環系抗うつ薬(TCAs)、抗けいれん薬、局所麻酔薬などの補助療法が追加されます3,4。 しかし、1999年に行われた米国疼痛学会(APS)の調査によると、中等度から重度の疼痛を持つ10人のうち4人以上は、痛みが緩和されていません5。痛みが緩和されない人の中には、オピオイド抵抗性や神経障害性疼痛のように、オピオイドや他の薬剤療法を適切に使用しても反応しない痛みを経験している可能性のある人もいます。
オピオイド抵抗性と神経障害性疼痛
オピオイド抵抗性は、少なくとも1時間当たり100 mgの硫酸モルヒネの静注(または他のオピオイドの等量投与)に反応せず、常に高い疼痛評価、オピオイド量を倍にしても痛みが緩和されないことと定義されています。 オピオイド抵抗性は、がん、慢性疼痛、神経障害、複合性局所疼痛症候群、帯状疱疹後神経痛、膵炎など多くの病態で認められている6。神経障害性疼痛は、末梢神経または中枢神経の損傷によって生じ、TCAや抗痙攣薬などの薬剤で一般的に治療されている。 オピオイド抵抗性と神経因性疼痛には、N-methyl-d-aspartate(NMDA)拮抗薬が有効である可能性があります。
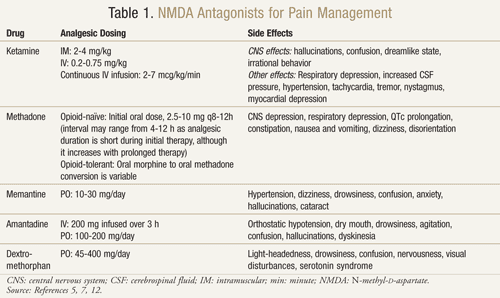
Ketamine: ケタミンは複数の痛みの場面で有益であることが証明されている。 ある臨床試験では、腹部大手術の術後に、オピオイドに低用量のケタミンを静注した場合とオピオイドのみを静注した場合では、鎮痛効果が高く、鎮静が少なく、疼痛管理のためのモルヒネの必要性や医師の介入が減少した14。 また、モルヒネに抵抗性のある癌患者に対してケタミンが有効であることを示唆した以前の結果を確認するために、無作為化二重盲検クロスオーバー・プラセボ対照試験が行われた15。登録した10人の患者それぞれに、少なくとも2日間隔で3日間、モルヒネに加えてケタミンを0.25 mg/kg, 0.50 mg/kg およびプラセボの用量で投与した。 その結果、ケタミンはいずれの用量でもプラセボと比較して有意に疼痛を軽減した。 0.5mg/kgを投与された患者は,0.25mg/kgを投与された患者よりも鎮痛効果が高かった(P <.05)。 重大な副作用は,幻覚を経験した4名と “empty head “と呼ばれる不快な感覚を経験した2名に発現した。 ジアゼパム1 mgを投与したところ,これらの中枢神経系の副作用を回復させることに成功した。 15
39人の患者を対象とした多施設非盲検プロスペクティブ試験において,ケタミンの「バースト」注入が,補助鎮痛薬を追加してもオピオイド抵抗性であるか,オピオイドの副作用に不耐性である患者のがん関連痛に著しい効果を持つことが示された16. バーストケタミンは、短期間(3~5日間)の皮下輸液と定義され、初期用量100mg/24時間から開始し、耐えられない副作用がなく患者の痛みが持続する場合は300mg/24時間、500mg/24時間と段階的に漸増させることとした。 痛みの軽減は、痛みのタイプ(体性、内臓性、神経障害性)別に分析された。 複数の疼痛タイプを持つ患者には、それぞれの疼痛を別々に分析した。 39名の患者が治療した43の痛みのうち、29名(67%)が言語性評価尺度(0=無痛、10=最悪の痛み)で少なくとも50%の減少を示し、24時間のオピオイド使用量の有意な減少、および/または運動能力や機能状態の改善が認められました。 12人の患者が、「ボーっとする」感じ、幻覚、眠気、めまいなどの中枢神経系の副作用を報告した16
Methadone: メタドンは、オピオイド抵抗性と神経障害性疼痛で研究されている別のNMDA拮抗薬である。 疼痛がコントロールされていない、あるいは他のオピオイドを使用している間に用量制限的な副作用を経験した患者において、代替オピオイドとして使用する良い選択肢であることが示されている17。80%の疼痛がコントロールされていない、あるいは著しい副作用を有する癌患者において、モルヒネからメタドンに変更した後に疼痛と副作用が減少したことが実証されている18
またメタドンは難治性の神経因性疼痛患者においても有効性が実証された。 慢性神経障害性疼痛に対して従来の鎮痛レジメンに反応しなかった患者18人を対象に実施された二重盲検無作為化対照クロスオーバー試験において、メタドン10mg1日2回経口投与は、プラセボと比較して、最大疼痛強度(P = .013)、平均疼痛強度(P = 020)、疼痛緩和(P = .015)に統計的に有意な疼痛緩和効果を示した19。メタドン5mg1日2回も最大疼痛強度および疼痛緩和に鎮痛効果を示したものの統計的に有意には達しなかった。 6名の患者が、吐き気、嘔吐、めまい、発汗、重度の頭痛を伴う意識障害などの有害事象により、本試験から離脱しました。 19
Gagnonらは、疼痛に対してオピオイドを投与されていないか、副作用のためにそれ以上の増量ができず、1日のオピオイドの投与量が経口モルヒネ120mg相当を超えていない患者18人を対象に、神経障害性疼痛の治療にメタドンを用いる試験を実施した8。 メタドンの投与量は、年齢に応じて1日3回、2mgから5mgの間で開始され、臨床反応と副作用に基づいて安定した用量まで漸増されました。 ブレイクスルーペインに対しては、必要に応じてメタドン2mgを4〜6時間ごとに投与することが許可された。 患者は中央値で106日間(16日から466日)追跡された。 すべての患者は、メタドン治療により視覚的アナログスケール(VAS;0〜10cm、0=痛みなし、10=最悪の痛み)の疼痛スコアに改善を認めた。 治療前の平均VAS±標準偏差(SD)は7.7±1.5cmで、メタドン投与時には1.4±1.7cmに減少した(P <.0001)。 18人中9人(50%)はメタドンを安定投与している間,全く痛みがなかった。 神経障害性疼痛の一部としてアロディニアがあった13人の患者のうち,9人(70%)は完全消失(臨床的に検出可能なアロディニアがない),4人(30%)は部分消失(表面積の<50%にアロディニアがある)であった。 射出性疼痛を有する8名の患者のうち、8名全員(100%)が安定したメタドン投与で症状がコントロールされたと報告された。 副作用は、一過性の軽い眠気と吐き気、下剤で解消された便秘などであった8。
残念ながら、メタドンは半減期が約8~59時間と長く、変動しやすいこと、QTc延長の可能性があるため心電図モニターが必要なこと、他のQTc延長剤、CYP3A4およびCYP2D6阻害剤と多くの薬物相互作用を示すことから、使用が困難な場合が多い。12 さらに、メタドンの効力がモルヒネの用量増加に伴って増加するので、オピオイド変換が困難である。 したがって、モルヒネとメタドンの間で、等痛覚性投与のための単一の比率を見出すことはできない17
Memantine: メマンチン、アマンタジン、デキストロメトルファンなどの他のNMDA受容体拮抗薬は、神経障害性疼痛においてさまざまな結果を示している20。メマンチンは安全な副作用プロファイルと迅速な作用発現を有するが、手術後の神経損傷による慢性疼痛を有する19名の患者グループにメマンチンを投与した無作為二重盲検クロスオーバー試験では、プラセボに対してメマンティンで疼痛の軽減に違いはみられなかった21。 さらに、HIV関連感覚神経障害の患者を対象としたメマンチンによる研究では、良好な結果は得られなかった22。
アマンタジン アマンタジンは、臨床試験でさまざまな結果を示したもう一つの薬物である。 外科的な神経障害性疼痛を有する15人のがん患者において、二重盲検無作為プラセボ対照試験が実施された23。無作為の順序で、患者は互いに1週間おきに200mgのアマンタジンまたはプラセボの点滴を受けた。 治療前、治療中、治療後の48時間に自発痛と誘発痛が測定された。 点滴終了時、平均して、amantadineでは85%、プラセボでは45%の痛みの減少がみられた(P = 0.009)。 治療前と治療後の48時間の平均疼痛強度を比較すると、アマンタジンは31%の疼痛軽減を示し(P = .006)、一方、プラセボは6%(P = .40)という重要ではない疼痛軽減を示していました23
これらのポジティブな結果に対し、福井らは抗痙攣薬、抗うつ薬、神経ブロックなどの従来の神経障害性疼痛に対する治療に反応しなかった患者19人を対象にアマンタジンの研究を行いました24。 患者さんには、amantadine 100 mg/日の経口投与を1週間開始し、200 mg/日に漸増させました。 その結果、19名中2名(10.5%)のみで疼痛の軽減が認められた。 副作用は、口渇、眠気、幻覚、興奮、刺激、めまい、ジスキネジア、脱毛など52.6%の患者にみられた24
Dextromethorphan: OTC咳止めによく見られるデキストロメトルファンは、神経障害性疼痛での使用についても検討されている。 プラセボ対照二重盲検無作為クロスオーバー試験において、神経障害性疼痛の患者15人に、デキストロメトルファン270mgとプラセボを無作為の順序で、1週間の洗浄期間をおいて投与しました25。その結果、デキストロメトルファン1回の投与でプラセボと比較して30%の痛みの減少が認められました。 投薬から1.5時間後と2.5~4時間後では、デキストロメトルファンとプラセボの痛みの軽減に統計的に有意な差がありました(それぞれP <.05, P <.002 )。 25
デキストロメトルファンはCYP2D6を介して活性代謝物デキストロファンに代謝されるため、代謝の多い人と少ない人の比較も行われました。 デキストロメトルファンの代謝が広範囲に及ぶ患者は、代謝不良の患者よりも良好な鎮痛効果が得られた。 25
薬剤師の役割
薬剤師は、NMDA拮抗薬の現在の役割を理解することにより、オピオイド抵抗性のために十分な鎮痛を受けていない患者や一般的に使用されている薬剤では十分にコントロールできない神経障害性疼痛において、患者の治療に大きな影響を与えることができます。 現在、この分野ではメタドンが有望視されているため、薬剤師は、適切な投与量、薬物相互作用、副作用のモニタリングに関して、この薬剤の安全使用を促進する方法を理解することが重要である。
結論
NMDA拮抗薬は、オピオイド抵抗性や神経障害性疼痛の治療において探求すべき素晴らしい場である。 現在試験されているNMDA拮抗薬には、ケタミン、メタドン、メマンチン、アマンタジン、デキストロメトルファンがある。 これまでの臨床試験で、神経障害性疼痛やオピオイド抵抗性疼痛の軽減にケタミンやメタドンが有効であることが証明されている。 しかし、特にケタミンでは、中枢神経系の副作用が懸念される。 メマンチン、アマンタジン、デキストロメトルファンは、より安全な毒性プロファイルを持つ弱いNMDA拮抗薬であるが、これらの痛みの設定において一貫した利益を示していない。12 NMDA拮抗薬について、痛み管理における最善の使用と、その副作用を効果的に管理するためのさらなる研究が必要である。
1. Weiner K. 痛みの問題。 痛みは伝染病である。 米国疼痛管理学会(American Academy of Pain Management)www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. 2010年10月4日にアクセスしました。 痛みは、個人、大切な人、そして社会を傷つける! APSの会報。 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. アメリカにおける慢性疼痛:救済への障害。 アメリカ疼痛学会。 1999. http://ampainsoc.org/links/roadblocks/index.htm. 2011年1月7日アクセス。
4.ヘルスケア・ガイドライン。 急性痛の評価と管理. 臨床システム改善研究所。 第6版。 2008年3月。www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html。 アクセス数:
2011年4月8日.
5. Lussier D、Huskey AG、Portenoy RK。 癌性疼痛管理における補助鎮痛薬。 オンコロジスト。
6.マコーミックWC、シュライナーRL. 進行したAIDSにおけるアヘン剤抵抗性疼痛の診断と治療。 ウエストJメッド。 2001;175:408-411.
7. Chizh BA、ヘッドリーPM. NMDA拮抗薬と神経障害性疼痛-複数の薬物ターゲットと複数の用途。 Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadone in the treatment of neuropathic pain.神経因性疼痛の治療におけるメタドン。 痛み Res Manag。 2003;8:149-154.
9. ベネットGJ. 痛みの伝達と調節の神経生理学の最新情報:NMDA-受容体を中心に。 J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. オピオイドによる耐性と痛覚過敏のメカニズム. Pain Manag Nursing. 2007;8:113-121.
11. ヒューイットDJ. 慢性疼痛治療におけるNMDA受容体拮抗薬の使用。 Clin J 痛み。 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. 2011年4月8日アクセス。
12. Lexicomp Online。www.lexi.com。 2011.4.12にアクセス。 Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment(痛み止め治療に関するACPA消費者ガイド)。 ロックリン、カリフォルニア州。 Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. 2011年4月8日にアクセスした
14。 Bhavani-ShankarのK、JasmeetのSO。 術後疼痛の管理。 UptoDate。 2010年5月28日。www.uptodate.com。 2011年10月4日アクセス
15。 J Pain Symptom Manage. 2000;20:246-252.
16. このような状況下において、「ケタミン」を用いた難治性がん疼痛の治療法として、39名の患者を対象とした非盲検監査を実施した。 J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD、Kral LA。 痛みの状態のためのメタドン治療。 アムファムフィジシャン。 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. がん患者における鎮痛効果と忍容性を改善するためのモルヒネからのスイッチング:前向き研究. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. 低用量メタドンは神経障害性疼痛において鎮痛効果がある:二重盲検ランダム化比較クロスオーバー試験. Palliat Med。 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. がん疼痛管理:アジュバント鎮痛薬。 UptoDate. 2010 年 5 月 28 日。www.uptodate.com. 2011年10月4日アクセス
21. ニコライセン L、ゴットラップ H、クリステンセン AG、イェンセン TS。 このような状況下で、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」を実施しました。 Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. ヒト免疫不全ウイルス関連感覚神経障害の治療に対するメマンチンのプラセボ対照試験。 J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. NMDA受容体拮抗薬アマンタジンは癌患者の外科的神経障害性疼痛を軽減する:ダブルブラインド、無作為化、プラセボ対照試験。 Pain. 1998;75:349-354.
24. 福井慎一郎、薦田祐子、野坂茂樹. 神経障害性疼痛に対するNMDA拮抗薬アマンタジンの臨床応用. J Anesth.2001;15:179-181.
25. カールソンKC、ホーエムNO、モバーグER、マティセンLC.Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. デキストロメット・オルファニンの神経障害性疼痛に対する鎮痛効果。 Acta Anaesthesiol Scand. 2004;48:328-336.