US Pharm. 2011;36(5):HS4-HS8.
On estime que 50 millions d’Américains souffrent actuellement de douleurs chroniques, ainsi que 25 autres millions qui souffrent de douleurs aiguës.1 Chaque année, près de la moitié des Américains se présentent chez leur médecin avec une plainte principale de douleur2. Le traitement principal de la douleur modérée à sévère est constitué par les analgésiques opioïdes, auxquels on ajoute d’autres analgésiques tels que les anti-inflammatoires non stéroïdiens (AINS) et d’autres traitements adjuvants, notamment les antidépresseurs tricycliques (ATC), les anticonvulsivants et les anesthésiques topiques, selon les besoins3,4. Cependant, plus de quatre personnes sur dix souffrant de douleurs modérées à sévères ne sont pas soulagées, selon une enquête de l’American Pain Society (APS) réalisée en 1999.5 Parmi les personnes qui ne sont pas soulagées, certaines peuvent ressentir une douleur qui ne répond pas aux opioïdes ou à d’autres traitements médicamenteux malgré l’utilisation appropriée de ces agents, comme dans la résistance aux opioïdes et la douleur neuropathique.
Résistance aux opioïdes et douleur neuropathique
La résistance aux opioïdes est définie comme une absence de réponse au sulfate de morphine IV d’au moins 100 mg par heure (ou à une dose équivalente d’un autre opioïde), des évaluations de la douleur constamment élevées et une douleur non soulagée même après avoir doublé la dose d’opioïde. La résistance aux opiacés a été constatée dans une multitude de maladies, notamment le cancer, la douleur chronique, la neuropathie, le syndrome complexe de la douleur régionale, la névralgie post-zostérienne et la pancréatite.6 La douleur neuropathique résulte d’une lésion des nerfs périphériques ou centraux et est généralement traitée par des agents tels que les TCA et les anticonvulsivants. Malheureusement, une majorité de patients n’éprouvent pas de soulagement significatif avec ces agents.7,8 Dans la résistance aux opiacés et la douleur neuropathique, les antagonistes du N-méthyl-d-aspartate (NMDA) peuvent être une option.
Antagonistes des récepteurs NMDA
Le NMDA est un récepteur du neurotransmetteur excitateur glutamate, qui est libéré lors de stimuli périphériques nocifs.7,9 L’activation des récepteurs NMDA a été associée à l’hyperalgésie, à la douleur neuropathique et à la réduction de la fonctionnalité des récepteurs opioïdes. L’hyperalgésie et la douleur neuropathique sont le résultat d’une sensibilisation accrue des neurones spinaux, ce qui entraîne un niveau de douleur plus élevé.7,9,10 La fonction réduite des récepteurs opioïdes est causée par une diminution de leur sensibilité. Cette diminution de la sensibilité, à son tour, se traduit par une tolérance aux opioïdes, car les patients auront besoin de doses plus élevées d’opioïdes pour obtenir les mêmes effets thérapeutiques.9 Par conséquent, les antagonistes du NMDA peuvent avoir un rôle dans ces domaines de la gestion de la douleur.10
Il existe plusieurs antagonistes du récepteur NMDA disponibles : la kétamine, la méthadone, la mémantine, l’amantadine et le dextrométhorphane (TABLEAU 1).11,12 Ils diffèrent chacun par leur niveau d’activité sur le récepteur NMDA. La kétamine est un antagoniste puissant du NMDA, alors que les autres sont des bloqueurs plus faibles des récepteurs NMDA.13 La gravité et la fréquence des effets secondaires dépendent de l’affinité pour le récepteur NMDA. Chez les adultes, les effets indésirables des antagonistes du NMDA sont principalement des effets secondaires liés au système nerveux central (SNC), notamment des hallucinations, des étourdissements, des vertiges, de la fatigue, des maux de tête, des sensations hors du corps, des cauchemars et des modifications sensorielles. Comme la kétamine est un antagoniste NMDA puissant, elle est moins tolérable que les autres antagonistes en raison d’une incidence plus élevée d’effets secondaires, notamment des hallucinations et un état mental dissociatif.7
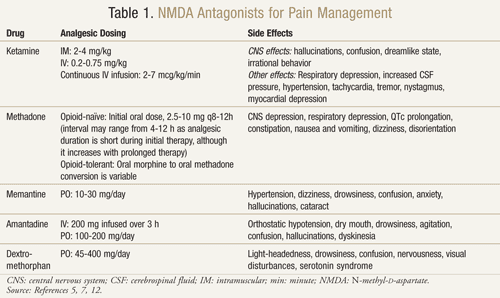
Kétamine : La kétamine s’est avérée bénéfique dans de multiples contextes de douleur. Dans un essai clinique, l’ajout d’une faible dose de kétamine IV aux opioïdes par rapport aux opioïdes seuls en postopératoire après une chirurgie abdominale majeure a produit une meilleure analgésie, moins de sédation et un besoin moindre de morphine ou d’intervention du médecin pour gérer la douleur14. Un essai randomisé, en double aveugle, croisé et contrôlé par placebo a également été mené pour confirmer les résultats précédents qui suggéraient que la kétamine était efficace chez les patients cancéreux résistants à la morphine.15 Chacun des 10 patients inscrits a reçu de la kétamine à une dose de 0,25 mg/kg, 0,50 mg/kg et un placebo sur 3 jours distincts à au moins 2 jours d’intervalle en plus de leur morphine. Les résultats ont montré que la kétamine réduisait significativement la douleur aux deux doses par rapport au placebo. Les patients recevant 0,5 mg/kg ont eu un meilleur effet analgésique que ceux recevant 0,25 mg/kg (P <.05). Des effets indésirables significatifs sont survenus chez quatre patients qui ont eu des hallucinations et chez deux patients qui ont ressenti une sensation désagréable qu’ils ont qualifiée de « tête vide ». Les patients ont reçu 1 mg de diazépam pour inverser avec succès ces effets indésirables sur le SNC. Les patients ont éprouvé une somnolence significative avec les deux doses de kétamine, bien qu’elle ait été plus prononcée à la dose de 0,5 mg/kg (P <.05).15
Dans un essai prospectif, multicentrique, sans insu et ouvert sur 39 patients, la perfusion de kétamine » en rafale » s’est avérée avoir un effet significatif sur la douleur liée au cancer chez les patients qui étaient soit résistants aux opioïdes, même avec l’ajout d’analgésiques adjuvants, soit intolérants aux effets indésirables des opioïdes.16 La kétamine en rafale a été définie comme une perfusion sous-cutanée de courte durée (3 à 5 jours), commençant par une dose initiale de 100 mg/24 h, puis augmentant à 300 mg/24 h et 500 mg/24 h de manière progressive si la douleur du patient était persistante sans effets secondaires intolérables. Le soulagement de la douleur a été analysé par type de douleur (somatique, viscérale ou neuropathique). Les patients présentant plus d’un type de douleur ont vu chacune de leurs douleurs analysée séparément. Sur 43 douleurs traitées chez 39 patients, 29 (67 %) ont présenté une diminution d’au moins 50 % sur l’échelle d’évaluation verbale (0 = aucune douleur, 10 = la pire douleur possible) soutenue par une réduction significative de la consommation d’opioïdes sur 24 heures et/ou une amélioration de la mobilité ou du statut fonctionnel. Douze patients ont rapporté des effets indésirables sur le SNC, notamment une sensation de » perte d’espace « , des hallucinations, de la somnolence et des étourdissements.16
Méthadone : La méthadone est un autre antagoniste du NMDA qui a été étudié dans la résistance aux opiacés et la douleur neuropathique. Elle s’est avérée être une bonne option à utiliser comme opioïde de remplacement chez les patients mal contrôlés ou présentant des effets indésirables limitant la dose lorsqu’ils prennent d’autres opioïdes.17 Chez 80 % des patients cancéreux présentant une douleur non contrôlée ou des effets secondaires importants, la méthadone a démontré une réduction de la douleur et des effets indésirables après un passage de la morphine à la méthadone.18
La méthadone a également démontré son efficacité chez les patients présentant une douleur neuropathique réfractaire. Lors d’un essai en double aveugle, randomisé, contrôlé et croisé mené chez 18 patients qui n’ont pas répondu aux régimes analgésiques traditionnels pour leur douleur neuropathique chronique, la méthadone orale à 10 mg deux fois par jour a montré un soulagement statistiquement significatif de la douleur en ce qui concerne l’intensité maximale de la douleur (P = 0,013), l’intensité moyenne de la douleur (P = 0,020) et le soulagement de la douleur (P = 0,015) par rapport au placebo.19 La méthadone à 5 mg deux fois par jour a également montré une amélioration analgésique en ce qui concerne l’intensité maximale de la douleur et le soulagement de la douleur ; cependant, elle n’a pas atteint la signification statistique. Six patients se sont retirés de l’étude en raison d’effets indésirables, notamment des nausées, des vomissements, des étourdissements, des sueurs et une désorientation accompagnée de graves maux de tête. D’autres qui ont terminé l’essai n’ont signalé que des effets indésirables légers à modérés.19
Gagnon et al ont mené un essai sur la méthadone dans le traitement de la douleur neuropathique chez 18 patients qui soit ne recevaient pas d’opioïdes pour leur douleur, soit recevaient une dose quotidienne d’opioïdes ne dépassant pas l’équivalent de 120 mg de morphine orale en raison d’effets secondaires qui empêchaient une augmentation supplémentaire de la dose.8 Les doses de méthadone ont été initiées entre 2 mg et 5 mg trois fois par jour selon l’âge et augmentées jusqu’à une dose stable en fonction de la réponse clinique et des effets indésirables. Une dose de 2 mg de méthadone toutes les 4 à 6 heures était autorisée en cas de percée de la douleur, selon les besoins. Les patients ont été suivis pendant une durée médiane de 106 jours (16 à 466 jours). Tous les patients ont connu une amélioration de leur score de douleur sur l’échelle visuelle analogique (EVA ; 0-10 cm, où 0 = aucune douleur et 10 = la pire douleur possible) avec le traitement à la méthadone. L’EVA moyenne avant le traitement, ± l’écart-type (ET), était de 7,7 ± 1,5 cm et a diminué à 1,4 ± 1,7 cm sous méthadone (P <.0001). Neuf patients sur 18 (50 %) n’ont ressenti aucune douleur alors qu’ils étaient sous une dose stable de méthadone. Sur les 13 patients qui présentaient une allodynie dans le cadre de leur douleur neuropathique, 9 (70 %) ont présenté une résolution complète (aucune allodynie cliniquement détectable) et 4 (30 %) une résolution partielle (allodynie dans <50 % de la surface). Sur les 8 patients qui avaient des douleurs fulgurantes, les 8 (100%) ont rapporté un contrôle des symptômes avec une dose stable de méthadone. Les effets secondaires comprenaient une légère somnolence et des nausées qui étaient transitoires, ainsi qu’une constipation qui a été résolue avec des laxatifs8.
Malheureusement, l’utilisation de la méthadone est souvent difficile en raison de sa demi-vie longue et variable d’environ 8 à 59 heures, de la surveillance ECG nécessaire pour un éventuel allongement de l’intervalle QTc et des nombreuses interactions médicamenteuses avec d’autres agents allongeant l’intervalle QTc, ainsi qu’avec les inhibiteurs du CYP3A4 et du CYP2D6.12 En outre, la conversion aux opiacés est difficile car la puissance de la méthadone augmente avec les doses de morphine. Par conséquent, il n’est pas possible de trouver un ratio unique pour une posologie équianalgésique entre la morphine et la méthadone.17
Mémantine : D’autres antagonistes des récepteurs NMDA tels que la mémantine, l’amantadine et le dextrométhorphane ont montré des résultats mitigés dans la douleur neuropathique.20 La mémantine a un profil d’effets secondaires sûr et un début d’action rapide ; cependant, dans une étude randomisée, en double aveugle et croisée où la mémantine a été administrée à un groupe de 19 patients souffrant de douleur chronique due à une lésion nerveuse après une intervention chirurgicale, il n’y a pas eu de différence dans la réduction de la douleur avec la mémantine par rapport au placebo21. En outre, une étude avec la mémantine chez des patients atteints de neuropathie sensorielle associée au VIH n’a pas montré de résultats positifs.22
Amantadine : L’amantadine est un autre médicament qui a montré des résultats mitigés dans les essais cliniques. Un essai en double aveugle, randomisé, contrôlé par placebo a été mené chez 15 patients cancéreux qui présentaient des douleurs neuropathiques chirurgicales.23 Dans un ordre aléatoire, les patients ont reçu une perfusion de 200 mg d’amantadine ou de placebo à une semaine d’intervalle. La douleur spontanée et évoquée a été mesurée 48 heures avant, pendant et après le traitement. En moyenne, on a observé une réduction de la douleur de 85 % avec l’amantadine contre 45 % avec le placebo (P = 0,009) à la fin de la perfusion. En comparant l’intensité moyenne de la douleur 48 heures avant et après le traitement, l’amantadine a permis une réduction de 31 % de la douleur (P = 0,006), alors que le placebo a montré une réduction non significative de la douleur de 6 % (P = 0,40).23
Contrairement à ces résultats positifs, Fukui et al ont mené une étude sur l’amantadine chez 19 patients qui n’avaient pas répondu aux traitements conventionnels de la douleur neuropathique, y compris les anticonvulsivants, les antidépresseurs et les blocs nerveux24. Les patients ont commencé à prendre de l’amantadine par voie orale à raison de 100 mg/jour pendant une semaine, puis leur dose a été augmentée à 200 mg/jour. Les résultats ont montré une réduction de la douleur chez seulement 2 (10,5%) des 19 patients. Des effets indésirables ont été constatés chez 52,6 % des patients, notamment une sécheresse de la bouche, une somnolence, des hallucinations, une excitation, une irritation, des vertiges, une dyskinésie et une perte de cheveux.24
Dextrométhorphane : Couramment présent dans les médicaments en vente libre contre la toux, le dextrométhorphane a également été examiné pour son utilisation dans la douleur neuropathique. Dans une étude croisée randomisée, en double aveugle, contrôlée par placebo, 15 patients souffrant de douleurs neuropathiques ont reçu 270 mg de dextrométhorphane et un placebo dans un ordre aléatoire, séparés par une période d’élimination d’une semaine.25 Les résultats ont montré une réduction de 30% de la douleur après une seule dose de dextrométhorphane par rapport au placebo. Les résultats ont montré une réduction de 30 % de la douleur après une dose unique de dextrométhorphane par rapport au placebo. Après 1,5 heure et 2,5 à 4 heures à partir de la prise du médicament, il y avait une différence statistiquement significative dans la réduction de la douleur du dextrométhorphane par rapport au placebo (P <.05 et P <.002, respectivement). Les effets secondaires comprenaient des étourdissements, de la somnolence, des troubles visuels et des bouffées de chaleur ; aucun n’était grave.25
Comme le dextrométhorphane est métabolisé par le CYP2D6 en un métabolite actif, le dextrométhorphane, on a également comparé les métaboliseurs importants aux métaboliseurs faibles. Les patients qui étaient des métaboliseurs extensifs du dextrométhorphane ont connu une meilleure analgésie que les métaboliseurs faibles. Il a été conclu que le dextrométhorphane a un potentiel dans le traitement de la douleur neuropathique, mais des études plus approfondies sont nécessaires pour valider son utilisation.25
Rôle du pharmacien
Les pharmaciens peuvent influencer grandement les soins aux patients chez les personnes qui ne reçoivent pas un soulagement adéquat de la douleur en raison de la résistance aux opioïdes et de la douleur neuropathique qui n’est pas contrôlée adéquatement par les agents couramment utilisés, en comprenant le rôle actuel des antagonistes du NMDA. Comme la méthadone est actuellement très prometteuse dans ce domaine, il est important que les pharmaciens comprennent comment faciliter l’utilisation sûre de cet agent en ce qui concerne le dosage approprié, les interactions médicamenteuses et la surveillance des effets indésirables.
Conclusion
Les antagonistes de la NMDA sont une excellente piste à explorer dans le traitement des douleurs neuropathiques et résistantes aux opiacés. Les antagonistes du NMDA qui ont actuellement été testés comprennent la kétamine, la méthadone, la mémantine, l’amantadine et le dextrométhorphane. Les essais cliniques réalisés jusqu’à présent ont démontré l’intérêt de la kétamine et de la méthadone dans la réduction de la douleur neuropathique et de la douleur résistante aux opiacés. Cependant, les effets indésirables sur le SNC sont préoccupants, surtout avec la kétamine. La mémantine, l’amantadine et le dextrométhorphane sont des antagonistes du NMDA plus faibles avec un profil de toxicité plus sûr, mais ils n’ont pas montré de bénéfice constant dans ces contextes de douleur.12 D’autres études sur les antagonistes du NMDA sont nécessaires pour déterminer leur meilleure utilisation dans la gestion de la douleur ainsi que pour gérer efficacement leurs effets secondaires.
1. Weiner K. Questions relatives à la douleur. La douleur est une épidémie. Académie américaine de gestion de la douleur. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Consulté le 4 octobre 2010.
2. Turk DC. La douleur fait mal – aux individus, aux proches et à la société ! APS Bulletin. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Consulté le 4 octobre 2010.
3. Chronic pain in America : roadblocks to relief. Société américaine de la douleur. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Consulté le 7 janvier 2011.
4. Lignes directrices en matière de soins de santé : Évaluation et prise en charge de la douleur aiguë. Institut pour l’amélioration des systèmes cliniques. 6e éd. Mars 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Consulté le
8 avril 2011.
5. Lussier D, Huskey AG, Portenoy RK. Les analgésiques adjuvants dans la prise en charge de la douleur cancéreuse. Oncologue.
6. McCormick WC, Schreiner RL. Diagnostic et traitement de la douleur résistante aux opiacés dans le sida avancé. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. Les antagonistes du NMDA et la douleur neuropathique – de multiples cibles médicamenteuses et de multiples utilisations. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadone in the treatment of neuropathic pain. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Mise à jour sur la neurophysiologie de la transmission et de la modulation de la douleur : accent sur le récepteur NMDA. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Mechanisms of opioid-induced tolerance and hyperalgesia. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. L’utilisation des antagonistes des récepteurs NMDA dans le traitement de la douleur chronique. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Consulté le 8 avril 2011.
12. Lexicomp Online. www.lexi.com. Consulté le 12 avril 2011.
13. Feinberg S, Provenzano D. Guide du consommateur de l’ACPA sur le traitement des médicaments contre la douleur &. Rocklin, CA : American Chronic Pain Association Inc ; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Consulté le 8 avril 2011.
14. Bhavani-Shankar K, Jasmeet SO. Prise en charge de la douleur postopératoire. UptoDate. 28 mai 2010. www.uptodate.com. Consulté le 4 octobre 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgesic effect of intravenous ketamine in cancer patients on morphine therapy : a randomized, controlled, double-blind, crossover, double-dose study. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. « Burst » ketamine for refractory cancer pain : an open-label audit of 39 Patients. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Traitement à la méthadone pour les états douloureux. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Switching from morphine to improve analgesia and tolerability in cancer patients : a prospective study. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. La méthadone à faible dose a un effet analgésique dans la douleur neuropathique : un essai croisé randomisé en double aveugle. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Prise en charge de la douleur cancéreuse : analgésiques adjuvants. UptoDate. 28 mai 2010. www.uptodate.com. Consulté le 4 octobre 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. La mémantine (un antagoniste des récepteurs du N-méthyl-d-aspartate) dans le traitement de la douleur neuropathique après une amputation ou une intervention chirurgicale : une étude randomisée, en double aveugle et croisée. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. Une étude contrôlée par placebo de la mémantine pour le traitement de la neuropathie sensorielle associée au virus de l’immunodéficience humaine. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. L’amantadine, un antagoniste des récepteurs NMDA, réduit la douleur neuropathique chirurgicale chez les patients atteints de cancer : un essai en double aveugle, randomisé, contrôlé par placebo. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Application clinique de l’amantadine, un antagoniste du NMDA, pour la douleur neuropathique. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Effet analgésique de la dextrometh-orphanine douleur neuropathique. Acta Anaesthesiol Scand. 2004;48:328-336.