US Pharm. 2011;36(5):HS4-HS8.
Schätzungsweise 50 Millionen Amerikaner leiden derzeit an chronischen Schmerzen und weitere 25 Millionen an akuten Schmerzen.1 Jedes Jahr sucht fast die Hälfte aller Amerikaner ihren Arzt mit einer Hauptbeschwerde auf, nämlich Schmerzen.2 Die Hauptstütze der Behandlung von mäßigen bis starken Schmerzen sind Opioid-Analgetika, die bei Bedarf durch andere Analgetika wie nichtsteroidale Antirheumatika (NSAIDs) und andere unterstützende Therapien wie trizyklische Antidepressiva (TCAs), Antikonvulsiva und topische Anästhetika ergänzt werden.3,4 Laut einer Umfrage der American Pain Society (APS) aus dem Jahr 1999 erhalten jedoch mehr als vier von zehn Menschen mit mäßigen bis starken Schmerzen keine Schmerzlinderung.5 Bei einigen derjenigen, die keine Schmerzlinderung erhalten, kann es sein, dass ihre Schmerzen trotz angemessener Anwendung von Opioiden oder anderen medikamentösen Therapien nicht darauf ansprechen, wie bei Opioidresistenz und neuropathischen Schmerzen.
Opioidresistenz und neuropathische Schmerzen
Opioidresistenz ist definiert als Unansprechbarkeit auf intravenöses Morphinsulfat von mindestens 100 mg pro Stunde (oder eine gleichwertige Dosierung eines anderen Opioids), gleichbleibend hohe Schmerzwerte und nicht gelinderte Schmerzen selbst nach Verdoppelung der Opioiddosis. Eine Opioidresistenz wurde bei einer Vielzahl von Krankheiten festgestellt, darunter Krebs, chronische Schmerzen, Neuropathie, komplexes regionales Schmerzsyndrom, postherpetische Neuralgie und Pankreatitis.6 Neuropathische Schmerzen entstehen durch eine Verletzung peripherer oder zentraler Nerven und werden in der Regel mit Wirkstoffen wie TCAs und Antikonvulsiva behandelt. Leider erfahren die meisten Patienten mit diesen Mitteln keine signifikante Linderung.7,8 Sowohl bei Opioidresistenz als auch bei neuropathischen Schmerzen können N-Methyl-d-Aspartat-(NMDA)-Antagonisten eine Option sein.
NMDA-Rezeptorantagonisten
NMDA ist ein Rezeptor für den exzitatorischen Neurotransmitter Glutamat, der bei schädlichen peripheren Reizen freigesetzt wird.7,9 Die Aktivierung von NMDA-Rezeptoren wurde mit Hyperalgesie, neuropathischen Schmerzen und einer verminderten Funktionalität von Opioidrezeptoren in Verbindung gebracht. Hyperalgesie und neuropathische Schmerzen sind das Ergebnis einer verstärkten Sensibilisierung der Rückenmarksneuronen, die zu einem erhöhten Schmerzniveau führt.7,9,10 Die verminderte Funktion der Opioidrezeptoren wird durch eine Abnahme der Empfindlichkeit der Opioidrezeptoren verursacht. Diese verringerte Empfindlichkeit führt wiederum zu einer Opioidtoleranz, da die Patienten höhere Opioiddosen benötigen, um die gleiche therapeutische Wirkung zu erzielen.9 Daher können NMDA-Antagonisten in diesen Bereichen der Schmerzbehandlung eine Rolle spielen.10
Es gibt mehrere NMDA-Rezeptor-Antagonisten: Ketamin, Methadon, Memantin, Amantadin und Dextromethorphan (TABELLE 1).11,12 Sie unterscheiden sich alle in ihrem Aktivitätsgrad am NMDA-Rezeptor. Ketamin ist ein starker NMDA-Antagonist, während die anderen schwächere NMDA-Rezeptorblocker sind.13 Schwere und Häufigkeit der Nebenwirkungen hängen von der Affinität zum NMDA-Rezeptor ab. Bei Erwachsenen sind die unerwünschten Wirkungen von NMDA-Antagonisten hauptsächlich Nebenwirkungen des zentralen Nervensystems (ZNS) wie Halluzinationen, Benommenheit, Schwindel, Müdigkeit, Kopfschmerzen, außerkörperliche Empfindungen, Albträume und sensorische Veränderungen. Da Ketamin ein starker NMDA-Antagonist ist, ist es weniger gut verträglich als die anderen Antagonisten, da es häufiger zu Nebenwirkungen kommt, insbesondere zu Halluzinationen und einem dissoziativen Geisteszustand.7
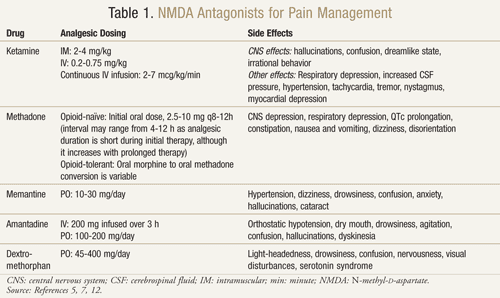
Ketamin: Ketamin hat sich in verschiedenen Schmerzsituationen als nützlich erwiesen. In einer klinischen Studie führte die Zugabe von niedrig dosiertem intravenösem Ketamin zu Opioiden im Vergleich zu Opioiden allein postoperativ nach einer größeren Bauchoperation zu einer besseren Analgesie, einer geringeren Sedierung und einem geringeren Bedarf an Morphin oder ärztlichen Maßnahmen zur Schmerzbehandlung.14 Eine randomisierte, doppelblinde, placebokontrollierte Crossover-Studie wurde ebenfalls durchgeführt, um frühere Ergebnisse zu bestätigen, die darauf hindeuteten, dass Ketamin bei Krebspatienten, die gegen Morphin resistent sind, wirksam ist.15 Jeder der 10 teilnehmenden Patienten erhielt an drei verschiedenen Tagen im Abstand von mindestens zwei Tagen zusätzlich zu seinem Morphin Ketamin in einer Dosis von 0,25 mg/kg, 0,50 mg/kg oder Placebo. Die Ergebnisse zeigten, dass Ketamin in beiden Dosierungen die Schmerzen im Vergleich zu Placebo deutlich reduzierte. Patienten, die 0,5 mg/kg erhielten, hatten eine bessere schmerzlindernde Wirkung als Patienten, die 0,25 mg/kg erhielten (P <.05). Signifikante unerwünschte Wirkungen traten bei vier Patienten auf, die Halluzinationen hatten, und bei zwei Patienten, die ein unangenehmes Gefühl empfanden, das sie als „leeren Kopf“ bezeichneten. Die Patienten erhielten Diazepam 1 mg, um diese ZNS-Nebenwirkungen erfolgreich zu beseitigen. Bei beiden Ketamindosen traten bei den Patienten erhebliche Schläfrigkeitserscheinungen auf, die jedoch bei der Dosis von 0,5 mg/kg am stärksten ausgeprägt waren (P <.05).15
In einer prospektiven, multizentrischen, unverblindeten, offenen Studie mit 39 Patienten wurde gezeigt, dass die „Burst“-Ketamininfusion eine signifikante Wirkung auf krebsbedingte Schmerzen bei Patienten hat, die entweder selbst unter Zugabe von Hilfsanalgetika opioidresistent waren oder die die unerwünschten Wirkungen von Opioiden nicht tolerierten.16 Burst-Ketamin wurde definiert als eine subkutane Infusion über einen kurzen Zeitraum (3-5 Tage), beginnend mit einer Anfangsdosis von 100 mg/24 h, die dann schrittweise auf 300 mg/24 h und 500 mg/24 h erhöht wurde, wenn die Schmerzen des Patienten ohne unerträgliche Nebenwirkungen anhielten. Die Schmerzlinderung wurde nach Art der Schmerzen (somatisch, viszeral oder neuropathisch) analysiert. Bei Patienten mit mehr als einem Schmerztyp wurde jeder einzelne Schmerz separat analysiert. Von 43 behandelten Schmerzen bei 39 Patienten zeigten 29 (67 %) eine mindestens 50-prozentige Verringerung auf der verbalen Bewertungsskala (0 = keine Schmerzen, 10 = schlimmstmögliche Schmerzen), unterstützt durch eine signifikante Verringerung des Opioidverbrauchs über 24 Stunden und/oder eine verbesserte Mobilität oder einen verbesserten Funktionsstatus. Zwölf Patienten berichteten über unerwünschte Wirkungen auf das ZNS, darunter das Gefühl, „weggetreten“ zu sein, Halluzinationen, Schläfrigkeit und Schwindel.16
Methadon: Methadon ist ein weiterer NMDA-Antagonist, der bei Opioidresistenz und neuropathischen Schmerzen untersucht wurde. Es hat sich als eine gute Option für den Einsatz als Opioid-Ersatz bei Patienten erwiesen, die schlecht kontrolliert sind oder bei denen dosislimitierende Nebenwirkungen auftreten, während sie andere Opioide einnehmen.17 Bei 80 % der Krebspatienten mit unkontrollierten Schmerzen oder erheblichen Nebenwirkungen hat Methadon nach einer Umstellung von Morphin auf Methadon eine Verringerung der Schmerzen und der unerwünschten Wirkungen gezeigt.18
Methadon hat auch seine Wirksamkeit bei Patienten mit refraktären neuropathischen Schmerzen bewiesen. In einer doppelblinden, randomisierten, kontrollierten Crossover-Studie, die mit 18 Patienten durchgeführt wurde, die auf herkömmliche Analgetika zur Behandlung ihrer chronischen neuropathischen Schmerzen nicht ansprachen, führte die zweimal tägliche Gabe von 10 mg Methadon im Vergleich zu Placebo zu einer statistisch signifikanten Schmerzlinderung in Bezug auf die maximale Schmerzintensität (P = 0,013), die durchschnittliche Schmerzintensität (P = 0,020) und die Schmerzlinderung (P = 0,015).19 Methadon in einer Dosierung von zweimal täglich 5 mg führte ebenfalls zu einer analgetischen Verbesserung der maximalen Schmerzintensität und der Schmerzlinderung, erreichte jedoch keine statistische Signifikanz. Sechs Patienten brachen die Studie wegen unerwünschter Ereignisse wie Übelkeit, Erbrechen, Schwindel, Schwitzen und Desorientierung mit starken Kopfschmerzen ab. Andere, die die Studie abschlossen, berichteten nur über leichte bis mäßige Nebenwirkungen.19
Gagnon et al. führten eine Studie mit Methadon zur Behandlung neuropathischer Schmerzen bei 18 Patienten durch, die entweder keine Opioide gegen ihre Schmerzen erhielten oder eine Tagesdosis von Opioiden erhielten, die nicht höher war als ein Äquivalent von 120 mg oralem Morphin, da die Nebenwirkungen eine weitere Dosiserhöhung verhinderten.8 Die Methadondosis wurde je nach Alter mit 2 mg bis 5 mg dreimal täglich begonnen und je nach klinischem Ansprechen und Nebenwirkungen auf eine stabile Dosis hochtitriert. Bei Durchbruchsschmerzen waren je nach Bedarf 2 mg Methadon alle 4 bis 6 Stunden erlaubt. Die Patienten wurden im Median 106 Tage lang beobachtet (16 bis 466 Tage). Bei allen Patienten kam es unter der Methadonbehandlung zu einer Verbesserung der Schmerzwerte auf der visuellen Analogskala (VAS; 0-10 cm, wobei 0 = keine Schmerzen und 10 = schlimmstmögliche Schmerzen). Die durchschnittliche VAS ± Standardabweichung (SD) betrug vor der Behandlung 7,7 ± 1,5 cm und sank unter Methadon auf 1,4 ± 1,7 cm (P <.0001). Neun von 18 Patienten (50 %) hatten unter einer stabilen Methadon-Dosis überhaupt keine Schmerzen. Von den 13 Patienten, die Allodynie als Teil ihrer neuropathischen Schmerzen hatten, zeigten 9 (70 %) eine vollständige Auflösung (keine klinisch nachweisbare Allodynie) und 4 (30 %) eine teilweise Auflösung (Allodynie in <50 % der Oberfläche). Von den 8 Patienten, die an stechenden Schmerzen litten, berichteten alle 8 (100 %) über eine Symptomkontrolle bei einer stabilen Methadondosis. Zu den Nebenwirkungen gehörten leichte Schläfrigkeit und Übelkeit, die vorübergehend auftraten, sowie Verstopfung, die mit Abführmitteln behoben werden konnte.8
Leider ist Methadon aufgrund seiner langen und variablen Halbwertszeit von etwa 8 bis 59 Stunden, der erforderlichen EKG-Überwachung auf eine mögliche QTc-Verlängerung und der zahlreichen Wechselwirkungen mit anderen QTc-verlängernden Wirkstoffen sowie CYP3A4- und CYP2D6-Inhibitoren oft schwierig anzuwenden.12 Darüber hinaus ist die Umstellung auf andere Opioide schwierig, da die Potenz von Methadon mit steigender Morphindosis zunimmt. Daher kann kein einheitliches Verhältnis für eine äquianalgetische Dosierung von Morphin und Methadon gefunden werden.17
Memantin: Andere NMDA-Rezeptor-Antagonisten wie Memantin, Amantadin und Dextromethorphan haben bei neuropathischen Schmerzen gemischte Ergebnisse gezeigt.20 Memantin hat ein sicheres Nebenwirkungsprofil und einen schnellen Wirkungseintritt; in einer randomisierten, doppelblinden Crossover-Studie, in der Memantin einer Gruppe von 19 Patienten mit chronischen Schmerzen aufgrund von Nervenverletzungen nach einer Operation verabreicht wurde, gab es jedoch keinen Unterschied in der Schmerzreduktion mit Memantin gegenüber Placebo.21 Darüber hinaus zeigte eine Studie mit Memantin bei Patienten mit HIV-assoziierter sensorischer Neuropathie keine positiven Ergebnisse.22
Amantadin: Amantadin ist ein weiteres Medikament, das in klinischen Studien gemischte Ergebnisse gezeigt hat. Eine doppelblinde, randomisierte, placebokontrollierte Studie wurde mit 15 Krebspatienten durchgeführt, die an chirurgischen neuropathischen Schmerzen litten.23 In randomisierter Reihenfolge erhielten die Patienten im Abstand von einer Woche eine 200-mg-Infusion von Amantadin oder Placebo. Spontane und evozierte Schmerzen wurden 48 Stunden vor, während und nach der Behandlung gemessen. Amantadin führte zu einer durchschnittlichen Schmerzreduktion von 85 % gegenüber 45 % bei Placebo (P = .009) am Ende der Infusion. Beim Vergleich der durchschnittlichen Schmerzintensität 48 Stunden vor und nach der Behandlung ergab sich unter Amantadin eine 31%ige Schmerzreduktion (P = .006), während das Placebo eine unbedeutende Schmerzreduktion von 6% (P = .40) aufwies.23
Im Gegensatz zu diesen positiven Ergebnissen führten Fukui et al. eine Studie mit Amantadin bei 19 Patienten durch, die auf die herkömmlichen Behandlungen für neuropathische Schmerzen, einschließlich Antikonvulsiva, Antidepressiva und Nervenblockaden, nicht ansprachen.24 Die Patienten erhielten zunächst eine Woche lang oral 100 mg/Tag Amantadin und wurden dann auf 200 mg/Tag titriert. Die Ergebnisse zeigten nur bei 2 (10,5 %) der 19 Patienten eine Schmerzlinderung. Unerwünschte Wirkungen traten bei 52,6 % der Patienten auf, darunter Mundtrockenheit, Schläfrigkeit, Halluzinationen, Erregung, Reizung, Schwindel, Dyskinesie und Haarausfall.24
Dextromethorphan: Dextromethorphan, das häufig in rezeptfreien Hustenmitteln enthalten ist, wurde auch auf seine Verwendung bei neuropathischen Schmerzen untersucht. In einer placebokontrollierten, doppelblinden, randomisierten Crossover-Studie erhielten 15 Patienten mit neuropathischen Schmerzen 270 mg Dextromethorphan und Placebo in zufälliger Reihenfolge, getrennt durch eine einwöchige Auswaschphase.25 Die Ergebnisse zeigten eine 30-prozentige Verringerung der Schmerzen nach einer einzigen Dextromethorphan-Dosis im Vergleich zu Placebo. Nach 1,5 Stunden und 2,5 bis 4 Stunden ab dem Zeitpunkt der Verabreichung bestand ein statistisch signifikanter Unterschied in der Schmerzlinderung von Dextromethorphan gegenüber Placebo (P <.05 bzw. P <.002). Zu den Nebenwirkungen gehörten Benommenheit, Schläfrigkeit, Sehstörungen und Hitzewallungen; keine davon war schwerwiegend.25
Da Dextromethorphan über CYP2D6 zu dem aktiven Metaboliten Dextrorphan verstoffwechselt wird, wurden auch Patienten mit extensivem bzw. schlechtem Metabolismus verglichen. Patienten, die Dextromethorphan gut verstoffwechseln, zeigten eine bessere Analgesie als Patienten, die Dextromethorphan schlecht verstoffwechseln. Man kam zu dem Schluss, dass Dextromethorphan ein Potenzial für die Behandlung neuropathischer Schmerzen hat, dass aber umfangreichere Studien erforderlich sind, um seine Verwendung zu validieren.25
Rolle des Apothekers
Apotheker können die Patientenversorgung bei Personen, die aufgrund von Opioidresistenz und neuropathischen Schmerzen, die durch die üblichen Mittel nicht ausreichend kontrolliert werden, keine angemessene Schmerzlinderung erhalten, erheblich beeinflussen, indem sie die derzeitige Rolle von NMDA-Antagonisten verstehen. Da Methadon in diesem Bereich derzeit sehr vielversprechend ist, ist es wichtig, dass Apotheker wissen, wie sie die sichere Anwendung dieses Mittels im Hinblick auf die richtige Dosierung, Wechselwirkungen mit anderen Medikamenten und die Überwachung unerwünschter Wirkungen erleichtern können.
Schlussfolgerung
NMDA-Antagonisten sind ein vielversprechender Ansatzpunkt für die Behandlung von opioidresistenten und neuropathischen Schmerzen. Zu den NMDA-Antagonisten, die derzeit getestet werden, gehören Ketamin, Methadon, Memantin, Amantadin und Dextromethorphan. Die bisherigen klinischen Studien haben den Wert von Ketamin und Methadon bei der Linderung neuropathischer Schmerzen und opioidresistenter Schmerzen gezeigt. Allerdings sind die unerwünschten Wirkungen auf das ZNS bedenklich, insbesondere bei Ketamin. Memantin, Amantadin und Dextromethorphan sind schwächere NMDA-Antagonisten mit einem sichereren Toxizitätsprofil, haben aber keinen konsistenten Nutzen in diesen Schmerzsituationen gezeigt.12 Es sind weitere Studien zu NMDA-Antagonisten erforderlich, um ihren besten Einsatz in der Schmerzbehandlung zu bestimmen und ihre Nebenwirkungen wirksam zu kontrollieren.
1. Weiner K. Schmerzprobleme. Pain is an epidemic. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Zugriff am 4. Oktober 2010.
2. Turk DC. Schmerz tut weh – dem Einzelnen, den Bezugspersonen und der Gesellschaft! APS Bulletin. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Zugriff am 4. Oktober 2010.
3. Chronische Schmerzen in Amerika: Hindernisse auf dem Weg zur Linderung. American Pain Society. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Accessed January 7, 2011.
4. Health Care Guidelines: Assessment and Management of Acute Pain. Institute For Clinical Systems Improvement. 6th ed. March 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Zugriff
April 8, 2011.
5. Lussier D, Huskey AG, Portenoy RK. Adjuvante Analgetika bei der Behandlung von Krebsschmerzen. Oncologist.
6. McCormick WC, Schreiner RL. Diagnose und Behandlung von opiatresistenten Schmerzen bei fortgeschrittenem AIDS. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. NMDA-Antagonisten und neuropathische Schmerzen – mehrere Angriffspunkte für Medikamente und vielfältige Einsatzmöglichkeiten. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadone in the treatment of neuropathic pain. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Aktuelles zur Neurophysiologie der Schmerzübertragung und -modulation: Schwerpunkt auf dem NMDA-Rezeptor. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Mechanisms of opioid-induced tolerance and hyperalgesia. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. Der Einsatz von NMDA-Rezeptorantagonisten bei der Behandlung chronischer Schmerzen. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Accessed April 8, 2011.
12. Lexicomp Online. www.lexi.com. Accessed April 12, 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Accessed April 8, 2011.
14. Bhavani-Shankar K, Jasmeet SO. Management of postoperative pain. UptoDate. May 28, 2010. www.uptodate.com. Accessed October 4, 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgetische Wirkung von intravenösem Ketamin bei Krebspatienten unter Morphintherapie: eine randomisierte, kontrollierte, doppelblinde, gekreuzte Studie mit doppelter Dosierung. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. „Burst“ Ketamin für refraktäre Krebsschmerzen: eine offene Prüfung von 39 Patienten. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Methadonbehandlung bei Schmerzzuständen. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Switching from morphine to improve analgesia and tolerability in cancer patients: a prospective study. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Low-dose methadone has an analgesic effect in neuropathic pain: a double-blind randomized controlled crossover trial. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Krebsschmerzbehandlung: adjuvante Analgetika. UptoDate. May 28, 2010. www.uptodate.com. Accessed October 4, 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantine (ein N-Methyl-d-Aspartat-Rezeptor-Antagonist) in der Behandlung von neuropathischen Schmerzen nach Amputation oder Operation: eine randomisierte, doppelblinde Cross-over-Studie. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. A placebo-controlled study of memantine for the treatment of human immunodeficiency virus-associated sensory neuropathy. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. Der NMDA-Rezeptor-Antagonist Amantadin reduziert chirurgische neuropathische Schmerzen bei Krebspatienten: eine doppelblinde, randomisierte, placebokontrollierte Studie. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Klinische Anwendung von Amantadin, einem NMDA-Antagonisten, bei neuropathischen Schmerzen. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Analgetische Wirkung von Dextrometh-orphanin bei neuropathischen Schmerzen. Acta Anaesthesiol Scand. 2004;48:328-336.