US Pharm. 2011;36(5):HS4-HS8.
För närvarande lider uppskattningsvis 50 miljoner amerikaner av kronisk smärta, tillsammans med ytterligare 25 miljoner som lider av akut smärta.1 Varje år kommer nästan hälften av alla amerikaner till sin läkare med ett huvudklagomål om smärta.2 Huvuddelen av behandlingen av måttlig till svår smärta är opioidanalgetika, med tillägg av andra analgetika som icke-steroida antiinflammatoriska läkemedel (NSAID) och andra stödjande terapier, inklusive tricykliska antidepressiva medel (TCA), antikonvulsiva medel och topiska anestetika vid behov.3,4 Mer än fyra av tio personer med måttlig till svår smärta får dock ingen lindring, enligt en undersökning från American Pain Society (APS) som genomfördes 1999.5 Av dem som inte får smärtlindring kan en del uppleva smärta som inte reagerar på opioider eller andra läkemedelsterapier trots lämplig användning av dessa medel, som vid opioidresistens och neuropatisk smärta.
Opioidresistens och neuropatisk smärta
Opioidresistens definieras som icke-svarighet för intravenöst morfinsulfat på minst 100 mg per timme (eller motsvarande dosering av en annan opioid), genomgående höga smärtskattningar och obesvärad smärta även efter att opioiddosen fördubblats. Opioidresistens har konstaterats i en mängd olika sjukdomstillstånd, bland annat cancer, kronisk smärta, neuropati, komplext regionalt smärtsyndrom, postherpetisk neuralgi och pankreatit.6 Neuropatisk smärta beror på skador på perifera eller centrala nerver och behandlas vanligen med medel som TCA och antikonvulsiva medel. Tyvärr upplever majoriteten av patienterna inte någon betydande lindring med dessa medel.7,8 Vid både opioidresistens och neuropatisk smärta kan N-metyl-d-aspartat (NMDA)-antagonister vara ett alternativ.
NMDA-receptorantagonister
NMDA är en receptor för den excitatoriska neurotransmittorn glutamat, som frisätts vid skadliga perifera stimuli.7,9 Aktiveringen av NMDA-receptorer har förknippats med hyperalgesi, neuropatisk smärta och minskad funktionalitet hos opioidreceptorer. Hyperalgesi och neuropatisk smärta är ett resultat av ökad sensibilisering av ryggmärgsneuronerna, vilket leder till en förhöjd smärtnivå.7,9,10 Opioidreceptorernas minskade funktion orsakas av en minskad känslighet hos opioidreceptorerna. Denna minskade känslighet leder i sin tur till opioidtolerans eftersom patienterna behöver högre doser opioider för att uppnå samma terapeutiska effekter.9 Därför kan NMDA-antagonister ha en roll inom dessa områden av smärtbehandlingen.10
Det finns flera NMDA-receptorantagonister att tillgå: ketamin, metadon, memantin, amantadin och dextrometorfan (TABELL 1).11,12 De skiljer sig var och en åt i sin aktivitetsnivå på NMDA-receptorn. Ketamin är en stark NMDA-antagonist, medan de andra är svagare NMDA-receptorblockerare.13 Svårighetsgraden och frekvensen av biverkningar beror på affiniteten för NMDA-receptorn. Hos vuxna är biverkningarna av NMDA-antagonister huvudsakligen biverkningar från centrala nervsystemet (CNS), inklusive hallucinationer, yrsel, yrsel, trötthet, huvudvärk, känslor utanför kroppen, mardrömmar och känselförändringar. Eftersom ketamin är en stark NMDA-antagonist är det mindre tolerabelt än de andra antagonisterna på grund av en högre förekomst av biverkningar, särskilt hallucinationer och ett dissociativt mentalt tillstånd.7
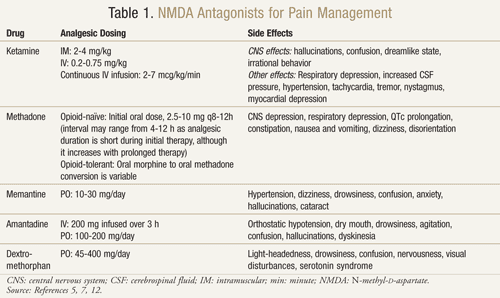
Ketamin: Ketamin har visat sig vara fördelaktigt i flera olika smärtsituationer. I en klinisk prövning gav tillägg av lågdos IV ketamin till opioider jämfört med enbart opioider postoperativt efter större bukkirurgi bättre analgesi, mindre sedering och minskat behov av morfin eller läkarintervention för att hantera smärta14 . En randomiserad, dubbelblind, crossover, placebokontrollerad studie genomfördes också för att bekräfta tidigare resultat som tydde på att ketamin var effektivt hos cancerpatienter som var resistenta mot morfin.15 Var och en av de 10 inskrivna patienterna fick ketamin i dosen 0,25 mg/kg, 0,50 mg/kg och placebo på 3 separata dagar med minst 2 dagars mellanrum utöver sitt morfin. Resultaten visade att ketamin minskade smärtan signifikant i båda doserna jämfört med placebo. Patienter som fick 0,5 mg/kg hade en bättre analgetisk effekt än patienter som fick 0,25 mg/kg (P <.05). Betydande biverkningar inträffade hos fyra patienter som upplevde hallucinationer och två patienter som upplevde en obehaglig känsla som de refererade till som ”tomt huvud”. Patienterna fick diazepam 1 mg för en framgångsrik reversering av dessa CNS-biverkningar. Patienterna upplevde betydande sömnighet med båda ketamindoserna, även om den var mest uttalad vid dosen 0,5 mg/kg (P <.05).15
I en prospektiv, multicenter, oblindad, öppen prövning med 39 patienter visade sig ”burst”-ketamininfusionen ha en signifikant effekt på cancerrelaterad smärta hos patienter som antingen var opioidresistenta även med tillsats av adjuvanta smärtstillande medel eller intoleranta mot opioidernas biverkningar.16 Burst ketamin definierades som en kortvarig (3-5 dagar) subkutan infusion, som inleddes med en initial dos på 100 mg/24 h och sedan trappades upp till 300 mg/24 h och 500 mg/24 h stegvis om patientens smärta var ihållande utan intolerabla biverkningar. Smärtlindringen analyserades efter typ av smärta (somatisk, visceral eller neuropatisk). De patienter som hade mer än en smärttyp fick var och en av sina smärtor analyserade separat. Av 43 smärtor som behandlades hos 39 patienter uppvisade 29 (67 %) en minskning med minst 50 % på den verbala skattningsskalan (0 = ingen smärta, 10 = värsta möjliga smärta) som stöddes av en signifikant minskning av opioidanvändningen under 24 timmar och/eller förbättrad rörlighet eller funktionell status. Tolv patienter rapporterade biverkningar av CNS, bland annat att de kände sig ”utspridda”, hallucinationer, sömnighet och yrsel.16
Metadon: Metadon är en annan NMDA-antagonist som har studerats vid opioidresistens och neuropatisk smärta. Det har visat sig vara ett bra alternativ att använda som ersättningsopioid hos patienter som är dåligt kontrollerade eller upplever dosbegränsande biverkningar när de står på andra opioider.17 Hos 80 % av cancerpatienter med okontrollerad smärta eller betydande biverkningar har metadon visat en minskning av smärta och biverkningar efter en övergång från morfin till metadon.18
Metadon har också visat sig vara effektivt hos patienter med refraktär neuropatisk smärta. I en dubbelblind, randomiserad, kontrollerad, crossover-studie som genomfördes på 18 patienter som inte svarade på traditionella analgetiska regimer för sin kroniska neuropatiska smärta, visade 10 mg två gånger dagligen oralt metadon statistiskt signifikant smärtlindring i maximal smärtintensitet (P = 0,013), genomsnittlig smärtintensitet (P = 0,020) och smärtlindring (P = 0,015) jämfört med placebo.19 Metadon med 5 mg två gånger dagligen visade också en analgetisk förbättring av maximal smärtintensitet och smärtlindring, men nådde dock inte statistisk signifikans. Sex patienter drog sig ur studien på grund av biverkningar inklusive illamående, kräkningar, yrsel, svettning och desorientering med svår huvudvärk. Andra som fullföljde studien rapporterade endast att de hade milda till måttliga biverkningar.19
Gagnon et al genomförde en studie av metadon vid behandling av neuropatisk smärta hos 18 patienter som antingen inte fick opioider för sin smärta eller fick en daglig dos opioider som inte var högre än motsvarande 120 mg oralt morfin på grund av biverkningar som förhindrade ytterligare doseskalering.8 Metadondoserna startades mellan 2 mg och 5 mg tre gånger dagligen beroende på ålder och titrerades upp till en stabil dos baserat på kliniskt svar och biverkningar. Metadon 2 mg var fjärde till sjätte timme tilläts för genombrottssmärta vid behov. Patienterna följdes i median 106 dagar (16 till 466 dagar). Alla patienter upplevde en förbättring av sina smärtpoäng på den visuella analoga skalan (VAS; 0-10 cm, där 0 = ingen smärta och 10 = värsta möjliga smärta) med metadonbehandlingen. Den genomsnittliga VAS ± standardavvikelsen (SD) före behandling var 7,7 ± 1,5 cm och minskade till 1,4 ± 1,7 cm när de fick metadon (P <.0001). Nio av 18 (50 %) hade ingen smärta alls när de stod på en stabil dos metadon. Av de 13 patienter som hade allodyni som en del av sin neuropatiska smärta uppvisade 9 (70 %) fullständig upplösning (ingen kliniskt påvisbar allodyni) och 4 (30 %) hade partiell upplösning (allodyni i <50 % av ytan). Av de 8 patienter som hade skjutande smärta rapporterade alla 8 (100 %) symtomkontroll på en stabil metadondos. Biverkningar omfattade mild sömnighet och illamående som var övergående, tillsammans med förstoppning som löstes med laxermedel.8
Tyvärr är metadon ofta en utmaning att använda med tanke på dess långa och varierande halveringstid på cirka 8 till 59 timmar, den nödvändiga EKG-övervakningen för eventuell QTc-förlängning och de många läkemedelsinteraktionerna med andra QTc-förlängande medel samt CYP3A4- och CYP2D6-hämmare.12 Dessutom är det svårt med opioidkonvertering eftersom metadonet ökar i potens med ökande doser av morfin. Därför kan man inte hitta något enda förhållande för ekvianalgetisk dosering mellan morfin och metadon.17
Memantine: Andra NMDA-receptorantagonister som memantin, amantadin och dextrometorfan har visat blandade resultat vid neuropatisk smärta.20 Memantin har en säker biverkningsprofil och snabb verkningstid, men i en randomiserad, dubbelblind, crossover-studie där memantin administrerades till en grupp på 19 patienter med kronisk smärta på grund av nervskada efter kirurgi, fanns det ingen skillnad i smärtminskning med memantin jämfört med placebo.21 Dessutom visade en studie med memantin hos patienter med hiv-associerad sensorisk neuropati inga positiva resultat.22
Amantadin: Amantadin är ett annat läkemedel som har visat blandade resultat i kliniska prövningar. En dubbelblind, randomiserad, placebokontrollerad studie genomfördes på 15 cancerpatienter som hade kirurgisk neuropatisk smärta.23 I randomiserad ordning fick patienterna en 200 mg infusion av amantadin eller placebo med en veckas mellanrum. Spontan och framkallad smärta mättes 48 timmar före, under och efter behandlingen. I genomsnitt var det en smärtreduktion på 85 % med amantadin jämfört med 45 % med placebo (P = 0,009) i slutet av infusionen. Vid jämförelse av genomsnittlig smärtintensitet 48 timmar före och efter behandlingen hade amantadin en smärtminskning på 31 % (P = .006), medan placebo uppvisade en obetydlig smärtminskning på 6 % (P = .40).23
I kontrast till dessa positiva resultat genomförde Fukui et al en studie av amantadin på 19 patienter som inte svarade på konventionella behandlingar av neuropatisk smärta, inklusive antikonvulsiva medel, antidepressiva medel och nervblockeringar.24 Patienterna började med oralt amantadin 100 mg/dag i en vecka och titrerades till 200 mg/dag. Resultaten visade smärtreduktion hos endast 2 (10,5 %) av de 19 patienterna. Biverkningar uppstod hos 52,6 % av patienterna, inklusive muntorrhet, sömnighet, hallucinationer, excitation, irritation, yrsel, dyskinesi och håravfall.24
Dextrometorphan: Dextrometorphan, som vanligen återfinns i receptfria hostmediciner, har också granskats för sin användning vid neuropatisk smärta. I en placebokontrollerad, dubbelblind, randomiserad crossover-studie fick 15 patienter med neuropatisk smärta 270 mg dextrometorfan och placebo i slumpmässig ordning åtskilda av en 1 veckas tvättperiod.25 Resultaten visade en 30-procentig minskning av smärtan efter en enda dextrometorfandos jämfört med placebo. Efter 1,5 timmar och 2,5 till 4 timmar från tidpunkten för medicinering fanns det en statistiskt signifikant skillnad i smärtreduktion av dextrometorfan jämfört med placebo (P <.05 respektive P <.002). Biverkningar var bland annat yrsel, sömnighet, synstörningar och värmevallningar; ingen var allvarlig.25
Då dextrometorfan metaboliseras via CYP2D6 till den aktiva metaboliten dextrorfan jämfördes också omfattande kontra dåliga metaboliserare. Patienter som var extensiva metaboliserare av dextrometorfan upplevde bättre analgesi än fattiga metaboliserare. Slutsatsen var att dextrometorfan har potential vid behandling av neuropatisk smärta, men det behövs mer omfattande studier för att validera användningen.25
Apotekens roll
Apotekare kan påverka patientvården i hög grad hos personer som inte får adekvat smärtlindring på grund av opioidresistens och neuropatisk smärta som inte kontrolleras på ett adekvat sätt med vanligt förekommande medel, genom att förstå NMDA-antagonisternas nuvarande roll. Eftersom metadon för närvarande har visat sig vara mycket lovande på detta område är det viktigt att farmaceuterna förstår hur man underlättar en säker användning av detta medel när det gäller korrekt dosering, läkemedelsinteraktioner och övervakning av biverkningar.
Slutsats
NMDA-antagonister är en utmärkt plats att utforska vid behandling av opioidresistent och neuropatisk smärta. De NMDA-antagonister som för närvarande har testats är ketamin, metadon, memantin, amantadin och dextrometorfan. De kliniska prövningarna hittills har visat att ketamin och metadon är värdefulla för att minska neuropatisk smärta och opioidresistent smärta. Biverkningar på CNS är dock ett problem, särskilt när det gäller ketamin. Memantin, amantadin och dextrometorfan är svagare NMDA-antagonister med en säkrare toxicitetsprofil, men har inte visat någon konsekvent nytta i dessa smärtmiljöer.12 Fler studier av NMDA-antagonister behövs för att fastställa deras bästa användning vid smärtbehandling samt för att effektivt hantera deras biverkningar.
1. Weiner K. Smärtfrågor. Smärta är en epidemi. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Tillgänglig den 4 oktober 2010.
2. Turk DC. Smärta skadar-individer, viktiga andra och samhället! APS Bulletin. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Tillgänglig den 4 oktober 2010.
3. Chronic pain in America: roadblocks to relief. American Pain Society. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Tillgänglig den 7 januari 2011.
4. Riktlinjer för hälso- och sjukvård: Bedömning och behandling av akut smärta. Institutet för förbättring av kliniska system. 6th ed. Mars 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Tillgänglig
8 april 2011.
5. Lussier D, Huskey AG, Portenoy RK. Adjuvanta analgetika vid smärtbehandling av cancer. Onkolog.
6. McCormick WC, Schreiner RL. Diagnos och behandling av opiatresistent smärta vid avancerad aids. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. NMDA-antagonister och neuropatisk smärta – flera läkemedelsmål och flera användningsområden. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Metadon vid behandling av neuropatisk smärta. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Uppdatering av neurofysiologin för smärtöverföring och smärtmodulering: fokus på NMDA-receptorn. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Mekanismer för opioidinducerad tolerans och hyperalgesi. Pain Manag Nursing. 2007;8:113-121.
11. Hewitt DJ. Användningen av NMDA-receptorantagonister vid behandling av kronisk smärta. Clin J Pain. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Tillgänglig den 8 april 2011.
12. Lexicomp Online. www.lexi.com. Tillgänglig den 12 april 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Tillgänglig den 8 april 2011.
14. Bhavani-Shankar K, Jasmeet SO. Behandling av postoperativ smärta. UptoDate. 28 maj 2010. www.uptodate.com. Tillgänglig den 4 oktober 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgetisk effekt av intravenöst ketamin hos cancerpatienter som behandlas med morfin: en randomiserad, kontrollerad, dubbelblind, crossover, dubbeldosstudie. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. ”Burst” ketamine for refractory cancer pain: an open-label audit of 39 Patients. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Metadonbehandling av smärttillstånd. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Byte från morfin för att förbättra analgesi och tolerabilitet hos cancerpatienter: en prospektiv studie. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Low-dose methadone has an analgesic effect in neuropathic pain: a double-blind randomized controlled crossover trial. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Smärtbehandling vid cancer: adjuvanta analgetika. UptoDate. 28 maj 2010. www.uptodate.com. Tillgänglig den 4 oktober 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantin (en N-metyl-d-aspartatreceptorantagonist) vid behandling av neuropatisk smärta efter amputation eller kirurgi: en randomiserad, dubbelblindad, cross-over-studie. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. A placebo-controlled study of memantine for the treatment of human immunodeficiency virus-associated sensory neuropathy. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. NMDA-receptorantagonisten amantadin minskar kirurgisk neuropatisk smärta hos cancerpatienter: en dubbelblind, randomiserad, placebokontrollerad studie. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Klinisk tillämpning av amantadin, en NMDA-antagonist, för neuropatisk smärta. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Analgetisk effekt av dextrometh-orphanin neuropatisk smärta. Acta Anaesthesiol Scand. 2004;48:328-336.