US Pharm. 2011;36(5):HS4-HS8.
Si stima che 50 milioni di americani soffrano attualmente di dolore cronico, insieme ad altri 25 milioni che soffrono di dolore acuto.1 Ogni anno, quasi la metà di tutti gli americani si presenta al proprio medico con una lamentela principale di dolore.2 Il cardine del trattamento del dolore da moderato a grave sono gli analgesici oppioidi, con l’aggiunta di altri analgesici come i farmaci antinfiammatori non steroidei (FANS) e altre terapie coadiuvanti, compresi gli antidepressivi triciclici (TCA), gli anticonvulsivanti e gli anestetici topici, se necessario.3,4 Tuttavia, più di quattro persone su 10 con dolore da moderato a grave non ottengono sollievo, secondo un sondaggio dell’American Pain Society (APS) condotto nel 1999.5 Tra coloro che non ottengono sollievo dal dolore, alcuni potrebbero provare un dolore che non risponde agli oppioidi o ad altre terapie farmacologiche nonostante l’uso appropriato di questi agenti, come nella resistenza agli oppioidi e nel dolore neuropatico.
Resistenza agli oppioidi e dolore neuropatico
La resistenza agli oppioidi è definita come l’insensibilità al solfato di morfina per via endovenosa di almeno 100 mg all’ora (o un dosaggio equivalente di un altro oppioide), valutazioni del dolore costantemente elevate e dolore non alleviato anche dopo il raddoppio della dose di oppioide. La resistenza agli oppioidi è stata riscontrata in una moltitudine di stati patologici tra cui il cancro, il dolore cronico, la neuropatia, la sindrome dolorosa regionale complessa, la nevralgia post-erpetica e la pancreatite.6 Il dolore neuropatico deriva da lesioni ai nervi periferici o centrali ed è comunemente trattato con agenti come i TCA e gli anticonvulsivanti. Purtroppo, la maggior parte dei pazienti non prova un sollievo significativo con questi agenti.7,8 Sia nella resistenza agli oppioidi che nel dolore neuropatico, gli antagonisti dell’N-metil-d-aspartato (NMDA) possono essere un’opzione.
Antagonisti del recettore NMDA
NMDA è un recettore per il neurotrasmettitore eccitatorio glutammato, che viene rilasciato con stimoli periferici nocivi.7,9 L’attivazione dei recettori NMDA è stata associata a iperalgesia, dolore neuropatico e ridotta funzionalità dei recettori oppioidi. L’iperalgesia e il dolore neuropatico sono il risultato di un’aumentata sensibilizzazione dei neuroni spinali, che porta a un elevato livello di dolore.7,9,10 La ridotta funzionalità dei recettori oppioidi è causata da una diminuzione della sensibilità del recettore oppioide. Questa diminuita sensibilità, a sua volta, si traduce in tolleranza agli oppioidi, in quanto i pazienti richiedono dosi più elevate di oppioidi per ottenere gli stessi effetti terapeutici.9 Pertanto, gli antagonisti NMDA possono avere un ruolo in queste aree di gestione del dolore.10
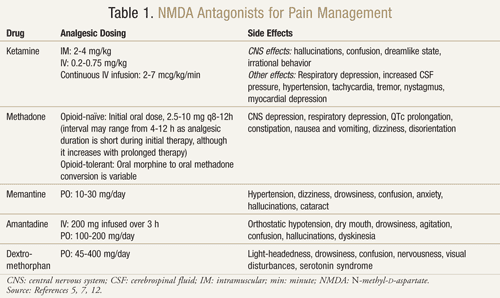
Ci sono diversi antagonisti del recettore NMDA disponibili: ketamina, metadone, memantina, amantadina e destrometorfano (TABELLA 1).11,12 Ciascuno differisce nel loro livello di attività sul recettore NMDA. La ketamina è un forte antagonista dell’NMDA, mentre gli altri sono bloccanti del recettore NMDA più deboli.13 La gravità e la frequenza degli effetti collaterali dipendono dall’affinità per il recettore NMDA. Negli adulti, gli effetti avversi degli antagonisti NMDA sono principalmente effetti collaterali del sistema nervoso centrale (SNC), tra cui allucinazioni, stordimento, vertigini, affaticamento, mal di testa, sensazioni extracorporee, incubi e cambiamenti sensoriali. Poiché la ketamina è un forte antagonista NMDA, è meno tollerabile degli altri antagonisti a causa di una maggiore incidenza di effetti collaterali, in particolare allucinazioni e uno stato mentale dissociativo.7
Ketamina: La ketamina si è dimostrata utile in diversi contesti di dolore. In uno studio clinico, l’aggiunta di una bassa dose di ketamina per via endovenosa agli oppioidi rispetto ai soli oppioidi nel postoperatorio dopo un intervento di chirurgia addominale maggiore ha prodotto una migliore analgesia, meno sedazione e una minore necessità di morfina o di intervento del medico per gestire il dolore.14 È stato anche condotto uno studio randomizzato, in doppio cieco, incrociato e controllato con placebo per confermare i risultati precedenti che suggerivano l’efficacia della ketamina nei pazienti oncologici resistenti alla morfina.15 Ognuno dei 10 pazienti arruolati ha ricevuto la ketamina a una dose di 0,25 mg/kg, 0,50 mg/kg e placebo in 3 giorni separati a distanza di almeno 2 giorni, in aggiunta alla morfina. I risultati hanno mostrato che la ketamina ha ridotto significativamente il dolore ad entrambe le dosi rispetto al placebo. I pazienti che ricevevano 0,5 mg/kg avevano un effetto analgesico migliore rispetto ai pazienti con 0,25 mg/kg (P <.05). Effetti avversi significativi si sono verificati in quattro pazienti che hanno sperimentato allucinazioni e due pazienti che hanno sperimentato una sensazione sgradevole a cui si sono riferiti come “testa vuota”. I pazienti hanno ricevuto diazepam 1 mg per una riuscita inversione di questi effetti avversi del SNC. I pazienti hanno sperimentato una significativa sonnolenza con entrambe le dosi di ketamina, anche se era più pronunciata alla dose di 0,5 mg/kg (P <.05).15
In uno studio prospettico, multicentrico, non cieco, in aperto su 39 pazienti, l’infusione di ketamina “burst” ha dimostrato di avere un effetto significativo sul dolore legato al cancro in pazienti che erano resistenti agli oppioidi anche con l’aggiunta di analgesici adiuvanti o intolleranti agli effetti avversi degli oppioidi.16 La ketamina a scoppio è stata definita come un’infusione sottocutanea di breve durata (3-5 giorni), cominciando con una dose iniziale di 100 mg/24 h, aumentando poi a 300 mg/24 h e 500 mg/24 h in modo graduale se il dolore del paziente era persistente senza effetti collaterali intollerabili. Il sollievo dal dolore è stato analizzato per tipo di dolore (somatico, viscerale o neuropatico). I pazienti con più di un tipo di dolore hanno analizzato ciascuno dei loro dolori separatamente. Su 43 dolori trattati in 39 pazienti, 29 (67%) hanno mostrato almeno una diminuzione del 50% sulla scala di valutazione verbale (0 = nessun dolore, 10 = il peggior dolore possibile) supportata da una significativa riduzione dell’uso di oppioidi nelle 24 ore e/o un miglioramento della mobilità o dello stato funzionale. Dodici pazienti hanno riferito effetti avversi sul sistema nervoso centrale, tra cui la sensazione di essere “distratti”, allucinazioni, sonnolenza e vertigini.16
Metadone: Il metadone è un altro antagonista NMDA che è stato studiato nella resistenza agli oppioidi e nel dolore neuropatico. Ha dimostrato di essere una buona opzione da utilizzare come oppioide sostitutivo in pazienti scarsamente controllati o che sperimentano effetti avversi limitanti la dose mentre assumono altri oppioidi.17 Nell’80% dei pazienti oncologici con dolore incontrollato o effetti collaterali significativi, il metadone ha dimostrato una riduzione del dolore e degli effetti avversi dopo un passaggio dalla morfina al metadone.18
Il metadone ha anche dimostrato efficacia in pazienti con dolore neuropatico refrattario. In uno studio in doppio cieco, randomizzato, controllato e crossover condotto su 18 pazienti che non rispondevano ai tradizionali regimi analgesici per il loro dolore neuropatico cronico, il metadone orale da 10 mg due volte al giorno ha mostrato un sollievo dal dolore statisticamente significativo nell’intensità massima del dolore (P = .013), nell’intensità media del dolore (P = .020) e nel sollievo dal dolore (P = .015) rispetto al placebo.19 Anche il metadone a 5 mg due volte al giorno ha mostrato un miglioramento analgesico nell’intensità massima del dolore e nel sollievo dal dolore; tuttavia, non ha raggiunto la significatività statistica. Sei pazienti si sono ritirati dallo studio a causa di eventi avversi tra cui nausea, vomito, vertigini, sudorazione e disorientamento con forti mal di testa. Altri che hanno completato lo studio hanno riportato solo effetti avversi da lievi a moderati.19
Gagnon et al hanno condotto uno studio sul metadone nel trattamento del dolore neuropatico in 18 pazienti che non ricevevano oppioidi per il loro dolore o che ricevevano una dose giornaliera di oppioidi non superiore all’equivalente di 120 mg di morfina orale a causa di effetti collaterali che impedivano un ulteriore aumento della dose.8 Le dosi di metadone sono state iniziate tra 2 mg e 5 mg tre volte al giorno a seconda dell’età e titolate fino a una dose stabile basata sulla risposta clinica e sugli effetti avversi. Il metadone 2 mg ogni 4-6 ore era consentito per il dolore di rottura, se necessario. I pazienti sono stati seguiti per una mediana di 106 giorni (da 16 a 466 giorni). Tutti i pazienti hanno sperimentato un miglioramento nei loro punteggi della scala analogica visiva (VAS; 0-10 cm, dove 0 = nessun dolore e 10 = il peggior dolore possibile) con il trattamento con metadone. La VAS media pretrattamento ± deviazione standard (SD) era di 7,7 ± 1,5 cm ed è scesa a 1,4 ± 1,7 cm con il metadone (P <.0001). Nove su 18 (50%) non avevano alcun dolore mentre erano sotto una dose stabile di metadone. Dei 13 pazienti che avevano allodinia come parte del loro dolore neuropatico, 9 (70%) hanno mostrato una risoluzione completa (nessuna allodinia clinicamente rilevabile) e 4 (30%) hanno avuto una risoluzione parziale (allodinia in <50% della superficie). Degli 8 pazienti che avevano dolore da sparo, tutti e 8 (100%) hanno riportato il controllo dei sintomi con una dose stabile di metadone. Gli effetti collaterali includevano lieve sonnolenza e nausea che era transitoria, insieme a costipazione che si risolveva con lassativi.8
Purtroppo, il metadone è spesso difficile da usare data la sua lunga e variabile emivita di circa 8-59 ore, il necessario monitoraggio ECG per il possibile prolungamento del QTc, e molte interazioni farmacologiche con altri agenti che prolungano il QTc, così come con gli inibitori CYP3A4 e CYP2D6.12 Inoltre, la conversione degli oppioidi è difficile perché il metadone aumenta di potenza con l’aumentare delle dosi di morfina. Pertanto, non è possibile trovare un unico rapporto per il dosaggio equianalgesico tra morfina e metadone.17
Memantina: Altri antagonisti dei recettori NMDA come la memantina, l’amantadina e il destrometorfano hanno mostrato risultati contrastanti nel dolore neuropatico.20 La memantina ha un profilo di effetti collaterali sicuro e un rapido inizio d’azione; tuttavia, in uno studio randomizzato, in doppio cieco e crossover in cui la memantina è stata somministrata a un gruppo di 19 pazienti con dolore cronico dovuto a lesioni nervose dopo un intervento chirurgico, non vi è stata alcuna differenza nella riduzione del dolore con memantina rispetto al placebo.21 Inoltre, uno studio con la memantina in pazienti con neuropatia sensoriale associata all’HIV non ha mostrato risultati positivi.22
Amantadina: L’amantadina è un altro farmaco che ha mostrato risultati contrastanti negli studi clinici. Uno studio in doppio cieco, randomizzato e controllato con placebo è stato condotto su 15 pazienti oncologici che avevano dolore neuropatico chirurgico.23 In un ordine randomizzato, i pazienti hanno ricevuto un’infusione di 200 mg di amantadina o placebo a 1 settimana di distanza l’uno dall’altro. Il dolore spontaneo ed evocato è stato misurato 48 ore prima, durante e dopo il trattamento. In media, c’è stata una riduzione del dolore dell’85% con l’amantadina contro il 45% con il placebo (P = .009) alla fine dell’infusione. Confrontando l’intensità media del dolore 48 ore prima e dopo il trattamento, l’amantadina ha avuto una riduzione del dolore del 31% (P = .006), mentre il placebo ha mostrato una riduzione del dolore insignificante del 6% (P = .40).23
In contrasto con questi risultati positivi, Fukui et al hanno condotto uno studio sull’amantadina in 19 pazienti che non hanno risposto ai trattamenti convenzionali per il dolore neuropatico, compresi anticonvulsivanti, antidepressivi e blocchi nervosi.24 I pazienti sono stati iniziati con l’amantadina orale 100 mg/giorno per 1 settimana e titolati a 200 mg/giorno. I risultati hanno mostrato una riduzione del dolore solo in 2 (10,5%) dei 19 pazienti. Gli effetti avversi sono stati sperimentati nel 52,6% dei pazienti, tra cui bocca secca, sonnolenza, allucinazioni, eccitazione, irritazione, vertigini, discinesia e perdita di capelli.24
Destrometorfano: Comunemente presente nei farmaci da banco per la tosse, il destrometorfano è stato anche esaminato per il suo uso nel dolore neuropatico. In uno studio crossover randomizzato, in doppio cieco, controllato con placebo, 15 pazienti con dolore neuropatico hanno ricevuto 270 mg di destrometorfano e placebo in ordine casuale separati da un periodo di washout di 1 settimana.25 I risultati hanno mostrato una riduzione del dolore del 30% dopo una singola dose di destrometorfano rispetto al placebo. Dopo 1,5 ore e da 2,5 a 4 ore dal momento della somministrazione, c’era una differenza statisticamente significativa nella riduzione del dolore del destrometorfano rispetto al placebo (P <.05 e P <.002, rispettivamente). Gli effetti collaterali includevano stordimento, sonnolenza, disturbi visivi e vampate di calore; nessuno era grave.25
Poiché il destrometorfano viene metabolizzato attraverso il CYP2D6 nel metabolita attivo destrorfano, sono stati confrontati anche i metabolizzatori estesi rispetto a quelli poveri. I pazienti che erano metabolizzatori estensivi del destrometorfano hanno sperimentato una migliore analgesia rispetto ai metabolizzatori scarsi. Si è concluso che il destrometorfano ha un potenziale nel trattamento del dolore neuropatico, ma sono necessari studi più ampi per convalidare il suo uso.25
Ruolo del farmacista
I farmacisti possono avere un grande impatto sulla cura dei pazienti che non ricevono un adeguato sollievo dal dolore a causa della resistenza agli oppioidi e del dolore neuropatico non adeguatamente controllato dagli agenti comunemente usati, comprendendo il ruolo attuale degli antagonisti NMDA. Poiché il metadone ha attualmente mostrato una grande promessa in questo settore, è importante che i farmacisti capiscano come facilitare l’uso sicuro di questo agente per quanto riguarda il corretto dosaggio, le interazioni farmacologiche e il monitoraggio degli effetti avversi.
Conclusione
Gli antagonisti NMDA sono un grande spazio da esplorare nel trattamento del dolore neuropatico e resistente agli oppioidi. Gli antagonisti NMDA che sono stati attualmente testati includono ketamina, metadone, memantina, amantadina e destrometorfano. Gli studi clinici finora hanno dimostrato il valore della ketamina e del metadone nella riduzione del dolore neuropatico e del dolore resistente agli oppioidi. Tuttavia, gli effetti avversi sul SNC sono una preoccupazione, specialmente con la ketamina. Memantina, amantadina e destrometorfano sono antagonisti NMDA più deboli con un profilo di tossicità più sicuro, ma non hanno mostrato un beneficio consistente in questi contesti di dolore.12 Sono necessari ulteriori studi sugli antagonisti NMDA per determinare il loro uso migliore nella gestione del dolore e per gestire efficacemente i loro effetti collaterali.
1. Weiner K. Problemi di dolore. Il dolore è un’epidemia. American Academy of Pain Management. www.aist-pain.it/en/files/PAIN%20AND%20SUFFERING/PAIN%20IS%20AN%20EPIDEMIC.pdf. Accessed October 4, 2010.
2. Turk DC. Il dolore fa male – gli individui, gli altri significativi, e la società! Bollettino APS. 2006;16(1). www.ampainsoc.org/pub/bulletin/win06/pres1.htm. Accessed October 4, 2010.
3. Dolore cronico in America: blocchi stradali per il sollievo. Società americana del dolore. 1999. http://ampainsoc.org/links/roadblocks/index.htm. Accessed January 7, 2011.
4. Linee guida per l’assistenza sanitaria: Valutazione e gestione del dolore acuto. Istituto per il miglioramento dei sistemi clinici. 6° ed. Marzo 2008. www.icsi.org/pain_acute/pain__acute__assessment_and_management_of__3.html. Accessed
April 8, 2011.
5. Lussier D, Huskey AG, Portenoy RK. Analgesici adiuvanti nella gestione del dolore del cancro. Oncologo.
6. McCormick WC, Schreiner RL. Diagnosi e trattamento del dolore resistente agli oppiacei nell’AIDS avanzato. West J Med. 2001;175:408-411.
7. Chizh BA, Headley PM. Antagonisti NMDA e dolore neuropatico: molteplici bersagli farmacologici e molteplici usi. Curr Pharm Des. 2005;11:2977-2994.
8. Gagnon B, Almahrezi A, Schreier G. Methadone nel trattamento del dolore neuropatico. Pain Res Manag. 2003;8:149-154.
9. Bennett GJ. Aggiornamento sulla neurofisiologia della trasmissione e modulazione del dolore: focus sul recettore NMDA. J Pain Symptom Manage. 2000;19(suppl 1):S2-S6.
10. DuPen A, Shen D, Ersek M. Meccanismi di tolleranza e iperalgesia indotta da oppioidi. Infermieristica per la gestione del dolore. 2007;8:113-121.
11. Hewitt DJ. L’uso di antagonisti del recettore NMDA nel trattamento del dolore cronico. Clin J Dolore. 2004;9:571-591. 2000;16(suppl 2):S73-S79. http://opioids.com/nmda/nmda.html. Accessed April 8, 2011.
12. Lexicomp Online. www.lexi.com. Accessed April 12, 2011.
13. Feinberg S, Provenzano D. ACPA Consumer Guide to Pain Medication & Treatment. Rocklin, CA: American Chronic Pain Association Inc; 2010. www.theacpa.org/documents/ACPA%20Consumer%20Guide%202010%20010410.pdf. Accesso 8 aprile 2011.
14. Bhavani-Shankar K, Jasmeet SO. Gestione del dolore postoperatorio. UptoDate. 28 maggio 2010. www.uptodate.com. Accessed October 4, 2011.
15. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Effetto analgesico della ketamina endovenosa in pazienti oncologici in terapia con morfina: uno studio randomizzato, controllato, in doppio cieco, crossover, a doppia dose. J Pain Symptom Manage. 2000;20:246-252.
16. Jackson K, Ashby M, Martin P, et al. “Burst” ketamina per il dolore da cancro refrattario: un controllo in aperto su 39 pazienti. J Pain Symptom Manage. 2001;22;831-842.
17. Toombs JD, Kral LA. Trattamento con metadone per gli stati di dolore. Am Fam Physician. 2005;71:1353-1358.
18. Mecadante S, Casuccio A, Fulfaro F, et al. Passaggio dalla morfina per migliorare l’analgesia e la tollerabilità nei pazienti oncologici: uno studio prospettico. J Clin Oncol. 2001;19:2898-2904.
19. Morley JS, Bridson J, Nash TP, et al. Il metadone a basso dosaggio ha un effetto analgesico nel dolore neuropatico: uno studio crossover controllato randomizzato in doppio cieco. Palliat Med. 2003;17:576-587.
20. Portenoy RK, Ahmed E, Keilson YY. Gestione del dolore da cancro: analgesici adiuvanti. UptoDate. 28 maggio 2010. www.uptodate.com. Accesso 4 ottobre 2011.
21. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantina (un antagonista del recettore N-metil-d-aspartato) nel trattamento del dolore neuropatico dopo l’amputazione o la chirurgia: uno studio randomizzato, in doppio cieco, cross-over. Anesth Analg. 2000;91:960-966.
22. Schifitto G, Yiannoutsos CT, Simpson DM, et al. Uno studio controllato con placebo di memantina per il trattamento della neuropatia sensoriale associata al virus dell’immunodeficienza umana. J Neurovirol. 2006;12:328-331.
23. Pud D, Eisenberg E, Spitzer A, et al. L’antagonista del recettore NMDA amantadina riduce il dolore neuropatico chirurgico in pazienti con cancro: un doppio cieco, randomizzato, studio controllato con placebo. Pain. 1998;75:349-354.
24. Fukui S, Komoda Y, Nosaka S. Applicazione clinica dell’amantadina, un antagonista NMDA, per il dolore neuropatico. J Anesth. 2001;15:179-181.
25. Carlsson KC, Hoem NO, Moberg ER, Mathisen LC. Effetto analgesico del dolore neuropatico destrometallico. Acta Anaesthesiol Scand. 2004;48:328-336.