Flaviviry jsou velká čeleď virových patogenů, které způsobují závažná onemocnění a úmrtí u lidí i zvířat. Čeleď se skládá ze tří rodů: Flavivirus, Pestivirus a Hepacivirus. Rod Flavivirus, který je z těchto tří rodů největší, obsahuje více než 70 virů včetně viru dengue (DV), viru japonské encefalitidy (JEV), viru západonilské horečky (WNV), viru žluté zimnice (YFV) a viru zika (ZIKV). Flaviviry vykazují morfologickou uniformitu s ikosaedrickou kapsidou a těsně přiléhajícím, špičatým obalem. Velikost kapsidy je přibližně 30 nm a celý virion měří 45 nm. Genom flavivirů je jednovláknová smyslová RNA o velikosti asi 10 kb. Kóduje 3 strukturní proteiny: kapsidový (C protein), membránový (M, který je vyjádřen jako prM, prekurzor M a obalový (E protein) a 7 nestrukturních proteinů: NS1, NS2A, NS2B, NS3, NS4A, NS4B a NS5 (obr. 1 a.b).
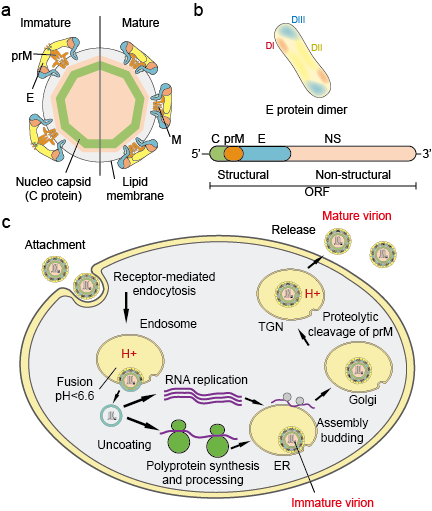
Obrázek 1. Částice flaviviru (a), proteiny (b) a životní cyklus (c).
Prohlédnout všechny produkty související s flaviviry
Životní cyklus flaviviru:
Viriony se přichytí na povrch hostitelské buňky a následně do buňky vstoupí pomocí endocytózy zprostředkované receptory (obrázek 1c). Bylo identifikováno několik primárních receptorů a nízkoafinitních koreceptorů pro flaviviry. Okyselení endozomálního vezikulu vyvolá konformační změny virionu, splynutí virové a buněčné membrány a rozpad částice. Po uvolnění genomu do cytoplazmy je RNA s pozitivním smyslem přeložena do jednoho polyproteinu, který je zpracován ko-translačně a post-translačně virovými a hostitelskými proteázami. Replikace genomu probíhá na intracelulárních membránách. K sestavení viru dochází na povrchu endoplazmatického retikula (ER), kdy se strukturní proteiny a nově syntetizovaná RNA vnoří do lumen ER. Vzniklé neinfekční, nezralé virové a subvirové částice jsou transportovány přes trans-Golgiho síť (TGN). Nezralé virionové částice jsou štěpeny hostitelskou proteázou furinem, čímž vznikají zralé, infekční částice. Subvirové částice jsou rovněž štěpeny furinem. Zralé viriony a subvirulární částice se následně uvolňují exocytózou.
Epidemiologie flavivirů:
Flaviviry přenášené komáry se v přírodě přenášejí v jednom nebo více odlišných nebo překrývajících se cyklech, které zahrnují komáří vektory, obvykle komáry rodu Aedes v případě YFV a DENV a komáry rodu Culex v případě JEV a WNV, a savčí nebo ptačí hostitele. Přenos mezi komáry a obratlovčími hostiteli se označuje jako horizontální přenos a způsobuje onemocnění obratlovců. Na rozdíl od horizontálního přenosu se flaviviry přenášené komáry mohou v prostředí udržovat prostřednictvím vertikálního, tj. transgeneračního přenosu, který umožňuje šíření flavivirů výhradně v komárech. Nejpřímější důkaz podporující vertikální přenos flavivirů přenášených komáry pochází z izolace viru z infikovaných larev pravděpodobně transovariálním přenosem. Toto pozorování je v souladu s detekcí virových antigenů v ovariálních tkáních infikovaných komárů. (Obrázek 2)
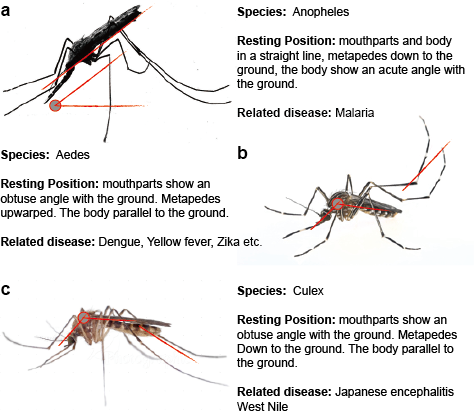
Obrázek 2. Tři typičtí komáři, kteří přenášejí onemocnění.
Flaviviry jsou rozšířeny po celém světě a někteří příslušníci rodu představují závažný problém pro veřejné zdraví (např. virus žluté zimnice , virus horečky dengue , virus západonilské horečky a virus japonské encefalitidy ) s vysokou nemocností a/nebo úmrtností. V posledním desetiletí flaviviry vykazují zvýšenou prevalenci a představují riziko pro více než 3 miliardy lidí na celém světě, což z nich činí paradigma nově se objevujících onemocnění.
V posledních 50 letech mnoho flavivirů, jako jsou viry horečky dengue, západonilské horečky a žluté zimnice, vykazuje dramatický nárůst incidence, závažnosti onemocnění a/nebo geografického rozšíření. Virové patogeny pocházející z životního prostředí vykazují relativně jednotné epidemiologické charakteristiky. Komáři, klíšťata a kousavé mouchy slouží jako přenašeči většiny lidských virových onemocnění. Lidská onemocnění se vyskytují v době, kdy jsou vektory aktivní, obvykle na jaře, v létě a na podzim v mírném podnebí, a často vykazují odlišné epidemiologické charakteristiky, které odpovídají stanovišti vektoru (obrázek 3).
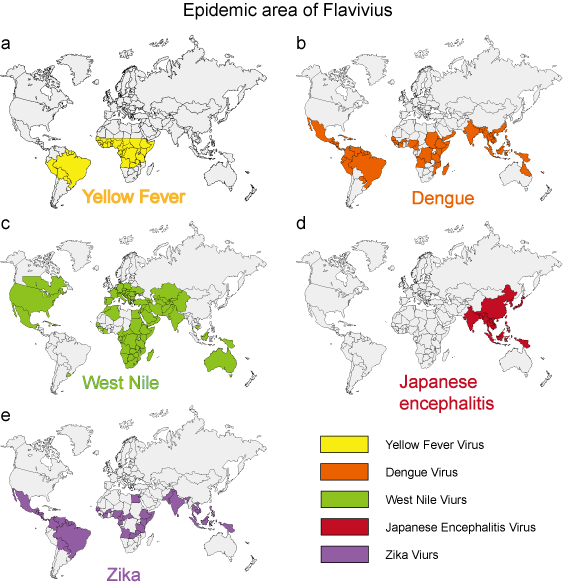
Obrázek 3. Epidemická oblast 5 typických flavivirů.
Manifestace:
Flaviviry se značně liší svým patogenním potenciálem a mechanismy vzniku lidských onemocnění (tabulka 1). Infekce člověka flaviviry přenášenými komáry i klíšťaty je iniciována přenosem viru přes kůži prostřednictvím slin infikovaného členovce. Virus se replikuje lokálně a v regionálních lymfatických uzlinách a vede k virémii. Mezi hlavní syndromy a příklady příčin flavivirů patří: encefalitida (japonská encefalitida), horečnaté onemocnění s vyrážkou (virus dengue), hemoragická horečka (virus Kyasanurské lesní choroby a někdy virus dengue) a hemoragická horečka s hepatitidou (virus žluté zimnice).
Tabulka 1 Přehled nejdůležitějších flavivirů
| Virové druhy | Přenašeč | Geografické rozšíření | Syndrom. |
|---|---|---|---|
| Žlutá zimnice | Komár (Aedes) | Viz obrázek 3a | Hemoragická horečka |
| Dengue | Komár (Aedes, Stegomyia) |
Viz obrázek 3b | Syndrom horečky dengue, DHF, DSS |
| západonilská horečka | Komár (Culex), klíšťata (Argasidae) |
Viz obrázek 3c | Syndrom dengue, encefalitida |
| japonská encefalitida | Komáři (Culex) | Viz obrázek 3d | Encefalitida |
| Zika | Komár (Aedes) | Viz obrázek 3e | Mikrocefalie |
Diagnostika:
Klinická diagnostika různých flavivirů není vzhledem k nespecifickým příznakům spolehlivá a k potvrzení etiologie onemocnění je nutná laboratorní diagnostika. U flavivirových infekcí lze virus nalézt v séru nebo plazmě obvykle 2-7 dní po začátku onemocnění, přičemž trvání této viremické fáze a zjištěná virová nálož se liší v závislosti na infikujícím viru (tabulka 2). Obvykle po 5-7 dnech od začátku infekce vzniká imunitní odpověď proti infekci, přičemž protilátky IgM dosahují vrcholu po 15 dnech. Tyto protilátky IgM mohou přetrvávat měsíce (jako v případě DENV) až roky (jako v případě infekce WNV). K výskytu IgG protilátek dochází po 8-10 dnech od začátku onemocnění a lze je detekovat po celý život. Specifické vlastnosti jednotlivých flavivirů výrazně ovlivňují diagnostické algoritmy, které je třeba použít při identifikaci flavivirálních infekcí. Obecně platí, že mnoho laboratoří zvolilo k diagnostice infekcí způsobených flaviviry sérologické testy vzhledem k jejich přesnosti a dostupnosti komerčních testů založených na vysokých standardech kvality. Přítomnost zkřížených sérologických reakcí mezi různými viry a doba potřebná k detekci protilátek u některých infekcí však brání užitečnosti sérologie jako diagnostického nástroje pro akutní flavivirové infekce. Izolace viru představuje „zlatý standard“ metody pro dosažení potvrzené diagnózy flavivirů.
Prohlédněte si všechny produkty ELSIA pro flaviviry a RDT pro flaviviry
Tabulka 2. Algoritmy pro diagnostiku flavivirů.
| Akutní fáze | Konvalescentní fáze | Preferovaný vzorek† | Očekávaná virová nálož | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, izolace viru | IgM, IgG | Sérum, plazma a tkáň | Vysoká |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, izolace viru | IgM, IgG | Sérum, plazma, CSF a PBMC | Do 106 virionů/ml |
| WNV | RT-PCR, IgM, IgG | IgM, IgG | CSF a séra | Nízká |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, sérum, krev a PBMC | Nízká |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF a sérum | Low |
| Gould E A, Solomon T. Patogenní flaviviry . The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. Phylogenetic relationships of flaviviruses correlate with their epidemiology, disease association and biogeography . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Phylogeny of the genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle. Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Flavivirus-mosquito interactions. Viruses, 2014, 6(11): 4703-4730. |
.