Chemie nám pomáhá pochopit vlastnosti a složení světa kolem nás. Zde se dozvíte o stavech hmoty a také spoustu informací o jednom konkrétním stavu (tři hádanky – není to pevná látka ani kapalina…).
Stavy hmoty
V závislosti na teplotě, tlaku a vlastnostech látky může látka nabývat různých fyzikálních forem. Tyto fyzikální formy nazýváme stavy hmoty. Existují tři velmi dobře známé stavy hmoty: Pevné látky, kapaliny a plyny. Existují však i další stavy hmoty. Patří mezi ně plazma (stav hmoty podobný plynu, ale obsahuje volně se pohybující elektrony a ionty – atomy, které ztratily elektrony) a Boseho-Einsteinovy kondenzáty (BEC) (vlnění hmoty, které se může vyskytovat u některých typů atomů při velmi nízkých teplotách).
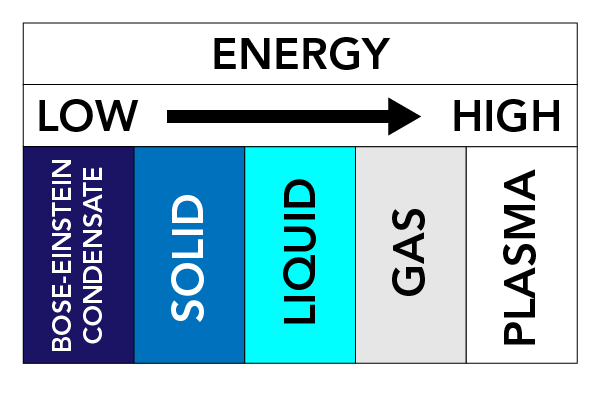
Síly mezi částicemi a tlak na částice udržují částice pohromadě. Pokud hmotu zahřejeme (přidáme energii), částice se začnou pohybovat rychleji a mají tendenci se rozptylovat. Tento pohyb částic má velký vliv na stav látky.
Tvrdé látky
V pevných látkách jsou síly, které drží částice pohromadě, poměrně silné a částice zůstávají velmi blízko sebe. Částice mohou vibrovat, ale příliš se nepohybují. Proto jsou pevná tělesa tvrdá a tuhá. Ponechány samy o sobě si pevné látky udrží svůj tvar.
Kapaliny
V kapalinách jsou síly mezi částicemi slabší než v pevných látkách. Částice jsou stále poměrně blízko u sebe, ale mohou se volně pohybovat. Kapaliny mohou proudit uvnitř nádoby a nemají žádný konkrétní pevný tvar.
Plyny
Plyny je obtížné vztahovat, protože jsou často neviditelné, ale nacházejí se všude kolem. Můžete je cítit, když například fouká vítr. Někdy je můžete cítit, když například ucítíte pach vařeného jídla nebo když vás rozčílí skunk. Některé plyny jsou důležité pro naše zdraví (např. kyslík), jiné mohou být smrtelně nebezpečné (např. sirovodík a chlor). Před operací můžete dostat anestetický plyn, který obsahuje chemické látky, abyste zmírnili bolest a během zákroku upadli do bezvědomí. Plyny jsou také zodpovědné za sílu výbuchů. Podívejme se na plyny blíže.
Typy plynů
Existují plyny elementární (tvořené jedním prvkem) a plyny, které jsou sloučeninami (tvořené více než jedním prvkem). Symboly elementárních plynů najdete v libovolné periodické tabulce prvků. Jsou shrnuty v následující tabulce.
Diatomický plyn |
Chemický vzorec |
Monatomický Plyn |
Chemický vzorec |
|
Vodík |
H2 |
Helium |
He |
|
Oxygen |
O2 |
Neon |
Ne |
|
Dusík |
N2 |
Argon |
Ar |
|
Fluor |
F2 |
Krypton |
Kr |
|
Chlor |
Cl2 |
Xenon |
Xe |
Dvouatomový plyn je plyn, jehož základní jednotkou je molekula složená ze dvou spojených atomů. Jednoatomový plyn je takový, jehož základní jednotkou je jeden atom. Většina plynů jsou však sloučeniny s chemicky spojenými dvěma nebo více různými prvky. Nejběžnější je vodní pára, H2O. Zde jsou názvy, vzorce a použití některých složených plynů:
Obvyklý název |
Chemický vzorec |
Kde se nacházíte? ho obvykle najdete |
|
Dioxid uhličitý |
CO2 |
Atmosféra, výfukové plyny aut, pop, naše plíce |
|
Propan |
C3H8 |
BBQ, kempinkové vařiče, palivo pro některá vozidla |
|
Metan |
CH4 |
Složka skleníkových plynů. a zemního plynu |
|
Amoniak |
NH3 |
Používá se k výrobě hnojiv, čisticích prostředků |