Pro pochopení molekulové geometrie, polarity a dalších vlastností je třeba znát některé základní vlastnosti dané sloučeniny a její Lewisovu strukturu. SF4 je chemický vzorec pro tetrafluorid sírový. Je to bezbarvý žíravý plyn, který se používá při syntéze několika organofluorových sloučenin. SF4 je poměrně nebezpečná sloučenina, ale hojně se používá v chemických a farmaceutických společnostech.
| Název molekuly | Tetrafluorid sírový ( SF4) |
| Počet valenčních elektronů v molekule | 34 |
| Hybridizace SF4 | sp3 hybridizace |
| Vazbové úhly | 102 stupňů a 173 stupňů |
| Molekulární geometrie SF4 | Trigonální bipyramida |
Pro pochopení vlastností této molekuly, jako je její reaktivita, polarita a další, je třeba nejprve znát Lewisovu strukturu SF4.
Obsah
Molekulová geometrie SF4
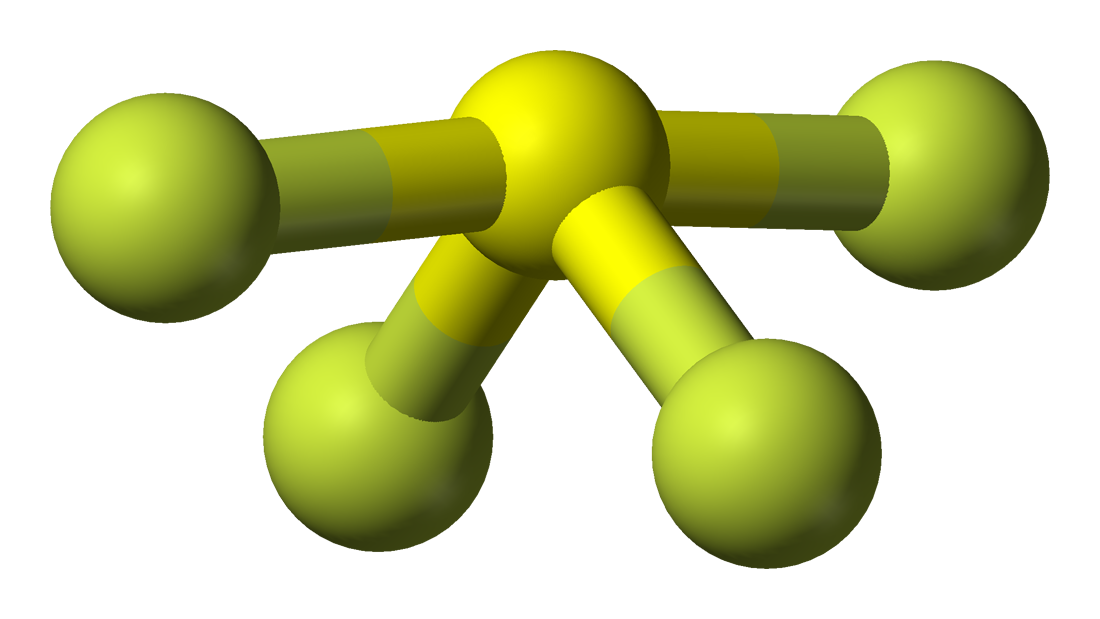
Pomocí molekulového vzorce nebo modelu VSEPR lze snadno pochopit molekulovou geometrii dané molekuly. Molekulový vzorec pomáhá zjistit přesný počet a typ atomů přítomných v dané sloučenině. Zde je ve sloučenině jeden atom síry a čtyři atomy fluoru, což ji činí podobnou molekulovému vzorci AX4E.
Molekuly s molekulovým vzorcem AX4E mají trigonální bipyramidální molekulovou geometrii. Dva atomy fluoru tvořící vazby s atomem síry jsou zde v ekvatoriálních polohách a zbylé dva jsou v axiálních polohách. Protože na centrálním atomu je jeden osamělý pár, odpuzuje vazebný pár elektronů, což trochu upravuje tvar a způsobuje, že se jeví jako hvězdice. Elektrony se při tomto uspořádání řídí pravidlem VSEPR, aby se minimalizovaly odpudivé síly mezi osamělými páry elektronů a maximalizovala se tak stabilita molekuly.
Proto má SF4 trigonální bipyramidální geometrii molekuly.
Lewisova struktura SF4
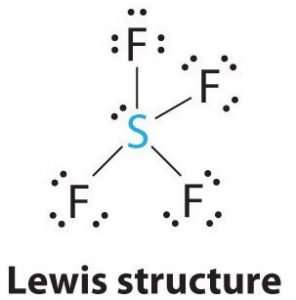
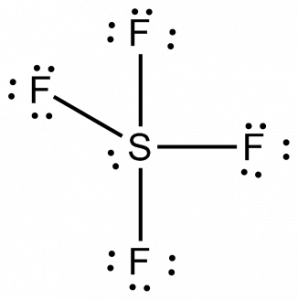
Lewisova struktura je názorné zobrazení vazeb a valenčních elektronů v molekule. Vazby vytvořené mezi dvěma atomy jsou znázorněny pomocí čar, zatímco valenční elektrony, které netvoří žádné vazby, jsou znázorněny tečkami. Valenční elektrony, které se podílejí na tvorbě vazeb, se nazývají vazebné páry elektronů, zatímco elektrony, které se neúčastní ani netvoří žádné vazby, se nazývají nevazebné páry elektronů nebo osamělé páry.
Až budeme moci nakreslit Lewisovu strukturu SF4, musíme nejprve znát celkový počet valenčních elektronů v této molekule.
Jak asi vidíme, v této sloučenině je jeden atom síry a čtyři atomy fluoru. Abychom znali celkový počet valenčních elektronů této sloučeniny, musíme znát valenční elektrony obou atomů jednotlivě.
- Valenční elektrony síry: 6
- Valenční elektrony fluoru: (7)
( protože atomy fluoru jsou čtyři, musíme uvažovat valenční elektrony všech atomů)
Celkový počet valenčních elektronů v SF4 = počet valenčních elektronů v síře + počet valenčních elektronů ve fluoru
= 6 + 28
= 34 valenčních elektronů
Teď, když známe celkový počet valenčních elektronů, bude pro nás snadné pochopit tvorbu vazeb mezi atomy a také kompletní uspořádání molekuly.
Síra bude v této molekule centrálním atomem, protože je nejméně elektronegativní, a po stranách tohoto centrálního atomu budou tvořit vazby čtyři atomy fluoru. Každý atom fluoru bude tvořit vazbu s centrálním atomem, což znamená, že ve struktuře molekuly budou čtyři vazby využívající čtyři valenční elektrony atomů fluoru a 4 elektrony atomu síry. Nyní je tedy využito osm valenčních elektronů, čímž se počet valenčních elektronů sníží z 34 na 24. Všechny atomy fluoru mají šest valenčních elektronů a centrální atom má dva valenční elektrony.
Kreslete čáry mezi S a F pro znázornění vazeb a pro osamělé páry elektronů použijte tečky. Každý atom fluoru bude mít na atomu tři páry 6 valenčních elektronů ( zobrazených jako tečky) spolu s jednou vazbou se sírou. Naproti tomu centrální atom bude mít dva valenční elektrony a čtyři vazby.
V Lewisově struktuře SF4 bude mít tedy centrální atom, síra, jeden osamělý pár elektronů a čtyři vazebné páry elektronů. Zároveň bude mít každý atom fluoru tři osamělé páry.
Je SF4 polární?
Jakmile známe Lewisovu strukturu a molekulovou geometrii dané sloučeniny, je snazší znázornit polaritu molekuly. Zde jeden osamělý pár na centrálním atomu síry a čtyři vazebné páry elektronů vedou k asymetrickému rozložení elektronů na centrálním atomu.
Jelikož je tvar molekuly jako hvězdice, dva atomy fluoru si mohou navzájem zrušit dipólový moment, ale zbylé dva ne kvůli uspořádání elektronů. A protože atomy fluoru jsou elektronegativnější než atomy síry, dochází k nerovnoměrnému rozložení náboje. Proto se dipólový moment nevyruší, což činí molekulu polární. Takže ano, SF4 je polární.
Hybridizace SF4
Chceme-li poznat hybridizaci molekuly SF4, podívejme se nejprve na oblasti elektronové hustoty pro centrální atom.
Síra má čtyři vazebné páry elektronů a jeden osamělý pár, takže celkový počet oblastí elektronové hustoty je u ní pět. Atom síry tedy využívá pět hybridizovaných orbitalů, jeden 3s orbital, tři 3p orbitaly a jeden 3d orbital. Toto uspořádání elektronů kolem atomu a hybridizovaných orbitalů vede k hybridizaci sp3d. Pro zjištění hybridizace lze také použít sterické číslo; zde je sterické číslo 5 pro atom síry.
Tak SF4 má sp3d hybridizaci.
Vazbové úhly a tvar SF4
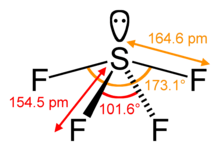
Střední atom síry tvoří čtyři vazby se sousedními atomy fluoru a má jeden osamělý pár elektronů. Atomy fluoru na rovníkových pozicích mají vazebné úhly 102 stupňů a axiální mají 173 stupňů, které se trochu liší od trigonální bipyramidální geometrie molekuly vedoucí k tvaru pilové pily.
Samostatný pár na centrálním atomu vede ke změně vazebných úhlů ze 120 stupňů na 102 stupňů u ekvatoriálních atomů fluoru a 173 stupňů místo 180 stupňů u axiálních atomů fluoru.
Závěrečné poznámky
Na závěr všech vlastností můžeme říci,
- Tetrafluorid síry má 34 valenčních elektronů, z nichž tvoří čtyři kovalentní vazby a jeden osamělý pár elektronů na centrálním atomu ve své Lewisově struktuře.
- Na každém atomu fluoru jsou tři osamělé páry.
- Má molekulovou geometrii vzorce AX4E; tvoří tvar vidlice a má trigonální bipyramidální molekulovou geometrii.
- SF4 má sp3d hybridizaci a je polární povahy.