Multiplexní amplifikace sondou závislou na ligaci (MLPA) je molekulární technika vyvinutá MRC-Holland v roce 2002. Stručně řečeno, MLPA je citlivá technika, která umožňuje rychlou a účinnou kvantifikaci sekvencí nukleových kyselin. Provádí se v mnoha laboratořích po celém světě a lze ji použít k detekci změn počtu kopií (jako jsou delece nebo duplikace) genu, identifikaci stavu metylace DNA, detekci jednonukleotidových polymorfismů (SNP) a bodových mutací a ke kvantifikaci mRNA. Proto se používá v mnoha výzkumných a diagnostických oblastech, jako je mimo jiné cytogenetika, výzkum rakoviny a lidská genetika.
Jak funguje?
MLPA se skládá z následujících kroků (obrázek 1):
- Denaturace
- Hybridizace
- Ligace
- Amplifikace (pomocí PCR)
- Separace fragmentů a analýza dat
Obrázek 1 – Vizualizace techniky MLPA (upraveno podle Schouten, Jan P., et al.1). Můžeme také pozorovat typický elektroferogram získaný analýzou MLPA, který ukazuje deleci exonu 46 (červená šipka). (Elektroferogram převzat z https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1-Denaturace a 2 – Hybridizace
Denaturace zahrnuje oddělení žíhaných vláken DNA, takže se z dvouřetězcové DNA stane jednovláknová.
Hybridizace zahrnuje hybridizaci vzorku DNA se specifickými sondami. Protože se jedná o multiplexní techniku, můžete každý vzorek analyzovat až 60 sondami současně, a zaměřit se tak na různá místa!
Tyto sondy mají primerovou sekvenci, která se v procesu amplifikace váže na PCR-primer. Všechny různé sondy budou mít stejnou vazebnou sekvenci primeru. Kromě toho mají sondy také hybridizační sekvenci komplementární k cílovému místu, která umožní, aby se sonda navázala na DNA. Obě sondy budou hybridizovat na sousedních místech na řetězci DNA.
Jedna ze sond z páru obsahuje vypichovací sekvenci, která má pro každé cílové místo jinou délku. Délka stuffer sekvence se mezi různými sondami mění, což umožňuje multiplexování. Můžete tedy očekávat, že každý produkt amplifikace bude mít jedinečnou délku!
3-Ligace
Krok ligace spojí obě sondy dohromady. V tomto kroku se používá specifický enzym zvaný DNA ligáza. Ten váže sondy, které jsou již hybridizovány na sousedních místech vlákna DNA v cílovém místě. Ligáza používaná v protokolech MLPA je ligáza-65, NAD-dependentní ligázový enzym, který může být užitečný i v jiných aplikacích.
Nyní vyvstává otázka: pokud je naším cílem ligace obou sond, proč jsou na začátku samostatné molekuly? No, obě sondy obsahují vazebná místa pro PCR-primery. To znamená, že pokud bychom sondy použili jako jedinou molekulu, získali bychom amplifikační produkt i bez cílového místa DNA, čímž bychom získali nespecifickou amplifikaci. Enzym ligáza je extrémně specifický: pokud by mezi sondou a cílovým místem byly jakékoli neshody, ligáza by nebyla schopna sondy navázat a k amplifikaci by nedošlo. V důsledku toho MLPA detekuje specifické bodové mutace, a dokonce rozlišuje mezi pseudogeny a skutečným cílovým genem.
4-Amplifikace
Dalším krokem je amplifikace, což je v podstatě polymerázová řetězová reakce (PCR) (tabulka 1). Pro krok PCR se přidává polymeráza, dNTP a přímý a zpětný primer. Protože všechny sondy mají stejnou sekvenci PCR-primérů, bude nutné přidat pouze jeden pár univerzálních primerů pro studium všech našich cílů. Přední primer je fluorescenčně značený, což umožňuje vizualizaci a kvantifikaci během analýzy.
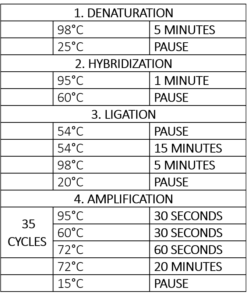
Tabulka 1 – Program termocykléru pro reakci MLPA
5-Separace fragmentů a analýza dat
Po amplifikaci se fragmenty separují kapilární elektroforézou. Kapilární elektroforéza separuje fragmenty na základě jejich délky a zobrazuje různě dlouhé fragmenty jako vzory píků, tzv. elektroforeogram (obrázek 1). Každý amplikon má jinou známou velikost, a to díky náplňové sekvenci na každé specifické sondě, a proto lze každý amplikon během analýzy dat kvantifikovat.
Údaje získané kapilární elektroforézou budou vstupem pro analýzu. MRC- Holland poskytuje bezplatný software pro analýzu dat – Coffalyser.
Při porovnání každého vzorku se sadou referenčních vzorků můžeme získat poměr sond. Tento poměr sond nás informuje o tom, kolik kopií má daný gen. Vzhledem k tomu, že většina lidských genů je diploidní, pokud vzorek představuje dvě kopie, bude poměr 1,0; to znamená, že sondy vzorku získaly stejný počet genů jako referenční vzorek.
Je-li však poměr 0,5, byla u jedince pouze jedna kopie genu, což pravděpodobně znamená heterozygotní deleci cílového genu. Pokud je naopak poměr 1,5, jedná se pravděpodobně o heterozygotní duplikaci genu.
MRC-Holland nabízí mnoho různých sad, které mohou mít řešení pro vaše problémy. Pokud se však snažíte najít něco trochu obskurnějšího nebo studovat něco, co není v žádné sadě, můžete si navrhnout vlastní sondy. Doporučuji vám, abyste si pozorně přečetli protokol pro návrh syntetických sond.
Výhody MLPA
- MLPA je vysoce citlivá, robustní a vysoce výkonná technika.
- Dokáže rozlišit bodové mutace i duplikace/delece genů. Proto má velkou výhodu oproti jiným technikám, jako je sekvenování, které dokáží najít pouze bodové mutace. Navíc na rozdíl od FISH dokáže MLPA odhalit malé změny genů.
- Výsledky jsou k dispozici do 24 hodin, a protože se jedná o multiplexní reakci, umožňuje rychlé a efektivní shromáždění informací.
- Malé úpravy protokolu MLPA mohou umožnit různé aplikace. Například přidáním dalšího kroku štěpení lze MLPA použít také k detekci metylačních vzorů v DNA (metylačně specifická MLPA (MS-MLPA)).
Omezení MLPA
- MLPA je extrémně citlivá na nečistoty. Proto je při přípravě vzorků a provádění této techniky nutná mimořádná opatrnost.
- Může dojít ke snížení signálu ze sondy v důsledku vzácného polymorfismu nebo mutace a může být nutné testovat ji jinými technikami.
MLPA je skvělá technika, kterou lze použít pro různé aplikace a která poskytuje výsledky rychle a efektivně. Neobejde se však bez zádrhelů. Jak všichni víme, každá technika má určité nevýhody a každou aplikaci je třeba důkladně prostudovat, abychom se ujistili, že používáme tu nejúčinnější a nejcitlivější techniku.
Použili jste někdy MLPA? Jaký je váš názor na tuto techniku?