Úvod
Tato neoplazie, která vzniká v epitelu žlučových cest, neboli cholangiokarcinom (CC), představuje 10 % hepatobiliárních nádorů a 2 % maligních nádorů.1,2 CC lze rozdělit na 3 podtypy podle anatomického původu ve žlučových cestách: intrahepatální neboli periferní CC (ICC), perihilární CC neboli Klatskinův tumor (PHC) a distální CC.
PHC, který je předmětem této revize, je nejčastější a představuje přibližně 40-60 % všech CC.2,3 Tento nádor je agresivní a tichý, s nespecifickými příznaky až do pokročilých stadií, což vede k pozdní diagnóze a krátkému přežití bez operace 6 až 12 měsíců.4 Chirurgický zákrok, který je jedinou dostupnou kurativní možností, je v okamžiku stanovení diagnózy možný pouze u přibližně 47 % pacientů.5-8 Nejdůležitější prognostické faktory u tohoto nádoru obvykle souvisejí s možností chirurgického zákroku, přičemž nejdůležitějšími faktory jsou stadium nádoru, velikost, postižení ganglií a cév, intrahepatální metastázy a histologický typ.9-11
Anatomický prostor
Anatomický prostor, který zaujímá PHC, by byl vymezen vstupem do cystického vývodu na distální úrovni a bifurkací pravého a levého jaterního vývodu na proximální úrovni.1,12 Nejčastěji používaná klasifikace zahrnuje všechny CC, které vznikají ve žlučovém splavu nebo jeho okolí. Některé skupiny navrhují, že CC vycházející z jaterního parenchymu mohou někdy zasahovat do biliární konfluence s původem v anatomickém prostoru vymezeném zdrojem zadní větve pravé portální žíly a falciformním vazem.13-15 Tyto ICC zahrnující biliární konfluenci by se léčily stejně jako nádory s extrahepatálním původem a jejich přežití je podobné jako u PHC ve stejném stadiu. Obvykle se jedná o vysoce rozvinuté nádory s lokoregionální vaskulární a lymfatickou invazí. Pochybnosti o biologickém chování těchto nádorů vedly mnoho skupin k jejich vyloučení z perihilárních nádorů. Ve studii publikované Ebatou a kol.13,15 250 pacientů resekovaných pro CC s postižením splavu bylo stadium a přežití analyzováno podle toho, zda se jednalo o intrahepatální nádor s postižením splavu (ICC), nebo zda byl původ nádoru v extrahepatálním žlučovodu (PHC). Celkem 83 pacientů mělo ICC a 167 PHC. Při porovnání stadií vykazovali pacienti s ICC vyšší četnost postižení cév a lymfatických uzlin a TNM vyšší než ve skupině PHC, přičemž v 59 % případů se jednalo o stadium iii a iv ve srovnání s 38 % ve skupině PHC. Nicméně pokud se rozdělí přežití podle stadií v obou skupinách, nejsou v pěti letech statisticky významné rozdíly, s mírně vyšším celkovým přežitím ve skupině PHC (20 % vs 29 %, respektive; P=,057), takže byl učiněn závěr, že jsou z hlediska léčby a přežití srovnatelné. Se zdokonalením diagnostických testů a histopatologických poznatků budeme možná v budoucnu schopni lépe definovat, zda se jedná o 2 odlišné jednotky, nebo zda jsou klinicky a biologicky stejné.
Histopatologická charakteristika
90 % PHC jsou adenokarcinomy. V 10 % se jedná o adenoskvamózní nebo skvamózní karcinomy, které jsou v některých případech spojeny s anamnézou litiázy, cyst nebo anomálií žlučových cest. Podle vzhledu nádoru, typu růstu a biologického a klinického chování se PHC dělí na16,17:
- –
Tumorózní neboli „mass-forming“ CC: jedná se o nejčastější formu prezentace u ICC, i když se může vyskytovat i u velkého počtu PHC. Je charakterizována tvorbou nádorové masy s jasně ohraničenými okraji. Má výraznou fibrotickou reakci a častá je i centrální nekróza. Tento nádor vzniká v ústí žlučového vývodu, proniká do jeho stěny a šíří se trojrozměrným růstem a vytváří uzlovitou masu, která vyvolává obstrukční příznaky.16-19
- –
Infiltrační periduktální CC: nádory tohoto typu rostou podél žlučového vývodu v podobě koncentrického podélného ztluštění vazivovou tkání kolem vývodu a způsobují stenózu nebo úplnou obstrukci postiženého žlučového vývodu.19 Většina PHC je tohoto typu a je obtížné je identifikovat pomocí zobrazovacích technik.17
- –
Intraduktální nebo intraduktální papilární CC: tato varianta je charakterizována přítomností povrchových a intraluminálních nádorů ve žlučových cestách. Produkují mucin a způsobují částečnou obstrukci a dilataci vývodů.16 Tento nádor má nízký stupeň malignity a je obvykle malé velikosti, i když se může šířit žlučovým hlenem a dávat vznik vícečetným nádorům (papilomatóza nebo papilární karcinomatóza).20
Důležitost tohoto rozlišení spočívá v rozdílech v přežití v závislosti na daném podtypu. Několik studií ukázalo, že pacienti s intraduktálním papilárním typem mají lepší prognózu než pacienti se sklerálně-nodulárními varietami,21 s průměrným přežitím 55, resp. 33 měsíců,22 zatímco postižení cév a ganglií je u intraduktálního papilárního podtypu méně časté.
Shrnem lze říci, že většina PHC jsou adenokarcinomy s periduktálním růstem, který jim dává horší prognózu, zatímco varianta s intraduktálním růstem je nejméně častá, i když má lepší prognózu.
Stagingové systémy
Stagingové systémy pro PHC lze rozlišit na předoperační a pooperační klasifikaci. Z prvních, které se používají při plánování operace, je nejdůležitějším systémem Bismuthova-Corletteova klasifikace. Ta udává, který lalok je přednostně postižen, a ukazuje tedy typ hepatektomie, který by měl být použit (obr. 1).23 Tato klasifikace byla vynalezena v 70. letech 20. století a nezohledňuje postižení lymfatických uzlin ani metastázy, takže má nyní menší prognostickou hodnotu.
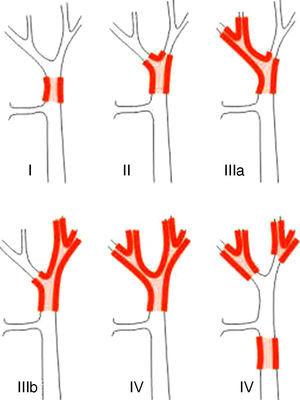
Klasifikace Bismuth-Corlette23.
Další předoperační klasifikací používanou v USA je klasifikace publikovaná Jarnaginem a spol.10 z Memorial Sloan Kettering Cancer Centre, New York. Cílem této klasifikace je předpovědět resekabilitu nádorů s přihlédnutím ke 3 faktorům lokálního rozšíření. Jedná se o biliární extenzi, vaskulární postižení a atrofii laloků. Tato klasifikace nebere v úvahu postižení lymfatických uzlin ani metastázy, takže má menší prognostickou hodnotu. Vzhledem k tomu, že resekabilita se v jednotlivých skupinách liší a zároveň je tendence ke stále agresivnější léčbě, bude její hodnota záviset na kritériích neresekability jednotlivých center. Lokální postižení by nyní nemělo být kritériem neresekability za předpokladu, že jsme schopni chirurgickou resekcí dosáhnout R0.
Z pooperačních klasifikací se nejčastěji používá TNM klasifikace Unie pro mezinárodní kontrolu rakoviny (UICC), sedmé vydání.12 Tato klasifikace zohledňuje patologické údaje, jako je lokální rozšíření, cévní postižení, postižení lymfatických uzlin a metastázy, a vytváří tak klasifikaci, která zahrnuje rozšíření nádoru a má prognostický charakter.
Nedávno zveřejnila „Japanese Study Group on Perihilar Cholangiocarcinoma“ (JSGPH) studii, která navrhla úpravu klasifikace „Union for International Cancer Control“. Základní rozdíly jsou uvedeny v tabulce 1 a spočívají především v tom13:
-
Nepovažovat Bismut IV za T4. Klasifikace JSGPH tedy nezohledňuje bilaterální biliární rozšíření jako špatnou prognózu, pokud je dosaženo R0 resekce.
-
S ohledem na stádia upřednostňuje postižení lymfatických uzlin jako nejhorší prognózu. Proto považují postižení lymfatických uzlin za stadium iva a nikoliv iiib (TNM7).
Srovnání základních rozdílů mezi klasifikací UICC TNM 7 a návrhem JSGPH.
| Klasifikace nádorů | UICC | návrh JSGPH | |
|---|---|---|---|
| Tis. | Karcinom in situ | ||
| T1 | Nádor omezený na žlučové cesty | ||
| T2a | Nádor omezený na žlučové cesty | Překračuje stěnu vývodu a zasahuje do perihilární tukové tkáně | |
| T2b | Zasahuje do jaterního parenchymu | ||
| T3 | Jednostranná invaze do jaterní tepny/žíly | ||
| T4 | Invaze do hlavní větve HA/PV, Bismut IV, nebo Bismuth III s kontralaterální invazí A/V | Invaze hlavní větve HA/PV, s oboustrannou vaskulární nebo kontralaterální invazí | |
| TNM stadium | |||
| 0 | Tis N0 M0 | ||
| I | T1 N0 M0 | ||
| II | T2 N0 M0 | ||
| IIIa | T3 N0 M0 | ||
| IIIb | T1-3 N1 M0 | T4 N0 M0 | |
| Iva | T4 N× M0 | T× N1 M0 | |
| Ivb | T× N× M1 | ||
HA, jaterní tepna; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, metastázy v lymfatických uzlinách nádoru; UICC, Union for International Cancer Control; PV, portální žíla.
Na evropské úrovni byl vytvořen mezinárodní registr perihilárních nádorů léčených chirurgicky, který vede „International Cholangiocarcinoma Group for the Staging of PHC“. Tato skupina zveřejnila novou klasifikaci1 , která zohledňuje velikost nádoru spolu s biliárním, venózním, arteriálním, gangliovým a metastatickým postižením, a to předoperačně i pooperačně. Nicméně omezení této klasifikace spočívají v tom, že pouze popisuje charakteristiky nádoru a operaci, která má být provedena, aniž by dále rozdělovala pacienty do skupin nebo stadií podle těchto proměnných. V důsledku toho není možné vyvozovat prognostické závěry a není ani možné porovnávat výsledky různých skupin.
Předchozí publikace ukazují, že předoperační klasifikací, která se nyní nejčastěji používá k rozhodnutí o typu resekce, je Bismuthova-Corletteova klasifikace, zatímco k určení dlouhodobé prognózy se používá klasifikace TNM7.
Diagnostické strategie
Příznaky spojené s PHC jsou častěji: žloutenka (90 %), úbytek hmotnosti a bolesti břicha (35 %), pruritus (26 %) a akutní cholangitida (10 %).17 Vzhledem k těmto příznakům se počáteční diagnóza obvykle stanoví pomocí ultrazvuku břicha, a to je dobré screeningové vyšetření. Dalšími diagnostickými testy u tohoto typu nádoru by byly:
- –
Dopplerovský ultrazvuk břicha: umožňuje zhodnotit arteriální a portální propustnost (trombózu), což může podmínit resekabilitu nádoru a terapeutickou strategii, i když není testem volby pro hodnocení cévního postižení.
- –
Břišní počítačová axiální tomografie: je užitečná pro diagnostiku primárního nádoru a rozšíření onemocnění, s 80% senzitivitou při hodnocení rozšíření žlučových cest. Jedná se o techniku volby pro předoperační hodnocení cévní anatomie se senzitivitou 93 % při hodnocení arteriálního a 87 % při hodnocení portálního postižení. Má nízkou citlivost pro předoperační hodnocení postižení lymfatických uzlin (50 %).14,24 Je také užitečná při provádění volumetrických testů a výpočtu objemu jater, který zbývá po chirurgické resekci. Je také nejekonomičtějším vyšetřením pro předoperační staging.
- –
Magnetická rezonance a magnetická rezonanční cholangiografie (RM-cholangiografie): nejlepší vyšetření pro diagnostiku primárního nádoru a pro hodnocení biliárního rozšíření. Má senzitivitu 86-100 %, je lepší než přímá cholangiografie a zároveň se jedná o neinvazivní vyšetření.25 Na druhou stranu má nízkou citlivost pro hodnocení vaskulárního postižení (73 %) a citlivost 80 % pro invazi do jaterního parenchymu.
- –
Přímá cholangiografie: endoskopická retrográdní cholangiopankreatografie (ERCP) a transparietální jaterní cholangiografie (TPHC): ty nás informují o úrovni biliární obstrukce a umožňují odebrat vzorky z léze na cytologii, přičemž senzitivita je 20 %. V současné době byly v diagnostice nahrazeny MR-cholangiografií. Jsou velmi užitečné při předoperační biliární drenáži a při paliativní léčbě PHC se zavedením přednostně pokovených stentů.26-28
- –
Endoskopický ultrazvuk: je užitečný pro hodnocení postižení ganglií v oblasti celiakálního kmene a peripankreatické oblasti, stanovení předoperačního stagingu a umožňuje odebrat tenkojehlovou aspirační biopsii.
- –
Pozitronová emisní tomografie: je užitečná při studiu pacientů s podezřením na metastatické postižení i na postižení adenopatií v oblasti celiakálního kmene. Její senzitivita je kontroverzní a může se pohybovat od 38 % do 90 % v závislosti na publikovaných sériích.14,24,29
- –
Nádorové markery: jejich užitečnost je omezená, nejčastěji se používá CA 19,9. V případě, že se jedná o nádorové markery, je jejich užitečnost omezená. Většina studií je hodnotila u neoplazií pankreatu a v menší míře u CC, aniž by specifikovala jejich lokalizaci nebo charakteristiky. Hladiny těchto markerů v séru jsou silně ovlivněny biliární obstrukcí a žloutenkou v důsledku jejich biliární eliminace. Byly navrženy různé normální hodnoty v závislosti na přítomnosti hepatopatie (300U/ml) nebo žloutenky (1000U/ml), zatímco u karcinomu pankreatu se dosahuje senzitivity vyšší než 70 % s úrovní specificity vyšší než 95 %. Jeho koncentrace u těchto pacientů značně kolísá a nekoreluje s velikostí nádoru, i když koreluje s metastatickým postižením. Senzitivitu a specificitu tohoto markeru lze zvýšit jeho kombinací s CEA, a to především u případů Lewis A negativních (neprodukujících CA 19.9).30
Z výše uvedených údajů lze vyvodit, že pro diagnostiku PHC obvykle zahajujeme studii pomocí ultrazvukového vyšetření. To se provádí v souvislosti s pacientem se žloutenkou, zatímco počítačová tomografie a MR-cholangiografie jsou nejlepšími stagingovými vyšetřeními, která lze doporučit před operací. Pro volumetrické vyšetření lze použít MR nebo počítačovou tomografii v závislosti na typu přístroje nebo počítačových programů, které jsou v jednotlivých nemocnicích k dispozici. V případě pochybností o rozšíření do lymfatických uzlin, které mohou kontraindikovat operaci, se doporučuje pozitronová emisní tomografie nebo aspirační endoskopie tenkou jehlou.
Kritéria neresekovatelnosti
Operace je jedinou kurativní léčbou PHC a nabízí nejlepší dlouhodobé přežití. Kritéria přijatá pro chirurgickou resekci se v posledních letech rozšířila, od kritérií popsaných původně týmem z Memorial Sloan Kettering Cancer Center Burke et al.31 v roce 1998 až po nedávné zavedení přístupů využívajících cévní resekci a rozšířenou hepatektomii.3,5,32-34 Kritéria neresekability se v jednotlivých nemocnicích liší a nejrozšířenější jsou: cévní postižení na jedné straně s kontralaterálním postižením žlučových cest až po rozdělení radikálů druhého stupně, vzdálené jaterní metastázy, cévní postižení obou jaterních laloků, extrahepatální nebo peritoneální postižení a adenopatické postižení celiakálního kmene, horní mezenterické tepny nebo paraaortální oblasti.3,5,8,31
V multicentrické studii publikované De Jongem a kol.34 , která analyzovala 305 pacientů operovaných pro PHC v 7 různých centrech v USA a Evropě a která zahrnovala pacienty s portálním postižením, byly v multivariační analýze jedinými 2 statisticky významnými prognostickými faktory postižení resekčního okraje a postižení lymfatických uzlin (P=,02). Ve studii publikované Ebatou a kol.15 , která analyzovala 1352 pacientů operovaných v 8 japonských nemocnicích pro PHC s kurativním záměrem, ukázala multivariabilní analýza statisticky významných prognostických faktorů, že jimi jsou: vaskulární invaze, invaze pankreatu, postižení lymfatických uzlin, přítomnost metastáz a postižení resekčního okraje. Postižení lymfatických uzlin a metastázy byly faktory, které vedly k horšímu přežití po 5 letech ve srovnání s ostatními (10 %, 20 % a 63 %). Tyto výsledky podporují použití chirurgického zákroku u těchto nádorů, pokud je i přes lokální rozšíření možné provést R0 resekci, vzhledem k tomu, že je možné prodloužit přežití na 5 let bez ohledu na lokální rozšíření.
Vzhledem ke všem výše uvedeným skutečnostem se doporučuje posuzovat každý případ individuálně a použít chirurgický zákrok, pokud je možné dosáhnout R0 resekce při absenci vzdálených metastáz nebo postižení peritonea. Oboustranné biliární a lokální cévní postižení by proto nemělo být kritériem neresekability, pokud je možné operovat při zachování více než 30 % objemu jater a dosažení onkologické resekce.
Terapeutické strategieBiliární drenáž
Vzhledem k tomu, že většina pacientů s PHC debutuje se žloutenkou, je jedním z nejdůležitějších dilemat užitečnost předoperační biliární drenáže. Ta však není prosta komplikací a ty, které jsou spojeny s ERCP se zavedením stentu, jsou: pankreatitida, perforace duodena, migrace duodena, obstrukce katétru a především cholangitida. Drenáž pomocí CTPH představuje nižší frekvenci předoperační cholangitidy, ale je spojena s krvácením, migrací katétru, až 5% šířením nádoru v trajektorii katétru a nepříjemnými pocity a bolestí ve vstupní zóně. Celkově je podle publikovaných studií s ERCP spojena morbidita ve výši 60 % a odpovídající hodnota pro CTPH je 31 %.14,35
Z výše uvedených důvodů byla užitečnost předoperační biliární drenáže při hepatobiliopankreatické chirurgii zpochybněna.36,37 Tyto studie, které zahrnují všechny typy hepatobiliární chirurgie, ukázaly, že předoperační biliární drenáž u pacientů se žloutenkou zvyšuje přidruženou morbiditu, aniž by zlepšila přežití, především zvyšuje komplikace zahrnující infekce. Evropská multicentrická studie publikovaná v roce 2013 Fargesem a spol.38 retrospektivně analyzovala 366 pacientů, kteří podstoupili hepatektomii nebo rozšířenou hepatektomii a biliární resekci z důvodu PHC. Byli klasifikováni podle toho, zda byla či nebyla provedena předoperační biliární drenáž. Skupinu bez předoperační drenáže (non-PBD) tvořilo 186 pacientů a skupinu s biliární drenáží (PBD) 180 pacientů. Skupiny byly homogenní z hlediska věku, stadia nádoru a portální resekce. Ve skupině s PBD bylo provedeno více pravostranných hepatektomií (56 % oproti 44 %). Při porovnání obou skupin podle typu provedené operace vykazovali pacienti, u nichž byla provedena pravostranná hepatektomie, vyšší počet pooperačních selhání jater, pokud patřili do skupiny bez PBD, s incidencí 16 % oproti 4 % ve skupině s PBD (P=,009). V multivariabilní analýze faktorů spojených s vyšší mortalitou ve skupině s pravostrannou hepatektomií byla statisticky významným faktorem hladina bilirubinu pod 3 mg/dl před operací. Pokud však byly porovnány obě skupiny pacientů s levostrannou hepatektomií, ve skupině s PBD se vyskytoval vyšší počet pooperačních sepsí, a to s incidencí 6 % ve srovnání s 0 % ve skupině bez PBD (P=,014). Tato studie ukazuje, že ačkoli je pravda, že biliární drenáž zvyšuje výskyt pooperační sepse, biliární drenáž by měla být prováděna u těch pacientů, kteří se chystají podstoupit pravostrannou hepatektomii, aby se snížila morbidita spojená s pooperačním selháním jater, a tuto teorii podporují i další studie.39 Vzhledem k tomu, že při léčbě PHC jediné studie, které prokázaly vyšší přežití, jsou ty, které podporují rozsáhlé resekce k dosažení R0 resekce, doporučuje se biliární drenáž v případě, že je indikována operace, která si případně vyžádá rozsáhlou hepatektomii více než 50 % objemu jater nebo trisegmentektomii, nebo pokud je přítomna cholangitida. O hraniční hodnotě hladiny bilirubinu pro indikaci drenáže se vedou spory, mezi nejčastěji používané patří >10mg/dl.5,37 Doporučuje se provést biliární drenáž pomocí CTPH s umístěním zevní drenáže, čímž se zabrání manipulaci s nádorem. Tento postup má nižší výskyt infekcí než CPRE a umožňuje u pacientů s jednostrannou drenáží, u nichž nedojde k normalizaci hladiny bilirubinu, použít oboustrannou biliární drenáž.35,40
Diseminace nádoru v místě vpichu byla popsána až v 5-10 % případů, kdy byla použita CTPH,14,24 ačkoli tyto studie neuvádějí, kdy byla použita zevní nebo vnitřní-zevní drenáž, a nezohledňují dobu, která uplynula do operace. Někteří autoři doporučují použití endoskopicky umístěné nazobiliární drenáže, aby se zabránilo diseminaci v místě punkce, s nižším výskytem cholangitidy a obstrukce stentu, než je tomu v případě CPRE.41 Stejné studie však přiznávají obtížnost předoperační bilaterální biliární drenáže pomocí tohoto systému, což brání normalizaci hladin bilirubinu před operací u pacientů, u nichž selhala jednostranná drenáž.42
Pro snížení morbidity spojené s infekcemi po předoperační biliární drenáži se navrhuje, aby byla žluč po drenáži a během operace systematicky kultivována. Několik studií prokázalo, že 78-94 % těchto kultur je pozitivních u pacientů s drenáží, na rozdíl od 20-30 % u pacientů bez drenáže,43-45 a nejčastěji izolovaným organismem je enterokok. Tyto skupiny obhajují používání profylaktických antibiotik, která sice zvyšují rezistenci izolovaných druhů k antibiotikům, ale v publikovaných studiích se ukazuje, že se tím dosahuje podobné morbidity pooperačních infekcí jako u nedrenovaných skupin. Zvolené antibiotikum závisí na kultivaci a antibiogramu, ačkoli většina skupin použila alespoň cefalosporin třetí generace nebo fluorochinolony + metronidazol, pokud nebyla k dispozici kultivace nebo pokud byla negativní.43,44,46
Paliativní biliární drenáž se používá u pacientů, kteří nemohou podstoupit resekci. Drenáž může být provedena pomocí ERCP s ponecháním potaženého kovového stentu nebo pomocí CTPH v případech, kdy není možné dosáhnout správné drenáže obou žlučových cest pomocí ERCP.
Takto definitivně by měla být předoperační biliární drenáž použita u všech pacientů s bilirubinem vyšším nebo rovným 10 mg/dl a u těch, kde jaterní resekce bude představovat více než 50 % objemu jater. Typ přístupu závisí na nemocnici, ačkoli se doporučuje CTPH se zevní drenáží, aby se zabránilo manipulaci s nádorem a nižšímu výskytu cholangitidy. Někteří autoři doporučují, aby drenovaní pacienti dostávali profylakticky antibiotika vhodná pro jejich žlučové kultury.
Předoperační portální embolizace
Předoperační portální embolizace byla popsána v 80. letech 20. století, nejprve Makuuchim a spol.47 a poté Kinoshitou a spol.48 Cílem portální embolizace je zvětšit zbývající objem jater v těch případech, kdy je v předoperační volumometrii považován za nedostatečný, a snížit tak pravděpodobnost pooperačního selhání jater. V metaanalýze, kterou nedávno publikovali Higuchi a Yamamoto49 a která zahrnovala 836 pacientů s PHC s předoperační portální embolizací, byla morbidita 1 % a mortalita 0,09 %. Progrese nádoru během zákroku, která zabránila operaci, činila 19,4 %. Tyto výsledky podporují myšlenku, že její použití u PHC je opodstatněné u těch pacientů, u nichž zbývající předoperační objem jater činí méně než 30 %.
Stagingová laparoskopie
S rozvojem senzitivity a specificity neinvazivních zobrazovacích vyšetření v posledních letech ustupuje stagingová laparoskopie do pozadí. Nejdůležitějšími kritérii neresekability jsou postižení lymfatických uzlin, rozšíření žlučových cest a cévní invaze. Ta se při laparoskopii, jejíž přesnost a účinnost již několik let klesá, hodnotí obtížně. Svědčí o tom nedávná revize Rotellara a Parda,50 v níž přesnost a účinnost činily v roce 2002 41 %, resp. 72 %, a ve studiích publikovaných v roce 2011 14 %, resp. 32 %. Tento pokles je způsoben především zlepšením neinvazivních testů, jako je MR-cholangiografie. Její účinnost se zvyšuje, pokud jsou vybráni pacienti s vysokým rizikem výskytu peritoneální diseminace nebo jaterních metastáz, čímž se předchází zbytečným laparotomiím.50-52 Neinvazivní zobrazovací techniky se doporučují u pokročilých stadií (T2/3/4), která představují možné pokročilé postižení peritonea nebo lymfatických uzlin a která nelze před vytvořením předoperační biliární drenáže punktovat pomocí echoendoskopie. Vždy provádíme stagingovou laparoskopii s využitím intraoperačního ultrazvukového vyšetření, abychom zlepšili citlivost na lokoregionální postižení a postižení lymfatických uzlin.53
Chirurgická léčba
Chirurgická léčba je stále jedinou kurativní léčbou PHC,3,14 a dosahuje 20-40% míry přežití po 5 letech (tabulka 2).10,11 Chirurgická resekce musí být provedena vždy, pokud je možné dosáhnout R0 resekce. Hlavními faktory, které ovlivňují přežití po operaci, jsou postižení resekčních okrajů, a to buď mikroskopicky (R1), nebo makroskopicky (R2) spolu s postižením lymfatických uzlin (N1 a N2).14,17,44,54 Několik studií prokázalo, že přežití se zvyšuje, pokud je resekce rozšířena tak, aby vznikly negativní okraje.3,5,33,45 Navrhované techniky zahrnují rozšířenou hepatektomii s resekcí kaudálního segmentu, biliární resekci, hilovou lymfadektomii až po celiakální kmen a rekonstrukci s hepatojejunostomií.
Přežití po resekci PHC podle publikovaných sérií.
| Autor | Rok | Případy | Přežití v 5 letech (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20,2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Přežití po resekci jater z důvodu perihilárního cholangiokarcinomu.
Pouze 2 roky sledování.
„No-touch technika“ poprvé popsaná Neuhausem a kol.32. spočívá v blokové resekci jaterního hilu bez manipulace s nádorem, což zvyšuje přežití pacientů na 5 let ve více než 15 % případů.3,33,34,55 Tato technika v podstatě spočívá v resekci portální žíly a pravé jaterní tepny, pokud jsou v blízkosti nádoru, čímž se zabrání jejich disekci, pokud by to znamenalo manipulaci s nádorem, spolu s kompletní resekcí žlučových cest s širokou lymfadenektomií až ke kořeni celiakálního kmene a rekonstrukcí s hepatikojejunostomií. Bude vhodnější vybrat pravý jaterní lalok (základní „nedotyková technika“ podle Neuhause)33 za podmínky, že rozšíření nádoru umožní zahrnout pravou jaterní tepnu, která je nejblíže nádoru. Tento typ radikální operace vede k přijatelné míře pooperační morbidity, která činí 50-70 % v závislosti na dané sérii, s mortalitou 10-20 %.3,5 Přežití pacientů s PHC po 5 letech činí 20-40 %, zatímco publikované studie, které zahrnují portální resekci, a série využívající „techniku bez doteku“ dosahují 58 % po 5 letech (obr. 2 a 3).3,5,33
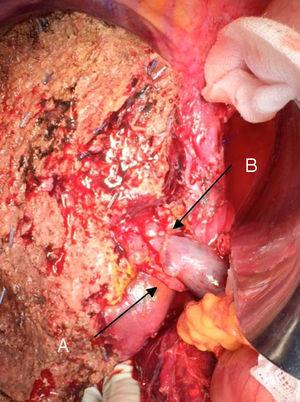
Levá hepatektomie pro Klatskinův tumor s resekcí portální žíly: (A) pravá jaterní tepna horního mezenteria; (B) portální žíla.
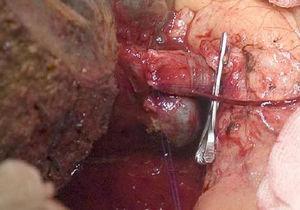
Pravá hepatektomie s rekonstrukcí portální žíly.
Je také důležité zdůraznit nedávné studie, které ukazují zvýšení přežití pacientů s předoperačním cévním postižením po resekci portální žíly. Dosahují dokonce míry přežití, která je stejná nebo vyšší než u pacientů bez předoperačního cévního postižení, kteří tedy nebyli podrobeni portální resekci.33,56,57 V těchto studiích je výskyt jaterních a cévních komplikací podobný jako ve skupině bez portální resekce, s výjimkou pacientů, kteří byli podrobeni arteriální resekci, neboť ti vykazují vyšší míru morbimortality než ostatní. Vzhledem ke všem těmto skutečnostem se u pacientů s jednostranným portálním postižením nebo postižením spojky v předoperačních testech doporučuje operace, provedení en-bloc resekce a cévní rekonstrukce. Resekce a rekonstrukce tepny se nedoporučuje, pokud není jasně postižena tepna, protože to je spojeno s horšími pooperačními výsledky, takže v takových případech je vhodnější pravostranná hepatektomie.
Shrnem lze říci, že chirurgické zásady, které je třeba dodržovat, budou následující: radikální operace s resekcí žlučových cest a kaudy a lymfadenektomií, s R0 okraji a bez manipulace s nádorem, i když to zahrnuje resekci a rekonstrukci portální žíly a jaterní tepny.
Závěry
V současné době spočívá jediná kurativní léčba v chirurgické resekci. Radikální en-bloc resekce a cévní rekonstrukce je technika, která dosahuje dlouhodobě nejvyšší míry přežití. Ke snížení pooperační morbimortality je vhodné provést biliární drenáž k prevenci jaterního selhání, s antibiotickou profylaxí po drenáži a portální embolizací, pokud bude budoucí zbývající objem jater menší než 30 %. R0 resekce, postižení lymfatických uzlin a vzdálené metastázy jsou stále nejdůležitějšími prognostickými faktory.
Konflikt zájmů
Tato revize nebyla prezentována ani částečně či zcela publikována v žádném časopise či na žádném kongresu.
.