![]()
![]()
Schváleno:Dolutegravir (DTG) ![]() !(image)./resources/AIDSinfo.gif!,Elvitegravir (EVG)
!(image)./resources/AIDSinfo.gif!,Elvitegravir (EVG) ![]() !(obrázek)./resources/AIDSinfo.gif!,Raltegravir (RAL)
!(obrázek)./resources/AIDSinfo.gif!,Raltegravir (RAL) ![]() !(obrázek)./resources/AIDSinfo.gif!
!(obrázek)./resources/AIDSinfo.gif!
Mezinhibiční mechanismus
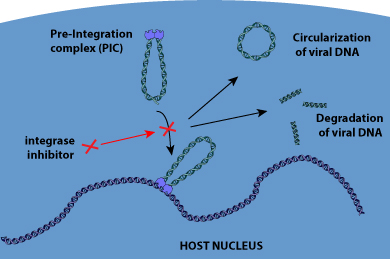
HIV integráza se stala novým lékovým cílem. Po reverzní transkripci se protein integrázy sestaví s virovou DNA do stabilního komplexu, označovaného jako preintegrační komplex (PIC), a vstoupí do jádra hostitele. Tam integráza zprostředkovává integraci komplementární DNA (cDNA) do hostitelského genomu ve dvou krocích. Nejprve jsou z 3′-konců virové DNA vyříznuty dva nukleotidy. Poté dojde ke kovalentnímu vložení virové DNA HIV do hostitelského chromozomu. Inhibitor integrázy Raltegravir interaguje s dvojmocnými kovy v aktivním místě HIV-1 integrázy. Tato interakce inhibuje vkládání virové DNA do hostitelského chromozomu (proces přenosu vlákna). Elvitegravir je rovněž specifickým inhibitorem kroku přenosu vlákna při integraci HIV . Dolutegravir (DTG) je jediným INSTI druhé generace, který byl schválen FDA v roce 2013
. Dolutegravir (DTG) je jediným INSTI druhé generace, který byl schválen FDA v roce 2013 .
.
Nežádoucí účinky a metabolismus
Nejčastějšími nežádoucími účinky inhibitorů integrázy jsou gastrointestinální příhody, včetně nevolnosti/zvracení nebo průjmu, a také bolesti hlavy, nervového systému a neuropsychiatrické účinky
Frederick J. Lee, Andrew Carr
Curr Opin HIV AIDS September 2012; 7: 422?428
.