Sulfonace methylbenzenu
Methylbenzen je reaktivnější než benzen, protože methylová skupina má tendenci „tlačit“ elektrony směrem ke kruhu.
Důsledkem této větší reaktivity je, že methylbenzen bude reagovat s dýmavou kyselinou sírovou při teplotě 0 °C a s koncentrovanou kyselinou sírovou, pokud se zahřívají pod zpětným tokem po dobu asi 5 minut.
Kromě vlivu na rychlost reakce je u methylbenzenu třeba myslet také na to, kde na kruhu skončí skupina kyseliny sulfonové vzhledem k methylové skupině. Methylové skupiny mají tendenci „směrovat“ nové skupiny do poloh 2- a 4- na kruhu (za předpokladu, že methylová skupina je v poloze 1-). Říká se, že methylové skupiny jsou 2,4-směrové.
Tak získáte směs, která se skládá převážně ze dvou izomerů. Vzniká pouze asi 5-10 % 3-izomeru. Hlavní reakce jsou:
![]()
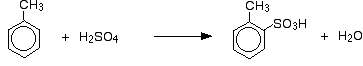
a:
![]()
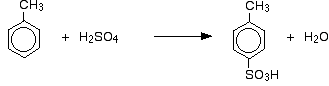
V případě sulfonace závisí přesný podíl vzniklých izomerů na teplotě reakce. Se zvyšující se teplotou se zvyšuje podíl 4-izomeru a snižuje podíl 2-izomeru. Je to proto, že sulfonace je vratná. Skupina kyseliny sulfonové může z kruhu opět odpadnout a znovu se připojit na jiné místo. To podporuje vznik termodynamicky nejstabilnějšího izomeru. K této záměně dochází spíše při vyšších teplotách.
4-izomer je stabilnější, protože v molekule nedochází ke znepřehlednění, jako by tomu bylo, kdyby methylová skupina a skupina kyseliny sulfonové byly vedle sebe.