Door Alyssa Cecchetelli en Lukas Morgan
Modelorganismen zijn vitale instrumenten die door onderzoekers over de hele wereld worden gebruikt. Deze organismen delen veel genen met de mens, kunnen gemakkelijk in het lab worden gehouden en hebben korte generatietijden, waardoor het gemakkelijk is om de effecten van genetische manipulaties te bestuderen. In deze blogbijdrage behandelen we vijf populaire modelorganismen, maar er zijn er nog veel meer.
De huismuis (Mus musculus)
 Laten we beginnen met het zoogdiermodelorganisme waaraan veel onderzoekers de voorkeur geven: de muis (Mus musculus). Muizen hebben vele voordelen als modelorganisme voor wetenschappers: zij hebben een voor zoogdieren relatief korte generatietijd – de tijd tussen geboorte en bevalling – van ongeveer 10 weken. Volwassen muizen planten zich om de drie weken voort, zodat wetenschappers tegelijkertijd verschillende generaties muizen kunnen observeren.
Laten we beginnen met het zoogdiermodelorganisme waaraan veel onderzoekers de voorkeur geven: de muis (Mus musculus). Muizen hebben vele voordelen als modelorganisme voor wetenschappers: zij hebben een voor zoogdieren relatief korte generatietijd – de tijd tussen geboorte en bevalling – van ongeveer 10 weken. Volwassen muizen planten zich om de drie weken voort, zodat wetenschappers tegelijkertijd verschillende generaties muizen kunnen observeren.
Omdat muizen genetisch en fysiologisch meer op de mens lijken dan veel andere modelorganismen, worden zij vaak gebruikt om ziekten bij de mens te bestuderen. Ziekten bij muizen vertonen veel vergelijkbare fenotypen als menselijke ziekten en hebben onderzoekers met succes geholpen bij de ontwikkeling van een verscheidenheid aan therapieën. Veel wetenschappers gebruiken bijvoorbeeld muizen om ziekten zoals kanker te bestuderen, aangezien muizen de complexe interacties tussen kankercellen, therapeutische geneesmiddelen en de rest van het lichaam beter nabootsen dan studies in andere modelorganismen of celkweek. Zo heeft het laboratorium van Scott Lowe muizen gebruikt om te bestuderen hoe verschillende mutaties in leukemie verschillende behandelingsregimes beïnvloeden (Zuber et al., 2009). Door muizen te injecteren met retrovirale vectoren die verschillende mutaties bevatten die bij leukemie worden aangetroffen, kon het laboratorium van Lowe een reeks mutaties identificeren die kankercellen resistenter maken tegen chemotherapie. U kunt deze plasmiden vinden bij Addgene.
Een ander voordeel van muizen als modelorganismen is dat ze genetisch handelbaar zijn. Muizen kunnen gemakkelijk worden gemanipuleerd met hulpmiddelen zoals CRISPR om transgene lijnen te maken.
De fruitvlieg (Drosophila melanogaster)
 Een ander populair modelorganisme is Drosophila melanogaster, of zoals het beter bekend is: de fruitvlieg. De fruitvlieg wordt al meer dan een eeuw voor wetenschappelijk onderzoek gebruikt, maar werd op de voorgrond geplaatst door Thomas Hunt Morgan, die bekend staat als de “vader” van het Drosophila-onderzoek. Morgan ontdekte dat genen zich binnen chromosomen bevonden met behulp van de fruitvlieg, ver voordat we zelfs maar wisten dat DNA genetisch materiaal was (Jennings, 2011).
Een ander populair modelorganisme is Drosophila melanogaster, of zoals het beter bekend is: de fruitvlieg. De fruitvlieg wordt al meer dan een eeuw voor wetenschappelijk onderzoek gebruikt, maar werd op de voorgrond geplaatst door Thomas Hunt Morgan, die bekend staat als de “vader” van het Drosophila-onderzoek. Morgan ontdekte dat genen zich binnen chromosomen bevonden met behulp van de fruitvlieg, ver voordat we zelfs maar wisten dat DNA genetisch materiaal was (Jennings, 2011).
De fruitvlieg is een geweldig modelorganisme omdat ze gemakkelijk en goedkoop te kweken en te onderhouden zijn in het lab, een korte levenscyclus hebben van 8 tot 14 dagen, en een groot aantal nakomelingen voortbrengen die uitwendig worden gelegd. Fruitvliegen zijn ook betrekkelijk eenvoudig genetisch te manipuleren. Wetenschappers kunnen een nieuwe vliegenlijn maken in slechts 6 weken, vergeleken met maanden om een transgene muizenlijn te maken. In de loop der jaren is de vlieg uitgegroeid tot een ideaal modelorganisme om een scala van onderwerpen te bestuderen, waaronder ontwikkeling, genetica en het zenuwstelsel. De vlieg is ook naar voren gekomen als een belangrijk menselijk ziektemodel met potentieel voor therapeutische ontdekking van geneesmiddelen, omdat geschat wordt dat 75% van de ziekte veroorzakende genen bij de mens een functionele homoloog in de vlieg hebben (Pandey en Nichols, 2011).
Een groot voordeel van het gebruik van de fruitvlieg is de reeks van genetische tools, zoals de GAL4/UAS en LexA systeem, waarmee wetenschappers gemakkelijk het niveau en de spatiotemporele expressie van een gen van belang kunnen controleren. Dit type van controle over genexpressie is mogelijk in andere modelsystemen maar kan vrij moeilijk en tijdrovend zijn. GAL4/UAS werd voor het eerst beschreven in 1993 door het laboratorium van Norbert Perrimon en is sindsdien voortdurend verbeterd. Als u geïnteresseerd bent in deze systemen kijk dan eens naar het lab van Gerald Rubin, die een set modulaire vectoren creëerde die kunnen worden gebruikt om genexpressie optimaal te controleren in specifieke cellen van de vlieg (Pfeiffer et al., 2010).
Gist (Saccharomyces cerevisiae)
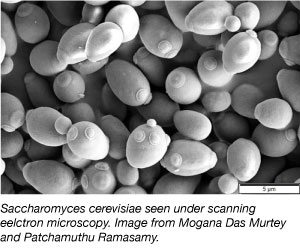 Gist, een van de eenvoudigste eukaryotische organisme, is een veelgebruikt modelorganisme in wetenschappelijk onderzoek. Ja, dezelfde soort die we gebruiken in brood en andere gebakken producten! Gist is goedkoop, eenvoudig en gemakkelijk om mee te werken, omdat het kan overleven in uiteenlopende milieuomstandigheden, en zich elke 2 uur kan verdubbelen. Gist is ook het eerste eukaryote genoom dat volledig gesequenced is en is zeer vatbaar voor genetische manipulatie.
Gist, een van de eenvoudigste eukaryotische organisme, is een veelgebruikt modelorganisme in wetenschappelijk onderzoek. Ja, dezelfde soort die we gebruiken in brood en andere gebakken producten! Gist is goedkoop, eenvoudig en gemakkelijk om mee te werken, omdat het kan overleven in uiteenlopende milieuomstandigheden, en zich elke 2 uur kan verdubbelen. Gist is ook het eerste eukaryote genoom dat volledig gesequenced is en is zeer vatbaar voor genetische manipulatie.
Gistcellen zijn geweldige modelorganismen, niet alleen om bovenstaande redenen, maar omdat ze in feite veel biologische eigenschappen en processen delen met onze eigen cellen. Net als menselijke cellen is het DNA van gist verpakt in chromosomen en ongeveer 23% van de gistgenen heeft een tegenhanger in de mens (Liu et al., 2017) . Zo kan gist worden gebruikt om de moleculaire basis te bestuderen van menselijke ziekten die worden veroorzaakt door een specifiek gen. Zo hebben verschillende genen die gemuteerd zijn in menselijke kankers een homoloog dat betrokken is bij de celdeling in gist (Pray, 2008). Wetenschappelijke ontdekkingen in gist kunnen vervolgens verder worden bestudeerd in andere modelorganismen die in vivo omstandigheden vergelijkbaar met de mens beter nabootsen.
Gist is bijvoorbeeld vanwege zijn eenvoud een belangrijk experimenteel model geworden bij het bestuderen van neurologische ziekten, zoals de ziekte van Parkinson (PD). PD wordt vooral gekenmerkt door eiwitmisvouwing die leidt tot een opeenhoping van eiwitaggregaten die “lewy bodies” worden genoemd in de hersenen. Gistmodellen van PD, zoals die waarin het toxische eiwit α-synucleïne (het meest voorkomende eiwit in lewy bodies) wordt overgeëxpresseerd, zijn van onschatbare waarde gebleken voor het begrijpen van de fundamentele moleculaire mechanismen die ten grondslag liggen aan de ziekte (Menezes et al., 2015). Aangezien gist eencellige organismen zijn, kunnen ze ook worden gebruikt om gemakkelijk meerdere therapeutische verbindingen in één experiment te screenen.
Zebravis (Danio rerio)
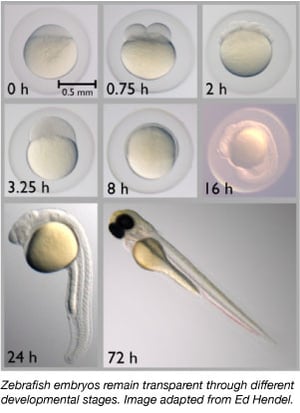 Sinds de jaren zestig is de zebravis geleidelijk uitgegroeid tot een belangrijk modelorganisme. Ze delen ongeveer 70% van hun genen met de mens en 85% van de menselijke genen die geassocieerd worden met een ziekte hebben een homoloog in de zebravis (Howe et al., 2013). Zebravissen zijn klein, gemakkelijk te onderhouden omdat ze in grote groepen worden gehuisvest, gemakkelijk te kweken, en produceren 50-300 eitjes per keer. Zebravisembryo’s worden ook uitwendig gelegd en bevrucht, waardoor wetenschappers ze gemakkelijk kunnen manipuleren. Wetenschappers kunnen eencellige embryo’s eenvoudig injecteren met DNA of RNA om hun genoom te bewerken of om transgene dieren te creëren.
Sinds de jaren zestig is de zebravis geleidelijk uitgegroeid tot een belangrijk modelorganisme. Ze delen ongeveer 70% van hun genen met de mens en 85% van de menselijke genen die geassocieerd worden met een ziekte hebben een homoloog in de zebravis (Howe et al., 2013). Zebravissen zijn klein, gemakkelijk te onderhouden omdat ze in grote groepen worden gehuisvest, gemakkelijk te kweken, en produceren 50-300 eitjes per keer. Zebravisembryo’s worden ook uitwendig gelegd en bevrucht, waardoor wetenschappers ze gemakkelijk kunnen manipuleren. Wetenschappers kunnen eencellige embryo’s eenvoudig injecteren met DNA of RNA om hun genoom te bewerken of om transgene dieren te creëren.
Zebravisjes zijn een ideaal modelorganisme voor embryonale ontwikkelingsstudies, omdat hun embryo’s volledig transparant zijn. Zo kunnen wetenschappers gemakkelijk de vroege ontwikkelingsstadia observeren, wat moeilijk kan zijn bij andere gewervelde diersoorten. Door hun transparantie kunnen wetenschappers ook gemakkelijk fluorescent gelabelde eiwitten en weefsels observeren om ontwikkelingsprocessen beter te beoordelen.
Het laboratorium van Stainier bestudeerde bijvoorbeeld de proliferatie en differentiatie van β-cellen in de zich ontwikkelende pancreas van de zebravis. Eerst werden deze cellen gemerkt met plasmiden. Vervolgens werd met behulp van HOTcre, een methode waarbij warmte-inductie wordt gebruikt om de temporele expressie van verschillende transgenen te controleren, door de Stainer-groep vastgesteld dat er in feite twee verschillende populaties van β-cellen zijn die in verschillende regio’s van de alvleesklier ontstaan en verschillende niveaus van insuline produceren (Hesselson et al, 2009).
De worm (Caenorhabditis elegans)
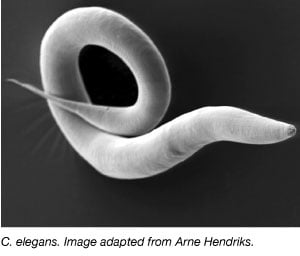 De worm, Caenorhabditis elegans, is uitgebreid gebruikt als modelorganisme sinds de jaren zeventig, toen Sydney Brenner hem in het lab bracht om de neuronale ontwikkeling te bestuderen (Brenner, 1973). C. elegans zijn kleine, transparante wormen met een snelle levenscyclus en grote broedsels. De meeste C. elegans zijn ook zelfvruchtbare hermafrodieten, waardoor het gemakkelijk is om grote experimenten uit te voeren over meerdere generaties. Net als andere modelorganismen is ook het genoom van C. elegans volledig gesequenced en heeft meer dan 60% van de menselijke genen een ortholoog in C. elegans, waardoor het ideaal is om fundamentele moleculair-biologische processen te bestuderen.
De worm, Caenorhabditis elegans, is uitgebreid gebruikt als modelorganisme sinds de jaren zeventig, toen Sydney Brenner hem in het lab bracht om de neuronale ontwikkeling te bestuderen (Brenner, 1973). C. elegans zijn kleine, transparante wormen met een snelle levenscyclus en grote broedsels. De meeste C. elegans zijn ook zelfvruchtbare hermafrodieten, waardoor het gemakkelijk is om grote experimenten uit te voeren over meerdere generaties. Net als andere modelorganismen is ook het genoom van C. elegans volledig gesequenced en heeft meer dan 60% van de menselijke genen een ortholoog in C. elegans, waardoor het ideaal is om fundamentele moleculair-biologische processen te bestuderen.
C. elegans zijn ook zeer vatbaar voor genetische manipulatie. Transgene dieren kunnen worden gemaakt door eenvoudig micro-injectie van DNA in de worm, zoals dieren die fluorescerende markers tot expressie brengen (Mello et al., 1991). Genen kunnen ook gemakkelijk worden uitgeschakeld door RNA-interferentie (RNAi), door de worm te voeden met bacteriën die specifieke plasmiden (L4440) tot expressie brengen die het gen van uw interesse bevatten (Fire et al., 1998). De ontdekking van RNAi in de worm leverde Andrew Fire en Craig Mello in 2006 zelfs een Nobelprijs op.
Een van de grote voordelen van C. elegans is dat ze gedurende hun hele leven transparant zijn. Zo kan elke genetische wijziging, zoals expressie van fluorescerende eiwitten of verstoring van een gen, gemakkelijk worden gevisualiseerd in een levend organisme vanaf de embryonale ontwikkeling tot de volwassenheid. Deze mogelijkheid om cellen en weefsels genetisch te manipuleren en te visualiseren stelt wetenschappers in staat in vivo studies uit te voeren die bij andere modelorganismen vrij moeilijk kunnen zijn. Wormen zijn gebruikt om een scala van biologische systemen en processen te onderzoeken, waaronder het zenuwstelsel, ontwikkeling, celsignalering, veroudering en mechanotransductie, om er maar een paar te noemen. Het lab van Andrew Leifer heeft bijvoorbeeld de worm gebruikt om calciumsignalisatie in de volledige volwassen hersenen te bestuderen, met behulp van een plasmide dat een genetisch gecodeerde calciumsensor, GCaMP6, tot expressie brengt (Nguyen et al., 2015). Als u geïnteresseerd bent in C. elegans plasmiden en middelen kijk dan op Addgene’s Worm Expression pagina.
Op zoek naar meer modelorganismen? Bekijk deel twee in de populaire serie modelorganismen, en lees over nieuwe systemen die worden ontwikkeld voor opkomende modelorganismen!
Brenner, Sydney. “De genetica van Caenorhabditis elegans.” Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. “Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling.” Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. “The zebrafish reference genome sequence and its relationship to the human genome.” Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. “Drosophila-een veelzijdig model in de biologie & geneeskunde.” Materials today 14.5 (2011): 190-195.
Mello, Craig C., et al. “Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences.” The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. “Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans.” Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan, en Charles D. Nichols. “Menselijke ziekte modellen in Drosophila melanogaster en de rol van de vlieg in therapeutische drug discovery.” Pharmacological reviews 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.
.