De scheikunde helpt ons de eigenschappen en samenstelling van de wereld om ons heen te begrijpen. Hier leer je meer over de toestanden van de materie, maar ook over één toestand in het bijzonder (drie keer raden – het is geen vaste of vloeibare stof…).
De toestanden van de materie
Afhankelijk van temperatuur, druk en de eigenschappen van een stof, kan een stof verschillende fysische vormen aannemen. Deze fysische vormen noemen we Materiestaten. Er zijn drie zeer bekende toestanden van materie: Vaste stoffen, vloeistoffen en gassen. Er bestaan ook andere toestanden van materie. Deze omvatten plasma (een toestand van materie vergelijkbaar met een gas, maar bevat vrij bewegende elektronen en ionen – atomen die elektronen hebben verloren) en Bose-Einstein Condensaten (BECs) (golven van materie die kunnen voorkomen met sommige soorten atomen bij super koude temperaturen).
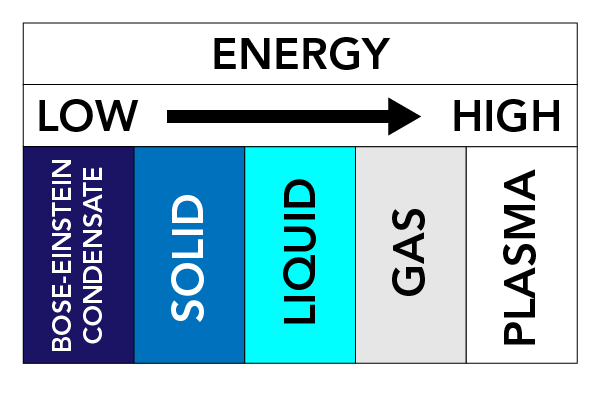
De krachten tussen deeltjes en de druk op deeltjes houden de deeltjes bij elkaar. Als we materie opwarmen (energie toevoegen), gaan de deeltjes sneller bewegen en hebben ze de neiging zich te verspreiden. Deze beweging van de deeltjes heeft een groot effect op de toestand van een stof.
Zoliden
In vaste stoffen zijn de krachten die de deeltjes bij elkaar houden relatief sterk, en de deeltjes blijven heel dicht bij elkaar. De deeltjes kunnen trillen, maar ze bewegen niet veel. Dit is de reden waarom vaste stoffen hard en stijf zijn. In hun eentje zullen vaste stoffen hun vorm behouden.
Vloeistoffen
In vloeistoffen zijn de krachten tussen de deeltjes zwakker dan in vaste stoffen. De deeltjes zitten nog vrij dicht op elkaar, maar kunnen zich vrij bewegen. Vloeistoffen kunnen in een vat rondstromen, en hebben geen bepaalde vaste vorm.
Gassen
Gassen zijn moeilijk in verband te brengen omdat ze vaak onzichtbaar zijn, maar overal om je heen te vinden zijn. Je kunt ze voelen als bijvoorbeeld de wind waait. Je kunt ze soms ruiken, bijvoorbeeld als je de geur ruikt van eten dat aan het koken is, of als een stinkdier overstuur is geraakt. Sommige gassen zijn belangrijk voor onze gezondheid (bv. zuurstof), terwijl andere dodelijk kunnen zijn (bv. waterstofsulfide en chloor). Voor een operatie kunt u een verdovingsgas toegediend krijgen, dat chemicaliën bevat, om de pijn te verlichten en u tijdens de ingreep bewusteloos te maken. Gassen zijn ook verantwoordelijk voor de kracht van explosies. Laten we gassen eens nader bekijken.
Soorten gassen
Er zijn elementaire gassen (die uit één enkel element bestaan) en gassen die verbindingen zijn (die uit meer dan één element bestaan). De symbolen van de elementaire gassen zijn te vinden in elk Periodiek Systeem der Elementen. Ze zijn samengevat in de onderstaande tabel.
Diatomisch gas |
Chemische formule |
Monatomisch Gas |
Chemische formule |
|
Waterstof |
H2 |
Helium |
He |
|
Zuurstof |
O2 |
Neon |
Ne |
|
Stikstof |
N2 |
Argon |
Ar |
|
Fluorine |
F2 |
Krypton |
Kr |
|
Chloor |
Cl2 |
Xenon |
Xe |
Een diatomisch gas is een gas waarvan de basiseenheid een molecuul is dat bestaat uit twee met elkaar verbonden atomen. Een monoatomair gas is een gas waarin de basiseenheid een enkel atoom is. De meeste gassen zijn echter verbindingen van twee of meer verschillende elementen die chemisch met elkaar zijn verbonden. Het meest voorkomende gas is waterdamp, H2O. Hier volgen de namen, formules en toepassingen van enkele samengestelde gassen:
Gemeenschappelijke naam |
Chemische formule |
Waar je normaal vindt |
||
|
Koolstofdioxide |
CO2 |
Luchtsfeer, auto-uitlaat, pop, onze longen |
||
|
Propaan |
C3H8 |
BBQ’s, kampkachels, brandstof voor sommige voertuigen |
||
|
Methaan |
CH4 |
Component van broeikasgas en aardgas |
CH4 |
Component van gas en aardgas |
|
Ammoniak |
NH3 |
Gebruikt om meststoffen te maken, schoonmaakmiddelen |