Men moet enkele basiseigenschappen van de gegeven verbinding en zijn Lewisstructuur kennen om de moleculaire geometrie, polariteit en andere dergelijke eigenschappen te begrijpen. SF4 is de chemische formule voor zwaveltetrafluoride. Het is een kleurloos corrosief gas dat wordt gebruikt bij de synthese van verschillende organofluorverbindingen. SF4 is een vrij gevaarlijke verbinding, maar wordt op grote schaal gebruikt in chemische en farmaceutische bedrijven.
| Naam van molecuul | Sulfur Tetraflouride ( SF4) |
| Nr van valentie-elektronen in het molecuul | 34 |
| Hybridisatie van SF4 | sp3 hybridisatie |
| Bondshoeken | 102 graden en 173 graden |
| Moleculaire Geometrie van SF4 | Trigonale bipyramidale |
Om de eigenschappen van deze molecule te begrijpen, zoals zijn reactiviteit, polariteit en meer, moet men eerst de Lewisstructuur van SF4 kennen.
Inhoud
SF4 Moleculaire geometrie
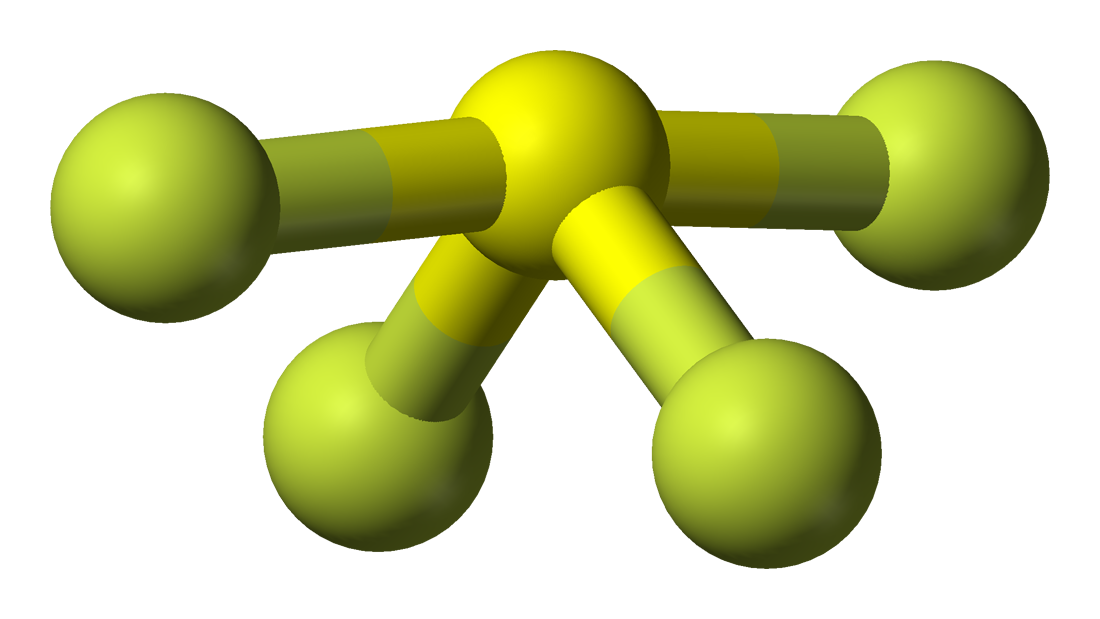
De moleculaire geometrie van een bepaald molecuul is gemakkelijk te begrijpen met behulp van de molecuulformule of het VSEPR-model. Een molecuulformule helpt om het exacte aantal en type atomen te kennen die in de gegeven verbinding aanwezig zijn. Hier is er één zwavelatoom en vier fluoratomen in de verbinding, waardoor het vergelijkbaar is met de moleculaire formule van AX4E.
Moleculen met een molecuulformule van AX4E hebben een trigonale bipyramidale moleculaire geometrie. Hier bevinden zich twee fluoratomen die bindingen vormen met het zwavelatoom op de equatoriale posities, en de overige twee op de axiale posities. Omdat er één lone pair op het centrale atoom is, stoot het het bindingspaar elektronen af, waardoor de vorm een beetje verandert en het lijkt op een wipwap. De elektronen volgen dit rangschikkingspatroon volgens de VSEPR-regel om de afstotingskrachten tussen de elektronenparen te minimaliseren en zo de stabiliteit van het molecuul te maximaliseren.
Hieruit volgt dat SF4 een trigonale bipyramidale moleculaire geometrie heeft.
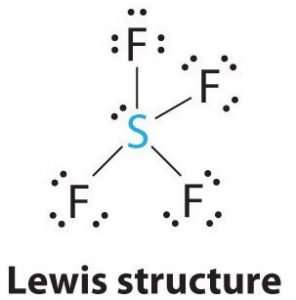
SF4 Lewisstructuur
De Lewisstructuur is een picturale weergave van de bindingen en valentie-elektronen in het molecuul. De bindingen die tussen twee atomen worden gevormd, worden weergegeven met lijnen, terwijl de valentie-elektronen die geen bindingen vormen, worden weergegeven met stippen. De valentie-elektronen die deelnemen aan de vorming van bindingen worden bindingsparen elektronen genoemd, terwijl de elektronen die niet deelnemen of geen bindingen vormen, niet-bindende elektronenparen of lone pairs worden genoemd.
En om de Lewisstructuur van SF4 te tekenen, moeten we eerst het totale aantal valentie-elektronen in dit molecuul weten.
Zoals men waarschijnlijk kan zien, zit er in deze verbinding één zwavelatoom en vier fluoratomen. Om de totale valentie-elektronen van deze verbinding te kennen, moeten we de valentie-elektronen van beide atomen afzonderlijk kennen.
- Waarde-elektronen van zwavel: 6
- Waarde-elektronen van fluor: 4* (7)
( aangezien er vier fluor atomen zijn, moeten we de valentie-elektronen van alle atomen in aanmerking nemen)
Totaal aantal valentie-elektronen in SF4 = aantal valentie-elektronen in zwavel + aantal valentie-elektronen in fluor
= 6 + 28
= 34 valentie-elektronen
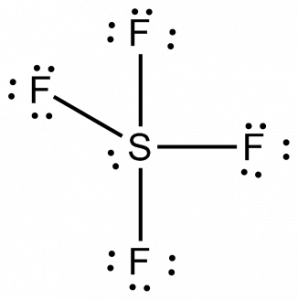
Nu we het totale aantal valentie-elektronen kennen, wordt het voor ons gemakkelijk om ook de bindingsvorming tussen de atomen en de volledige rangschikking van het molecuul te begrijpen.
Zwavel zal het centrale atoom in dit molecuul zijn, omdat het het minst elektronegatief is, met vier fluoratomen die bindingen vormen aan de zijkanten van dit centrale atoom. Elk fluoratoom zal een binding vormen met het centrale atoom, wat betekent dat er vier bindingen in de molecuulstructuur zullen zijn, waarbij vier valentie-elektronen van fluoratomen en vier elektronen van het zwavelatoom worden gebruikt. Er worden nu dus acht valentie-elektronen gebruikt, waardoor het aantal valentie-elektronen daalt van 34 naar 24. Alle fluoratomen hebben zes valentie-elektronen, en het centrale atoom heeft twee valentie-elektronen.
Teken lijnen tussen S en F om bindingen aan te geven en voor eenzame elektronenparen gebruikt u stippen. Elk fluoratoom zal drie paren van 6 valentie-elektronen (weergegeven als stippen) op het atoom hebben, samen met één binding met zwavel. Daarentegen heeft het centrale atoom twee valentie-elektronen en vier bindingen.
Hieruit volgt dat het centrale atoom, zwavel, in de Lewisstructuur van SF4 één eenzaam elektronenpaar en vier bindingselektronenparen heeft. Tegelijkertijd zal elk fluoratoom drie eenzame paren hebben.
Is SF4 polair?
Als we eenmaal de Lewis-structuur en de moleculaire geometrie van de gegeven verbinding kennen, wordt het gemakkelijker om de polariteit van het molecuul weer te geven. Hier leidt één lone pair op het centrale zwavelatoom en vier bindingsparen van elektronen tot de asymmetrische verdeling van elektronen op het centrale atoom.
En omdat de vorm van het molecuul als een wipwap is, kunnen twee fluoratomen elkaars dipoolmoment opheffen, maar de overige twee niet vanwege de rangschikking van de elektronen. En omdat fluoratomen elektronegatiever zijn dan het zwavelatoom, resulteert dit in een ongelijke verdeling van de lading. Het dipoolmoment wordt dus niet geannuleerd, wat het molecuul polair maakt. Dus ja, SF4 is polair.
SF4 hybridisatie
Om de hybridisatie van het SF4-molecuul te kennen, kijken we eerst naar de gebieden van elektronendichtheid voor het centrale atoom.
Zwavel heeft vier bindingsparen elektronen en één lone paar, waardoor het totale aantal gebieden voor elektronendichtheid 5 is. Het zwavelatoom gebruikt dus vijf gehybridiseerde banen, een 3s-baan, drie 3p-banen en een 3d-baan. Deze rangschikking van elektronen rond het atoom en de gehybridiseerde banen leidt tot de sp3d hybridisatie. Men kan ook het sterische getal gebruiken om de hybridisatie te kennen; hier is het sterische getal 5 voor het zwavelatoom.
Dus SF4 heeft sp3d hybridisatie.
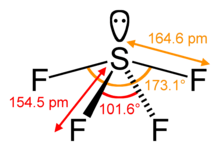
SF4 Bindingshoeken en vorm
Het centrale zwavelatoom vormt vier bindingen met de naburige fluoratomen en heeft één lone elektronenpaar. Fluoratomen op de equatoriale posities hebben bindingshoeken van 102 graden, en de axiale hebben 173 graden, die een beetje afwijken van de trigonale bipyramidale moleculaire geometrie die leidt tot een wip-vorm.
Het lone paar op het centrale atoom leidt tot de verandering in de bindingshoeken van 120 graden naar 102 graden voor equatoriale fluoratomen en 173 graden in plaats van 180 graden voor axiale fluoratomen.
Conclusies
Ter afsluiting van alle eigenschappen kunnen we zeggen dat,
- Zwaveltetrafluoride 34 valentie-elektronen heeft, waarvan het vier covalente bindingen vormt en één eenzaam elektronenpaar op het centrale atoom in zijn Lewis-structuur.
- Er zijn drie eenzame paren op elk fluoratoom.
- Het heeft een moleculaire geometrie van de formule AX4E; het vormt een see-saw vorm en heeft een trigonale bipyramidale moleculaire geometrie.
- SF4 heeft sp3d hybridisatie en is polair van aard.