US Pharm. 2017;42(4):HS16-HS20.
ABSTRACT: Necrotiserende weke delen infecties (NSTI’s) zijn een type ernstige bacteriële infectie die snelle herkenning en interventie door artsen en chirurgen vereisen in combinatie met tijdige antibiotische behandeling. Deze infecties kunnen een polymicrobiële oorzaak hebben, maar in de meeste gevallen is meticilline-resistente Staphylococcus aureus betrokken. Bij de behandeling van NSTI’s is tijd van essentieel belang om complicaties zoals amputatie te voorkomen, en onlangs zijn nieuwe geneesmiddelen toegevoegd aan de lijst van behandelingsmogelijkheden. Deze nieuwe antibiotica omvatten tedizolid (Sivextro), oritavancin (Orbactiv), en dalbavancin (Dalvance). Met name de lange halfwaardetijd van zowel dalbavancine als oritavancine maakt een eenmalige dosering of een eenmaal per week toediening mogelijk.
Necrotiserende weke delen infectie (NSTI) is een bredere term dan necrotiserende fasciitis, omdat bij NSTI de infectie zich tot buiten de fascia kan uitstrekken. In de omgangstaal worden termen gebruikt als “vleesetende bacterie” en “vleesetende infectie”. Dit type infectie werd voor het eerst opgemerkt in de 5e eeuw v. Chr. door Hippocrates, die het als volgt beschreef: “Velen werden door de erysipelas over het gehele lichaam aangevallen, terwijl de opwindende oorzaak een onbeduidend ongeluk was…vlees, pezen en botten vielen in grote hoeveelheden weg…er waren vele doden.”1 Sinds die tijd zijn andere beschrijvende termen gebruikt om NSTI te karakteriseren, zoals “phagedaenic ulcer, phagedena gangrenous, gangrenous ulcer, malignant ulcer, putrid ulcer, or hospital gangrene. “2 De term gangreen wordt nog steeds gebruikt, zoals in Fournier gangrene, dat necrose is van het perineum en scrotum.3
Epidemiologie
Het risico van NSTI blijft over het algemeen laag, met ongeveer 1.000 gevallen per jaar in de Verenigde Staten. Dit aantal kan echter stijgen, misschien door een groter bewustzijn en erkenning van de ziektetoestand, toenemende antibioticaresistentie, of verbeterd bacterieel virulentievermogen.4
Etiologie
NSTI’s worden ingedeeld naar anatomische locatie (bijv. Fournier gangreen), maar ze komen het meest voor in de extremiteiten, perineum en genitaliën. Veel voorkomende bacteriële veroorzakende organismen zijn onder meer meticillineresistente Staphylococcus aureus (MRSA), gramnegatieve organismen en anaeroben, en streptokokken van groep A (GAS).4
Klinische presentatie en diagnose
De eerste presentatie van patiënten met NSTI kan lijken op symptomen die worden geassocieerd met cellulitis, waaronder erytheem, zwelling, koorts, verharding en oedeem buiten het gebied van de huidveranderingen.4 Patiënten kunnen pijnlijkheid of pijn beschrijven die lijkt op die van een verrekte spier.5 Symptomen die de verdenking van de clinicus op NSTI moeten verhogen zijn pijn die niet in verhouding staat tot de bevindingen bij onderzoek (vroeg in het ziektebeloop), de aanwezigheid van bullae, ecchymose van de huid voorafgaand aan huidnecrose, gas in de weefsels, en verdoving van de huid. Bovendien wijst de chronologie van de infectie bij patiënten met NSTI, in vergelijking met patiënten met de diagnose cellulitis, op een veel snellere ziekteprogressie.4 Daarom moet bij patiënten bij wie het vermoeden van cellulitis bestaat, de diagnose necrotiserende fasciitis worden uitgesloten.6 Om een infectie te laten ontstaan, moeten de bacteriën in de bloedbaan terechtkomen, gewoonlijk via een inciterende wond (een breuk in het epitheliale of mucosale oppervlak) zoals een kleine snijwond of kras, insectenbeet, huidzweer of postoperatieve wond; soms kunnen dergelijke verwondingen echter niet worden geïdentificeerd. Risicofactoren voor NSTI zijn onder meer een immuungecompromitteerde toestand (AIDS, steroïdentherapie), zwaarlijvigheid, alcoholmisbruik, kanker, diabetes mellitus, perifere vaatziekten, nierziekten, ondervoeding, en andere chronische aandoeningen. Actief parenteraal drugsgebruik (IV- of subcutane injectie van illegale stoffen) is ook geïdentificeerd als een risicofactor, vooral in de stedelijke omgeving.7
Guidelines Review
De 2014 Infectious Diseases Society of America (IDSA) Practice Guidelines for the Diagnosis and Management of Skin and Soft Tissue Infections bevatten informatie over het beheer van alle soorten huid- en weke delen infecties, variërend van eenvoudige cellulitis tot cutane miltvuur bij gezonde personen en gecompromitteerde patiënten. Omdat deze infecties in alle leeftijdsgroepen voorkomen, bevatten de richtlijnen aanbevelingen voor zowel pediatrische als volwassen patiënten. Een subsectie van de richtsnoeren bevat informatie met betrekking tot NSTI. Specifieke aanbevelingen voor behandeling worden gegeven op basis van een rating die de sterkte van het bewijs voor de aanbeveling aangeeft volgens het IDSA/U.S. Public Health Service grading system for rating recommendations in clinical guidelines.6 De richtlijn geeft antwoord op 24 klinische vragen, waaronder twee vragen die gerelateerd zijn aan NSTI.
De eerste NSTI-gerelateerde vraag die in de richtlijnen wordt behandeld is: Wat is de voorkeursbeoordeling en behandeling van necrotiserende fasciitis, inclusief Fournier gangreen? De eerste aanbeveling is voor onmiddellijk chirurgisch overleg bij patiënten met agressieve infecties met tekenen van systemische toxiciteit of als er bezorgdheid is voor necrotiserende fasciitis of gasgangreen.6 Dit wordt gevolgd door twee aanbevelingen met betrekking tot antibiotische therapie. De initiële antimicrobiële therapie moet breed zijn om dekking te bieden voor zowel enkelvoudige als multiorganisme infecties. Daarnaast wordt penicilline in combinatie met clindamycine aanbevolen voor gedocumenteerde necrotiserende fasciitis met GAS. Alle drie de aanbevelingen hebben een rating van sterk met bewijs van lage kwaliteit, wat aangeeft dat de gewenste effecten duidelijk opwegen tegen eventuele ongewenste effecten. Na de aanbevelingen volgt een evidence review, gevolgd door een overzicht van de meest voorkomende klinische kenmerken, microbiologische oorzaken (monomicrobieel versus polymicrobieel), diagnose en behandeling.
Een apart deel van de richtlijnen richt zich op de behandeling van clostridiale NSTI aan de hand van de volgende vraag: Wat is de juiste aanpak voor de evaluatie en behandeling van clostridiaal gasgangreen of myonecrose? Ten eerste moet de vermoedelijke plaats van gasgangreen dringend chirurgisch worden onderzocht en moet het betrokken weefsel worden gedebrideerd. Een antibioticumkuur met een breed spectrum wordt voorgesteld tenzij er een definitieve microbiologische oorzaak is. In het geval van clostridiale myonecrose wordt penicilline in combinatie met clindamycine voorgesteld. Ten slotte wordt hyperbare zuurstoftherapie niet aanbevolen. Al deze aanbevelingen hebben een sterke aanbeveling, en alle behalve de chirurgische aanbeveling hebben een lage kwaliteit van bewijs (de chirurgische aanbeveling heeft een matige kwaliteit van bewijs). Een overzicht van het bewijs rond deze aanbevelingen besluit het hoofdstuk over NSTI.6
Behalve dat NSTI’s verschillen van minder ernstige huidinfecties door klinische presentatie en andere systemische manifestaties, vereisen ze ook een andere aanpak van de behandeling. Er zijn vele soorten NSTI’s, maar de antibiotische behandeling en chirurgische aanpak zijn voor alle soorten vergelijkbaar, en chirurgische interventie is de primaire aanpak wanneer een NSTI wordt verwacht. De meeste patiënten zullen meerdere bezoeken aan de operatiekamer (OK) nodig hebben totdat debridement niet langer nodig is.6
Behandeling met geneesmiddelen
Initiële antibioticaselectie moet middelen omvatten met activiteit tegen een breed scala van organismen, waaronder aerobes, MRSA en anaerobes (TABEL 1).6 Bij de antibioticaselectie moet rekening worden gehouden met patiëntspecifieke factoren zoals eerdere blootstelling aan antibiotica, bijkomende ziektetoestanden, orgaanfunctiestoornissen en allergieën. Zoals het geval is bij het beheer van de meeste infecties, houdt goed antimicrobieel rentmeesterschap in dat de antibioticatherapie wordt geoptimaliseerd tot een zo beperkt mogelijk spectrum zodra een microbiologische oorzaak is geïdentificeerd.
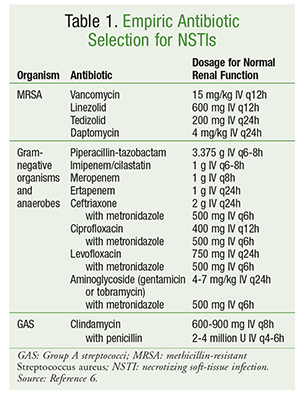
Voor het definitieve beheer van NSTI is een verscheidenheid aan antibiotica nodig. Bij polymicrobiële infecties wordt vaak een breedspectrumantibioticatherapie voortgezet. In aanwezigheid van infecties veroorzaakt door GAS, moeten zowel clindamycine als penicilline worden gebruikt. De toevoeging van clindamycine onderdrukt de toxine- en cytokineproductie, en het gebruik van penicilline biedt dekking in het geval van clindamycineresistentie tegen GAS. Voor infecties veroorzaakt door meticilline-gevoelige S aureus wordt de voorkeur gegeven aan het gebruik van nafcilline, oxacilline, of cefazolin. Clostridiale infecties moeten worden behandeld met clindamycine in combinatie met penicilline. Antibiotische therapie wordt gewoonlijk voortgezet totdat geen verder debridement nodig is, de patiënt klinische verbetering heeft laten zien, en koorts 48 tot 72 uur afwezig is geweest.6
Sinds de publicatie van de IDSA-richtlijnen van 2014 zijn verschillende nieuwe antibiotica goedgekeurd voor gebruik bij de behandeling van gecompliceerde huid- en weke deleninfecties. Deze middelen zijn tedizolid (Sivextro), oritavancine (Orbactiv), en dalbavancine (Dalvance).
Tedizolid is een oxazolidinon-antibioticum vergelijkbaar met linezolid. Het heeft een betrouwbare activiteit tegen MRSA en andere multiresistente Gram-positieve organismen. In tegenstelling tot de tweemaal daagse dosering van linezolid, wordt tedizolid in een enkele dagelijkse dosis toegediend, oraal of IV. Tedizolid kan gunstiger bijwerking- en geneesmiddel-interactieprofielen hebben in vergelijking met linezolid.8 Hoewel tedizolid is onderzocht bij de behandeling van acute bacteriële huid- en huidstructuurinfecties, is het niet onderzocht bij NSTI.
Dalbavancin en oritavancin zijn lipoglycopeptiden die zijn goedgekeurd voor de behandeling van acute bacteriële huid- en huidstructuurinfecties. Deze middelen zijn uniek omdat zij een lang halfwaardetijd hebben, waardoor een eenmalige dosis of een eenmaal per week toe te passen regime mogelijk is. De dosering van dalbavancine moet worden verlaagd bij patiënten met een creatinineklaring <30 ml/minuut. Oritavancine vereist geen dosisaanpassingen in verband met orgaanfunctiestoornissen, maar het mag niet worden gebruikt bij patiënten die heparine krijgen omdat het de stollingstests kunstmatig verlengt. Oritavancine kan ook de effecten van vitamine K-antagonisten zoals warfarine verhogen.9 Beide middelen hebben bewezen doeltreffendheid bij de behandeling van huid- en huidstructuurinfecties, maar zij zijn niet geëvalueerd voor gebruik bij necrotiserende infecties.
Aanvullende therapieën voor NSTI omvatten IV immunoglobuline (IVIG) en hyperbare zuurstoftherapie. IVIG wordt verondersteld gunstig te zijn vanwege de mogelijke neutralisatie van de toxinen die bij streptokokkeninfecties worden geproduceerd. Vermindering van deze toxines zou mogelijk een deel van het orgaanfalen, de shock en de weefselvernietiging die vaak bij NSTI worden gezien, kunnen verminderen.6 Op het moment dat de IDSA-richtlijnen werden gepubliceerd (april 2014), meldden een observationele studie en een trial uit Europa enkele successen met het gebruik van IVIG bij streptokokkeninfecties.6 Op basis van het gebrek aan bewijs dat de werkzaamheid ondersteunt, wordt het gebruik van IVIG momenteel echter niet aanbevolen.
Een recentere studie beschreef de effectiviteit van clindamycine en IVIG tegen invasieve GAS-infecties.10 Vierenentachtig patiënten voldeden aan de criteria voor invasieve GAS-ziekte, en IVIG werd gebruikt bij 14 patiënten, waaronder acht met necrotiserende fasciitis. De mortaliteit was lager bij patiënten die werden behandeld met clindamycine en IVIG, maar dit verschil was niet significant. Hoewel er geen statistisch verschil in mortaliteit was wanneer IVIG werd toegevoegd aan clindamycine, suggereerden de auteurs dat er een mogelijk voordeel kan zijn bij volwassenen met ernstiger ziekte.10
Hyperbarische zuurstoftherapie (HBOT) is bepleit voor de behandeling van gasgangreen, maar de rol ervan is controversieel.6 Laboratoriumonderzoek heeft aangetoond dat zuurstofrijke weefseltoestanden helpen de groei van Clostridium perfringens te onderdrukken en de afweer van de gastheer tegen vreemde cellen te verhogen, maar er ontbreken criteria om te bepalen welke patiënten baat kunnen hebben en wat het juiste moment is om met de therapie te beginnen.6,11 Niets mag spoedeisend chirurgisch debridement en toediening van antibiotica uitstellen, aangezien beide belangrijk zijn om de overleving te verzekeren.6
Omdat de meerderheid van de gepubliceerde studies klein en onderpowered waren, werd een studie uitgevoerd om gegevens over het gebruik van HBOT van verschillende centra met HBOT-faciliteiten te evalueren.11 Over een periode van 3 jaar zagen 14 HBOT-faciliteiten 1.583 gevallen van NSTI en verstrekten adjuvante HBOT in 117 gevallen. De HBOT-groep had hogere kosten en een langere verblijfsduur in het ziekenhuis dan de controlegroep, maar had een significant lager sterftecijfer in het ziekenhuis (5% vs. 12%, respectievelijk; P <.05). Wanneer de ernst van de ziekte in aanmerking werd genomen, hadden de ernstigst zieke HBOT-patiënten significant lagere mortaliteits- en complicatiecijfers, maar er waren geen verschillen in verblijfsduur of kosten. Een multivariate analyse toonde aan dat patiënten die geen HBOT kregen een grotere kans hadden om tijdens de ziekenhuisopname te overlijden (odds ratio, 10,6; 95% CI 5,2-25,1). Elke toename in de ernst van de ziekte bracht een verhoogd risico op overlijden met zich mee.
Deze studie van 14 HBOT-faciliteiten lijkt verbeterde uitkomsten aan te tonen, vooral voor de ziekste patiënten die direct werden opgenomen in een centrum met de mogelijkheid om deze behandeling te geven.11 Dit neemt de controverse rond het gebruik van HBOT echter niet weg, omdat dit onderzoek verschillende beperkingen had. De studie werd retrospectief uitgevoerd met behulp van een administratieve database in academische medische centra. Ook kan het zijn dat sommige centra een derde partij hebben die eigenaar is van de HBOT-faciliteit, waardoor de resultaten minder generaliseerbaar zijn naar patiënten in die instellingen. Een gerandomiseerde, gecontroleerde trial zou nuttig zijn om het uiteindelijke voordeel van deze therapie te bepalen.
Complicaties
Het sterftecijfer geassocieerd met NSTI is maar liefst 30% tot 70% bij patiënten met GAS necrotiserende fasciitis in combinatie met hypotensie en orgaanfalen.6 Omdat de behandeling meerdere bezoeken aan de OK met zich meebrengt, worden grote wonden en mogelijke amputaties routinematig gemeld. Andere complicaties, zoals reconstructieve chirurgie, sepsis, nosocomiale infecties en verlengde kritieke zorgtijd als gevolg van de ontwikkeling van multisysteem orgaanfalen, zijn frequente complicaties van NSTI.12
Informatie over langetermijneffecten van NSTI werd verzameld uit diepte-interviews met 18 overlevenden.12,13 De onderzoekers ontdekten dat de gerapporteerde kwaliteit van leven aanzienlijk werd beïnvloed door fysieke functie en aanhoudende pijn. Het effect van de ervaring op familie- en andere relaties bleek ook significant te zijn. Verschillende overlevenden beschreven langdurige psychologische gevolgen van de ziekte, waaronder depressie en posttraumatische stress.
Conclusie
Ziekenhuisapothekers zijn zeer geschikt om te helpen bij de zorg voor patiënten met NSTI’s, waaronder stroomlijning van de zorg; bevordering van antimicrobieel rentmeesterschap; en verbeteringen in klinische uitkomsten, kostenreductie, complicatieminimalisatie en heropnames. Andere taken van de apotheker zijn het identificeren van ideale patiënten voor de nieuwe maar duurdere therapeutische middelen (bv. oritavancine) en het herkennen van interacties tussen geneesmiddelen (bv. anticoagulantia) met deze antibioticaklassen.
1. Descamps V, Aitken J, Lee MG. Hippocrates over necrotiserende fasciitis. Lancet. 1994;344:556.
2. Loudon I. Necrotising fasciitis, hospital gangrene, and phagedena. Lancet. 1994;344:1416-1419.
3. Sarani B, Strong M, Pascual J, Schwab CW. Necrotiserende fasciitis: huidige concepten en overzicht van de literatuur. J Am Coll Surg. 2009;208:279-288.
4. Hakkarainen TW, Kopari NM, Pham TN, Evans HL. Necrotiserende weke delen infecties: review and current concepts in treatment, systems of care, and outcomes. Curr Probl Surg. 2014;51:344-362.
5. CDC. Necrotiserende fasciitis: een zeldzame ziekte, vooral voor de gezonde. www.cdc.gov/features/necrotizingfasciitis/. Accessed November 29, 2016.
6. Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update door de Infectious Diseases Society of America. Clin Infect Dis. 2014;59:147-159.
7. Bosshardt TL, Henderson VJ, Organ CH Jr. Necrotizing soft-tissue infections. Arch Surg. 1996;131:846-852.
8. Kisgen JJ, Mansour H, Unger NR, Childs LM. Tedizolid: a new oxazolidinone antimicrobial. Am J Health Syst Pharm. 2014;71:621-633.
9. Roberts KD, Sulaiman RM, Rybak MJ. Dalbavancine en oritavancine: een innovatieve benadering voor de behandeling van grampositieve infecties. Farmacotherapie. 2015;35:935-948.
10. Carapetis JR, Jacoby P, Carville K, et al. Effectiviteit van clindamycine en intraveneuze immunoglobuline, en risico op ziekte bij contacten, bij invasieve groep A streptokokkeninfecties. Clin Infect Dis. 2014;59:358-365.
11. Shaw JJ, Psoinos C, Ernhoff TA, et al. Not just full of hot air: hyperbaric oxygen therapy increases survival in cases of necrotizing soft tissue infections. Surg Infect (Larchmt). 2014;15:328-335.
12. Hakkarainen TW, Burkette Ikebata N, Bulger E, Evans HL. Moving beyond survival as a measure of success: understanding the patient experience of necrotizing soft-tissue infections. J Surg Res. 2014;192:143-149.
13. Miller LG, Perdreau-Remington F, Rieg G, et al. Necrotiserende fasciitis veroorzaakt door community-associated methicillin-resistant Staphylococcus aureus in Los Angeles. New Engl J Med. 2005;352:1445-1453.