Er zijn veel verschillende modaliteiten die kunnen worden gebruikt voor niet-invasieve moleculaire beeldvorming. Ze hebben elk hun eigen sterke en zwakke punten en sommige zijn meer bedreven in het in beeld brengen van meerdere doelwitten dan andere.
Magnetic resonance imagingEdit

MRI heeft als voordeel dat het een zeer hoge ruimtelijke resolutie heeft en zeer bedreven is in morfologische en functionele beeldvorming. MRI heeft echter ook een aantal nadelen. Ten eerste heeft MRI een gevoeligheid van ongeveer 10-3 mol/L tot 10-5 mol/L, hetgeen in vergelijking met andere soorten beeldvorming zeer beperkend kan zijn. Dit probleem vloeit voort uit het feit dat het verschil tussen atomen in de hoge energietoestand en in de lage energietoestand zeer klein is. Bij 1,5 Tesla bijvoorbeeld, een typische veldsterkte voor klinische MRI, is het verschil tussen de hoge en de lage energietoestand ongeveer 9 moleculen per 2 miljoen. Verbeteringen om de gevoeligheid van MR te verhogen zijn onder meer verhoging van de magnetische veldsterkte en hyperpolarisatie via optische pompen, dynamische nucleaire polarisatie of door parahydrogeen geïnduceerde polarisatie. Er zijn ook verschillende signaalversterkingsschema’s op basis van chemische uitwisseling die de gevoeligheid verhogen.
Om moleculaire beeldvorming van ziektebiomarkers met behulp van MRI te bereiken, zijn gerichte MRI-contrastmiddelen met hoge specificiteit en hoge relaxiviteit (gevoeligheid) nodig. Tot op heden zijn veel studies gewijd aan de ontwikkeling van gerichte MRI-contrastmiddelen om moleculaire beeldvorming met MRI te bereiken. Meestal zijn peptiden, antilichamen of kleine liganden, en kleine eiwitdomeinen, zoals HER-2 affibodies, gebruikt om doelgerichtheid te bereiken. Om de gevoeligheid van de contraststoffen te verhogen, worden deze targetingmoleculen gewoonlijk gekoppeld aan MRI-contraststoffen met een hoge payload of MRI-contraststoffen met een hoge relaxiviteiten. Met name de recente ontwikkeling van ijzeroxidedeeltjes van microngrootte (MPIO) maakte het mogelijk ongekende gevoeligheidsniveaus te bereiken voor het opsporen van eiwitten die tot expressie komen in slagaders en aders.
optische beeldvormingEdit
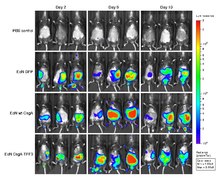
Er zijn een aantal benaderingen die voor optische beeldvorming worden gebruikt. De verschillende methoden zijn afhankelijk van fluorescentie, bioluminescentie, absorptie of reflectie als contrastbron.
De meest waardevolle eigenschap van optische beeldvorming is dat er geen grote veiligheidsrisico’s zijn zoals bij andere medische beeldvormingsmethoden.
Het nadeel van optische beeldvorming is het gebrek aan penetratiediepte, vooral wanneer wordt gewerkt met zichtbare golflengten. De penetratiediepte houdt verband met de absorptie en verstrooiing van licht, die in de eerste plaats een functie is van de golflengte van de excitatiebron. Licht wordt geabsorbeerd door endogene chromoforen die in levend weefsel voorkomen (b.v. hemoglobine, melanine, en lipiden). In het algemeen nemen de lichtabsorptie en de verstrooiing af met toenemende golflengte. Beneden ~700 nm (b.v. zichtbare golflengten) resulteren deze effecten in geringe doordringdiepten van slechts enkele millimeters. In het zichtbare gebied van het spectrum is dus slechts een oppervlakkige beoordeling van weefselkenmerken mogelijk. Boven 900 nm kan waterabsorptie de signaal/achtergrondverhouding verstoren. Omdat de absorptiecoëfficiënt van weefsel in het nabij-infrarode (NIR) gebied (700-900 nm) aanzienlijk lager is, kan licht dieper doordringen, tot op dieptes van enkele centimeters.
Nabij-infrarode beeldvormingEdit
Fluorescente sondes en labels zijn een belangrijk hulpmiddel voor optische beeldvorming. Sommige onderzoekers hebben NIR beeldvorming toegepast in rattenmodel van acuut myocardinfarct (AMI), met behulp van een peptide probe die zich kan binden aan apoptotische en necrotische cellen. Een aantal nabij-infrarood (NIR) fluoroforen zijn gebruikt voor in vivo beeldvorming, waaronder Kodak X-SIGHT kleurstoffen en conjugaten, Pz 247, DyLight 750 en 800 fluors, Cy 5.5 en 7 fluors, Alexa Fluor 680 en 750 kleurstoffen, IRDye 680 en 800CW fluors. Quantum dots, met hun fotostabiliteit en heldere emissie, hebben veel belangstelling gewekt; hun grootte belet echter een efficiënte klaring uit de bloedsomloop en de nieren, terwijl zij ook toxiciteit op lange termijn vertonen.
Verschillende studies hebben het gebruik van infrarode kleurstof-gelabelde probes in optische beeldvorming aangetoond.
- In een vergelijking van gamma scintigrafie en NIR beeldvorming, werd een cyclopentapeptide dubbel gelabeld met 111
In en een NIR fluorofoor gebruikt om αvβ3-integrin positieve melanoom xenografts af te beelden. - Naar-infrarood gelabelde RGD gericht op αvβ3-integrine is gebruikt in tal van studies naar een verscheidenheid van kankers te richten.
- Een NIR-fluorofoor is geconjugeerd met epidermale groeifactor (EGF) voor beeldvorming van tumorprogressie.
- Een NIR-fluorofoor werd vergeleken met Cy5.5, wat suggereert dat kleurstoffen met een langere golflengte effectievere targeting agents voor optische beeldvorming kunnen opleveren.
- Pamidronaat is gelabeld met een NIR-fluorofoor en gebruikt als een botbeeldvormingsmiddel om osteoblastische activiteit in een levend dier te detecteren.
- Een met een NIR-fluorofoor gelabeld GPI, een krachtige remmer van PSMA (prostaatspecifiek membraanantigeen).
- Gebruik van humaan serumalbumine gelabeld met een NIR-fluorofoor als traceermiddel voor het in kaart brengen van sentinel lymfeklieren.
- 2-Deoxy-D-glucose gelabeld met een NIR-fluorofoor.
Het is belangrijk op te merken dat toevoeging van een NIR probe aan een vector de biocompatibiliteit en biodistributie van de vector kan veranderen. Daarom kan niet ondubbelzinnig worden aangenomen dat de geconjugeerde vector zich op dezelfde wijze zal gedragen als de natieve vorm.
Single photon emission computed tomographyEdit
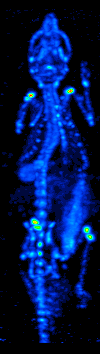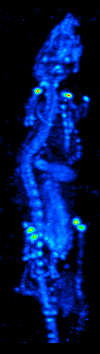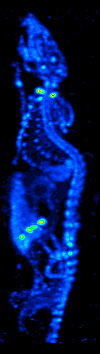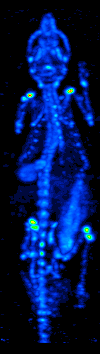
De ontwikkeling van computertomografie in de jaren zeventig maakte het mogelijk de verdeling van de radio-isotopen in het orgaan of weefsel in kaart te brengen, en leidde tot de techniek die nu single photon emission computed tomography (SPECT) wordt genoemd.
Het beeldvormingsmiddel dat bij SPECT wordt gebruikt, zendt gammastralen uit, in tegenstelling tot de positronstralers (zoals 18
F) die bij PET worden gebruikt. Er zijn verschillende radiotracers (zoals 99m
Tc, 111
In, 123
I, 201
Tl) die kunnen worden gebruikt, afhankelijk van de specifieke toepassing.
Xenon (133
Xe) gas is zo’n radiotracer. Het is waardevol gebleken voor diagnostische inhalatiestudies voor de evaluatie van de longfunctie, voor beeldvorming van de longen en kan ook worden gebruikt om de rCBF te beoordelen. De detectie van dit gas gebeurt met een gammacamera – een scintillatiedetector bestaande uit een collimator, een NaI-kristal en een reeks fotomultiplicatorbuizen
Door de gammacamera rond de patiënt te draaien, kan een driedimensionaal beeld van de verdeling van de radiotracer worden verkregen door gebruik te maken van gefilterde backprojectie of andere tomografische technieken.De radio-isotopen die bij SPECT worden gebruikt, hebben een betrekkelijk lang halfleven (enkele uren tot enkele dagen), waardoor zij gemakkelijk te produceren en betrekkelijk goedkoop zijn. Dit is het grote voordeel van SPECT als een moleculaire beeldvormingstechniek, aangezien het aanzienlijk goedkoper is dan PET of fMRI. Het ontbreekt echter aan een goede ruimtelijke (d.w.z. waar bevindt het deeltje zich precies) of temporele (d.w.z. gebeurde het signaal van het contrastmiddel in deze milliseconde, of in die milliseconde) resolutie. Bovendien zijn er, als gevolg van de radioactiviteit van het contrastmiddel, veiligheidsaspecten verbonden aan de toediening van radio-isotopen aan de proefpersoon, vooral bij seriële studies.
PositronemissietomografieEdit
Afspeelmedia
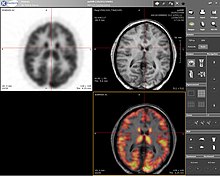
Positronemissietomografie (PET) is een beeldvormingstechniek voor de nucleaire geneeskunde die een driedimensionaal beeld of afbeelding oplevert van functionele processen in het lichaam. De theorie achter PET is eenvoudig genoeg. Eerst wordt een molecuul gemerkt met een positronuitstotende isotoop. Deze positronen annihileren met nabije elektronen, waarbij twee 511 keV fotonen worden uitgezonden, die 180 graden uit elkaar zijn gericht in tegengestelde richtingen. Deze fotonen worden vervolgens gedetecteerd door de scanner, die de dichtheid van positronannihilaties in een bepaald gebied kan schatten. Wanneer voldoende interacties en annihilaties hebben plaatsgevonden, kan de dichtheid van het oorspronkelijke molecuul in dat gebied worden gemeten. Typische isotopen zijn 11
C, 13
N, 15
O, 18
F, 64
Cu, 62
Cu, 124
I, 76
Br, 82
Rb, 89
Zr en 68
Ga, waarvan 18
F het meest klinisch wordt gebruikt. Een van de grootste nadelen van PET is dat de meeste sondes met een cyclotron moeten worden gemaakt. De meeste van deze sondes hebben ook een halfwaardetijd die in uren wordt gemeten, zodat de cyclotron ter plaatse moet zijn. Deze factoren kunnen PET onbetaalbaar duur maken. PET-beeldvorming heeft echter vele voordelen. In de eerste plaats is er de gevoeligheid: een doorsnee PET-scanner kan concentraties detecteren tussen 10-11 mol/L tot 10-12 mol/L.