- Introduction
- Methoden
- Muizenfibroblasten
- Diagnoses en medicatie
- Experimentele Set-Up
- Meting van effectieve refractaire periode
- Stock Solutions and Drug Application
- Analyse van actiepotentiaalparameters
- Statistische analyse
- Resultaten
- Effecten van MK-0448 op Kv1.5 stroom
- Effecten van MK-0448 op actiepotentialen
- Discussie
- Beperkingen van de studie
- Conclusie
- Conflict of Interest Statement
- Acknowledgments
Introduction
Op zoek naar veiliger antiaritmica voor de behandeling van atriaal fibrilleren (AF), zijn selectieve remmers van IKur ontworpen als atriaal-selectieve klasse III antiaritmica met therapeutisch potentieel in AF. Aangezien deze middelen gericht zijn tegen de Kv1.5-kanalen die alleen in de boezems functioneel zijn (Mays et al., 1995), worden zij geacht geen pro-aritmische effecten te hebben in de hartkamers en hebben zij bijgevolg veel belangstelling gekregen in de wetenschappelijke gemeenschap (voor een overzicht zie Ford en Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens and Wettwer, 2011).
Wij hebben eerder de elektrofysiologische effecten onderzocht van verschillende IKur-remmers, waaronder 4-aminopyridine, AVE0118, XEN-D0101, die alle de plateaufase van menselijke rechter atriale actiepotentialen (AP’s) verhoogden, opgenomen in trabeculae van atriale appendage, afkomstig van patiënten in sinusritme (SR) of AF (Wettwer et al, 2004; Christ et al., 2008; Ford et al., 2013). Interessant is dat de actiepotentiaalduur (APD90) en de effectieve refractaire periode (ERP) werden verkort in SR maar verlengd in AF-preparaten.
Nu zijn er voor het eerst resultaten bij mensen gepubliceerd met een andere selectieve Kv1.5-remmer, MK-0448 (Pavri et al., 2012). MK-0448 had geen effect op de relatieve atriale ERP in gezonde vrijwilligers, en de auteurs concludeerden dat niet verwacht kan worden dat IKur-blokkade therapeutisch nuttige antiaritmische effecten heeft bij AF. Aangezien er niets bekend is over de effecten van MK-0448 in ex-vivo menselijk atriumweefsel, onderzochten wij de effecten van MK-0448 op de vorm van atriale APs en ERP met standaard micro-elektrode technieken in trabeculae geïsoleerd uit rechter atriale appendages van patiënten in SR en AF, die een open hart operatie moesten ondergaan. In SR preparaten verhoogde MK-0448 de plateau potentiaal en verkortte APD en ERP bij 1 Hz zoals verwacht van IKur blokkers. We bevestigen ook dat MK-0448 effectief Kv1.5 stroom blokkeert in muizenfibroblasten die stabiel het hKCNA5 gen tot expressie brengen.
Methoden
Muizenfibroblasten
HK2BN9 cellen die menselijke Kv1.5 kanalen tot expressie brengen werden vriendelijk ter beschikking gesteld door Dr. Tamkun (Snyders et al., 1993). De cellen werden gekweekt in Dulbecco’s gemodificeerd eagle medium met 10% foetaal kalfsserum en 1% penicilline/streptomycine onder atmosferische omstandigheden van 5% CO2 bij 37°C. 250 μg/ml G418 werd aan het medium toegevoegd voor selectie. Expressie van Kv1.5 werd geïnduceerd door behandeling van de cellen met 1 uM dexamethason 24 uur voor een experiment. De cellen werden bestudeerd met een standaard enkele elektrode hele-cel voltage-clamp set-up zoals eerder beschreven (Radicke et al., 2006). De badoplossing bevatte (in mM): NaCl 150, KCl 5,4, MgCl2 2, CaCl2 2,0, HEPES 10, glucose 10, pH 7,4, temperatuur 25 ° C. De elektrodeoplossing bevatte (in mM): KCl 40, kaliumaspartaat 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0,1, HEPES 10, pH 7,4 aangepast met KOH. De serieweerstanden lagen tussen 5 en 10 MΩ en werden tot 85% gecompenseerd. Cel capaciteit werd gemeten met kleine hyperpolariserende klem stappen van -40 mV tot -42 mV, gemiddelde waarde was 20,8 ± 1,2 pA / PF (n = 33) en verschilde niet tussen cellen getest bij 0,5 en 3 Hz. Spanningsklem puls generatie, data collectie en analyse werden uitgevoerd met de ISO2 software (MFK, Niedernhausen, Duitsland). Gegevens werden niet gecorrigeerd voor de junction potential die 11,7 mV, zoals berekend met de JPCalc software (P.H. Barry, Sydney, Australië).
Diagnoses en medicatie
Atriumweefsel werd verkregen van patiënten die een hartoperatie ondergingen als gevolg van coronaire hartziekte of klepziekte. Alle patiënten gaven schriftelijke geïnformeerde toestemming. De studie werd goedgekeurd door de ethische commissie van de medische faculteit van de Technische Universiteit van Dresden (nr. EK790799). De patiënten staan vermeld in tabel 1. De studie omvatte 13 aan medicatie blootgestelde en 9 TMC preparaten van patiënten in sinusritme (SR-groep), 9 aan medicatie blootgestelde en 9 TMC preparaten van patiënten met permanent atriumfibrilleren (AF-groep, gedefinieerd als permanent atriumfibrilleren gedurende ≥6 maanden op het moment van weefselafname), en 3 aan medicatie blootgestelde preparaten van patiënten met intermitterend AF (episodes van spontaan beëindigend AF die enkele seconden tot enkele uren duurden). De medicatie van de patiënten bestond doorgaans uit ACE-remmers, β -blokkers, nitraten, lipidenverlagers en diuretica.
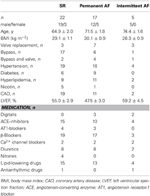
Tabel 1. Kenmerken van de patiënten van wie de trabeculae werden gebruikt voor de blootstelling aan geneesmiddelen.
Experimentele Set-Up
Kleine stukjes (50-100 mg in gewicht) van menselijke rechter atriale appendages werden naar het laboratorium vervoerd in een speciale Ca2+-vrije transportoplossing bij 20-25°C, samenstelling in mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 taurine, 5 MOPS, 30 2,3-butaan-dion monoxime (BDM), pH 7,0. Ofwel vrijlopende trabeculae (< 1 mm in diameter en 2-5 mm in lengte) of trabeculae samen met bijgevoegde atriale wand werden ontleed en gemonteerd op de bodem van een 5 ml orgel bad doorbloed met 50 ml recirculerende, zuurstof Tyrode’s oplossing bij een debiet van 7 ml / min bij 36 ± 1 ° C (samenstelling in mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 bij evenwicht met 5% CO2 in O2). De preparaten werden elektrisch gestimuleerd met een basale snelheid van 1 Hz met geïsoleerde blokgolfstimuli met een duur van 1 ms, 2 maal de drempelintensiteit. Transmembraanpotentialen werden geregistreerd met glazen micro-elektroden gevuld met 2,5 M KCl. Tip weerstanden van de elektroden waren tussen 20 en 80 MΩ. Zowel timing van de drijvende stimuli en pre-processing van de transmembraanpotentiaal reacties werden uitgevoerd met een computer-aided actiepotentiaal recording systeem (Wettwer et al., 2004). Chart voor Windows, versie 7.3.5, opname programma (ADInstruments Pty Ltd, Castle Hill, Australië) werd gebruikt voor de analyse van de actiepotentiaal parameters.
Elk experiment werd voorafgegaan door een 60 min equilibratie periode waarin de voorbereidingen werden toegestaan om te stabiliseren en residuele BDM werd volledig uitgewassen. Numerieke waarden van de belangrijkste actiepotentiaal parameters moesten constant blijven, dat wil zeggen, binnen een bereik van ±5% gedurende ten minste 10 min. Wanneer de micro-elektrode uit de cel werd bewogen, werd op dezelfde plaats een nieuwe inprik gemaakt en werd het experiment voortgezet indien de nieuwe opname visueel niet van de oude verschilde en bij de uiteindelijke numerieke analyse minder dan 3% verschil vertoonde.
Meting van effectieve refractaire periode
Effectieve refractaire periode (ERP) werd gemeten door een enkele extra stimulus geïnterpoleerd na treinen van 10 reguliere stimulatie pulsen op de basale frequentie van 1 Hz met afnemende intervallen in stappen van 5 ms van de laatste reguliere puls tot de extra stimulus niet een actiepotentiaal uit te lokken. Na een korte herstelperiode werd het preparaat blootgesteld aan MK-0448 (3 uM) bij 1 Hz gedurende nog eens 60 min en ERP werd nogmaals getest in de aanwezigheid van drug.
Stock Solutions and Drug Application
MK-0448 werd gesynthetiseerd door Xention Ltd. Cambridge UK. In een paar experimenten werd MK-0448 toegepast in cumulatief toenemende concentraties door rechtstreeks aliquots van een 10 mM voorraadoplossing met DMSO als oplosmiddel toe te voegen aan 50 ml van het circulerende badmedium. De DMSO-concentratie bedroeg nooit meer dan 0,2%, een concentratie die op zichzelf geen significante verandering teweegbracht. De preparaten werden gedurende 20 minuten blootgesteld aan elke concentratie MK-0448.
Analyse van actiepotentiaalparameters
De volgende standaardparameters van atriale APs werden geanalyseerd: rustmembraanpotentiaal, RMP (mV), actiepotentiaalamplitude, APA (mV), actiepotentiaalduur bij 20, 50 en 90% van de repolarisatie, APD20, APD50 en APD90 (ms), maximale depolarisatiesnelheid, dV/dtmax (V/s) en de “plateaupotentiaal” gedefinieerd als de gemiddelde absolute membraanpotentiaal (mV) in het tijdvenster tussen 20 en 30% van APD90 (PLT20). Preparaten met rustpotentialen die minder negatief waren dan -65 mV en amplitudes van minder dan 80 mV werden buiten beschouwing gelaten.
Statistische analyse
GraphPad Prism (versie 4.03) werd gebruikt voor statistische analyse. In de concentratie-respons curven (zie tabel 2) de waarden verkregen bij toenemende concentraties werden vergeleken met pre-drug controles door One-Way ANOVA gevolgd door Bonferroni’s multiple comparison test. De individuele actiepotentiaalparameters van SR en permanente AF preparaten in aanwezigheid van 3 uM MK-0448 werden vergeleken met pre-drug controles door gepaarde Student’s t-test (zie tabel 3). Verschillen worden als statistisch significant beschouwd bij P < 0,05.

Tabel 2. Concentratie-afhankelijke effecten van MK-0448 bij 1, 3, en 10μM (1 Hz).
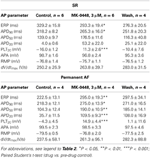
Tabel 3. Effecten van MK-0448 (3μM) op actiepotentiaal parameters en effectieve refractaire periode (ERP) van de menselijke rechter atriale trabeculae van patiënten in SR en AF (stimulatie frequentie 1 Hz).
Resultaten
Effecten van MK-0448 op Kv1.5 stroom
Kv1.5 stromen, die werd gemeten tijdens stap potentiaal veranderingen van een holding potentiaal van -60 mV tot verschillende test potentialen tussen -40 en +80 mV had een drempelpotentiaal van -30 mV, snel geactiveerd en nauwelijks geïnactiveerd binnen 500 ms (data niet weergegeven). Voor het testen van drugs kozen we 50 ms duur voltage-clamp stappen tot +50 mV die gemiddelde stroom amplitudes van 85,0 ± 10,5 pA / pF bij 0,5 Hz (n = 16) en 110,6 ± 16,9 pA / pF bij 3 Hz n = 17, P = 0,2133) uitlokten. MK-0448 (100 nM) blokkeerde de Kv1.5 stroomamplitude op een frequentie-afhankelijke manier (Figuur 1A). Bij 0,5 Hz bereikte de blokkade een steady-state binnen 5-10 min. na toediening van het geneesmiddel en herstelde zich gedeeltelijk tijdens een periode van 5 min. waarin de cel continu werd geklemd bij -60 mV (Figuur 1B). Wanneer cellen werden blootgesteld aan MK-0448 gedurende een periode van 5 minuten gehouden bij -60 mV, om kanalen in de gesloten toestand te houden, was IKv1.5 van de eerste post-rust puls niet verschillend van pre-rust. Latere pulsen in aanwezigheid van het geneesmiddel onthulden een snel begin van remming, toenemend met elke puls tot het bereiken van steady-state (figuur 1C). MK-0448 (100 nM) verminderde IKv1.5 van 82.3 ± 31.5 pA/pF tot 22.4 ± 6.0 pA/pF (n = 5) binnen 3 min van continue voltage-clamp stappen bij 0.5 Hz, en van 113.8 ± 52.7 pA/pF tot 12.9 ± 2.5 pA/pF bij 3 Hz (n = 4). Deze resultaten zijn consistent met MK-0448 remming van Kv1.5 afhankelijk van kanaalactivering.

Figuur 1. Effecten van MK-0448 op Kv1.5 stromen gemeten in HK2BN9 cellen bij 25°C. (A) Spanningsklem en stroomsporen verkregen vóór (zwart) en na superfusie van cellen met 100 nM MK-0448 (groen) gedurende 10 min. Snelheid van de klem pulsen zoals aangegeven. (B) Begin van het blokkerende effect van MK-0448 (100 nM) op de piek Kv1.5 stroom en herstel van de blokkade gedurende 5 min bij een houdpotentiaal van -60 mV. Individuele stroomsporen bovenaan werden verkregen op de tijdstippen aangegeven met kleine letters in de dagplot onderaan. (C) Begin van drug effect na blootstelling gedurende 5 min van continue afklemming bij -60 mV. Stap frequentie: 3 Hz.
Effecten van MK-0448 op actiepotentialen
Actiepotentialen opgenomen in rechter atriale trabeculae van patiënten in SR had de typische spike-en-koepel configuratie (figuur 2), in permanente AF weefsel de vorm was driehoekig en is het resultaat van elektrische remodeling . De meest opvallende concentratie-afhankelijke effect van MK-0448 (1-10 uM) op SR actiepotentialen bij de basale stimulatiefrequentie van 1 Hz was een robuuste verhoging van plateau potentieel (PLT20) (figuur 2; tabel 2). In deze reeks experimenten, de APD90 neiging te worden verkort (niet significant), terwijl APD20 en APD50 werden verlengd, het bereiken van het niveau van statistische significantie alleen bij de hoogste concentratie (zie tabel 2). Rustende membraanpotentiaal (RMP), actiepotentiaalamplitude (APA) en maximale depolarisatiesnelheid (dV/dtmax) werden niet significant beïnvloed door MK-0448 (zie Tabel 2). Voor en na de behandeling met het geneesmiddel volgden alle preparaten de stimulatie, zelfs bij de hoogste concentratie.
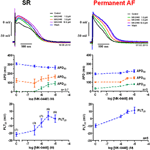
Figuur 2. Concentratie-afhankelijke effecten van MK-0448 op actiepotentialen opgenomen in rechter atriale trabeculae van patiënten in sinusritme (SR) en permanente atriale fibrillatie (AF). Boven: Individuele tracings voor typische experimenten, opgenomen in de aanwezigheid van toenemende concentraties van de verbinding (zie kleurcode). Blootstellingstijd bij elke concentratie: 20 min; controle: pre-drug controle. Midden en onder: Gemiddelde waarden ± s.e.m. van 7 experimenten in SR en 5 in AF, van actiepotentiaal duur bij 90, 50, en 20% van repolarisatie (APD90, APD50, en APD20) en plateau potentiaal (PLT20). Frequentie van stimulatie: 1 Hz. Let op, dat niet alle preparaten werden blootgesteld aan het volledige bereik van concentraties (aantallen preparaten aangegeven tussen haakjes).
De effecten van MK-0448 op ERP werden alleen bestudeerd bij 3 uM. Deze concentratie veroorzaakte maximale veranderingen binnen 40-50 minuten na toediening van het geneesmiddel, en deze waren gedeeltelijk omkeerbaar na 60 minuten van washout. In 6 preparaten van patiënten in SR, APD90, en ERP waren significant verkort (figuur 3; tabel 3). Vergelijkbare effecten werden waargenomen in 2 preparaten van patiënten in intermitterende AF (figuur 3).
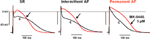
Figuur 3. Effecten van MK-0448 (3 μM, rode curve, pijl) op actiepotentialen opgenomen in rechter atriale trabeculae van patiënten in sinusritme (SR), intermitterend atriumfibrilleren (iAF) en chronisch atriumfibrilleren (AF). Originele opnamen van een voorbereiding in elke groep wordt getoond. c, pre-drug controle (zwart spoor). Stimulatiefrequentie 1 Hz.
In permanente AF trabeculae, MK-0448 verhoogde ook significant de plateau potentiaal in een vergelijkbare mate als in SR, maar in tegenstelling tot SR, verlengde APD op de drie geanalyseerde repolarisatie niveaus (figuren 2, 3; tabel 3). In permanente AF preparaten, werden APA, RMP, en dV/dtmax ook niet significant beïnvloed, met uitzondering van RMP met 10 μM MK-0448.
Omwille van beperkte beschikbaarheid konden we alleen de effecten van MK-0448 bestuderen in 2 trabeculae van patiënten in intermitterende AF, een typische opname wordt getoond in figuur 3; 3 andere werden gebruikt als TMCs. Vergelijkbaar met de resultaten in SR-preparaten, verkortte MK-0448 APD90 en ERP in de 2 intermitterende AF-preparaten.
In tijd-gematchte controle-experimenten met weefsel van patiënten in SR, intermitterende AF, en AF, veranderden actiepotentiaalparameters niet significant (gegevens niet weergegeven).
Discussie
De karakteristieke veranderingen in actiepotentiaalparameters die met MK-0448 in menselijke rechteratriumtrabeculae zijn waargenomen, zijn consistent met blokkade van Kv1.5-kanalen zoals eerder voor verschillende geneesmiddelen is gerapporteerd.
MK-0448 is beschreven als zeer selectief voor tot expressie komende Kv1.5 kanalen boven een grote verscheidenheid van standaard cardiale ionkanalen. hERG-kanalen zijn ongeveer 10.000-voudig, inward rectifier current Kir2.1 en Kir3.1/3.4 ongeveer 1000-voudig, en Kv7.1 (IKs) zo’n 10- tot 100-voudig minder gevoelig dan Kv1.5 (Pavri et al., 2012). De spanningsclampgegevens in een heteroloog expressiesysteem bevestigen dat MK-0448 (100 nM) een robuuste blokkade van menselijke Kv1.5 teweegbracht met een eerder traag begin van actie en gedeeltelijk herstel van de blokkade bij -60 mV. Hoewel onze resultaten geen nauwkeurige karakterisering van de interactie tussen het geneesmiddel en het kanaal mogelijk maken, geven ze duidelijk aan dat kanalen in rust zich herstellen van blokkering en dat activering noodzakelijk is voor de ontwikkeling van blokkering, wat wijst op een preferentiële binding aan open en/of geïnactiveerde kanalen.
In eerdere experimenten toonden we aan dat lage concentraties 4-aminopyridine selectief Iso (IKur) inhiberen in menselijke atriale myocyten (Wettwer et al., 2004). Deze blokker verhoogde de plateau potentiaal in SR preparaten (EC50 ~ 15 pM). Bovendien verkortte 4-AP bij concentraties die als selectief voor IKur-blokkade worden beschouwd, de APD90 in SR aanzienlijk, maar verlengde APD90 in permanente AF-trabeculae (Wettwer et al., 2004). De meest prominente effecten van MK-0448 op menselijke atriale APs, d.w.z, verhoging van de plateaupotentiaal, verkorting van APD90 in SR en verlenging van APD20, APD50 en APD90 in permanente AF, komen overeen met onze eerdere bevindingen met andere IKur-remmers, zodat we met vertrouwen kunnen concluderen dat MK-0448 inderdaad IKur blokkeert in menselijke atriale trabeculae.
In tegenstelling tot remming van hERG-kanalen, werd remming van IKs niet geassocieerd met een pro-aritmisch ventriculair effect in diermodellen (Lynch et al., 1999). Desalniettemin zou modulatie van IKs door MK-0448 ook de repolarisatiereserve in de ventrikel kunnen verminderen en aritmogeen kunnen worden in ventrikels onder de juiste omstandigheden (Lynch et al., 1999). Het is belangrijk op te merken dat het moeilijk is om het ventriculaire pro-aritmische risico te beoordelen van een geneesmiddel dat IKs moduleert in gezonde vrijwilligers met normale ventriculaire repolarisatiereserve. Daarom zou de atriale selectiviteit van MK-0448 zorgvuldig moeten worden beoordeeld bij patiënten.
De verkorting van APD90 en ERP door Kv1.5 blokkers in SR wordt voorgesteld te worden veroorzaakt door de duidelijke verhoging van de plateaupotentiaal in een spanningsbereik waar meer hERG-kanalen worden geactiveerd, en, hoewel snel geïnactiveerd, kunnen herstellen van inactivatie bij negatievere potentialen en zo de uiteindelijke repolarisatie versnellen (Gintant, 2000).
Naast verschillende veranderingen in de vorm van actiepotentialen, is het verlies van de snelheidsaanpassing van ERP en APD90 aan de frequentie erkend als een kenmerk van atriale remodellering, zowel bij patiënten (bijv, Attuel et al., 1982; Daoud et al., 1996) en in ex vivo studies (Franz et al., 1997; Dobrev en Ravens, 2003). In onze huidige studie en in de recente “first-time-in-human” studie met MK-0448 vonden alle elektrofysiologische testen plaats in een frequentiegebied veel lager dan dat van AF en men zou kunnen stellen dat op basis van onze SR-gegevens dat het niet verrassend is dat MK-0448 de AERP niet verlengde bij gezonde vrijwilligers (Pavri et al, 2012).
Experimenteel en klinisch bewijs suggereert dat atriumfibrilleren het gevolg is van microreentry die wordt uitgelokt door ectopische foci die zich in de nabijheid van de longaders bevinden (Haissaguerre et al., 1998). Farmacologische interventies voor het onderbreken van microreentry moeten de effectieve refractaire periode verlengen, terwijl voor de onderdrukking van ectopische foci een vermindering van de exciteerbaarheid vereist is. Ervan uitgaande dat MK-0448 inderdaad selectief IKur blokkeert, is het waarschijnlijker dat het de atriale refractiliteit (in AF) verhoogt dan dat het de exciteerbaarheid vermindert, hoewel het niet duidelijk is hoe de duidelijke verhoging van de plateau-amplitude zich verhoudt tot de verlenging van de ERP in AF. Het moet echter worden benadrukt dat de algehele vorm van de cardiale actiepotentiaal wordt bepaald door meerdere ionengeleidingen, vandaar dat interpretatie van actiepotentiaalgegevens niet doorslaggevend kan zijn met betrekking tot welke ionenkanalen bijdragen aan een bepaalde verandering.
In SR zagen we zelfs verkorting van de ERP met MK-0448 en we kunnen niet beoordelen of dit een anti- of pro-aritmisch effect in de atria is. Dit kan immers alleen worden beantwoord in een prospectieve fase 2-studie bij AF-patiënten. Het is echter vermeldenswaard dat er geen pro-aritmie werd gemeld voor MK-0448 (Pavri et al., 2012) of verkorting van de AERP in gezonde vrijwilligers. Andere Kv1.5-remmers, bv. XEN-D0101, die in de kliniek zijn geëvalueerd, hebben ook geen pro-aritmie (atriaal of ventriculair) gemeld bij gezonde vrijwilligers (Ford et al., 2013). Genetische studies hebben een associatie aangetoond van “loss-of-function” mutaties in het KCNA5-gen dat codeert voor Kv1.5 met familiair “lone” AF (Olson et al., 2006). In deze studie was er echter sprake van onvolledige genotypering/fenotypering van familieleden en geen bewijs voor primaire linkage. Inderdaad, de waarschijnlijkheid dat deze gegevens door toeval alleen worden waargenomen is tussen 10 en 15%. Een recente studie van meer dan 300 patiënten met vroeg-ontstaan alleenstaand AF onthulde 3 “gain-of-function” mutaties in KCNA5 naast verschillende loss-of-function mutaties, die de hypothese ondersteunen dat AF-gevoeligheid kan worden versterkt door ofwel verandering in KCNA5-functie (Christophersen et al, 2013).
Beperkingen van de studie
In sommige humane atriale preparaten blijft de APD niet stabiel tijdens langdurige superfusie met zoutoplossingen (doorgaans ~2 uur).-De indeling van patiënten in SR en AF is mogelijk niet altijd betrouwbaar, d.w.z., De SR-groep kan atriale weefsels bevatten van patiënten die niet herkende episodes van paroxysmale of recente AF hebben gehad.
Conclusie
Samengevat verhoogt de IKur-blokker MK-0448 consequent het actiepotentiaalplateau in menselijke atriale trabeculae, ongeacht de initiële vormen van de controle-actiepotentialen en ongeacht of de preparaten werden verkregen van patiënten in SR of permanente AF. In SR preparaten produceerde MK-0448 verkorting van APD90 en ERP, maar in permanent AF weefsel werden prominente APD90- en ERP-verlengende effecten waargenomen met het geneesmiddel. Voor de preventie van persisterend AF is verlenging van ERP door MK-0448 in AF-preparaten zeker een zeer wenselijke werkingswijze die het atriale myocard kan beschermen tijdens de fase van omgekeerde remodellering na cardioversie, hoewel dit, indien te wijten aan IKs-modulatie, een risico kan inhouden voor het induceren van ventriculaire proaritmie. Het moet nog blijken of selectieve IKur-medicijnen (i) effectiever zijn in het verlengen van ERP bij hogere atriale snelheden, (ii) recent beginnend AF farmacologisch kunnen omzetten, (iii) de AF-last in paroxysmale AF kunnen verminderen, en (iv) het terugkeren van persistent AF kunnen voorkomen.
Conflict of Interest Statement
James Milnes en John Ford zijn medewerkers van Xention Ltd., John Ford is medeoprichter en houdt aandelen in Xention Ltd., Ursula Ravens is opgetreden als consultant voor Xention. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer hebben niets bekend te maken.
Acknowledgments
De auteurs erkennen dankbaar de financiële steun van de Europese Unie (FP7-Health T2-2010-261057 “EUTRAF”) en Xention Limited. Wij danken alle patiënten en de hartchirurgen Klaus Matschke en Michael Knaut voor hun onschatbare steun, en Konstanze Fischer voor haar deskundige technische bijstand.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M., and Ravens, U. (1996). Differences between outward currents of human atrial and subepicardial ventricular myocytes. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J., and Coumel, P. (1982). Failure in the rate adaptation of the atrial refractory period: its relationship to vulnerability. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. (2008). Pathologie-specifieke effecten van de I(Kur)/I(to)/I(K,ACh) blokker AVE0118 op ionenkanalen in humane chronische atriale fibrillatie. Br. J. Pharmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. (2013). Genetische variatie in KCNA5: impact op de atriale-specifieke kaliumstroom IKur bij patiënten met lone atriumfibrilleren. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. (1996). Effect van atriale fibrillatie op atriale refractoriness bij mensen. Circulation 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dobrev, D., and Ravens, U. (2003). Remodeling van cardiomyocyte ionkanalen in humane atriale fibrillatie. Basic Res. Cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. (2013). Humane elektrofysiologische en farmacologische eigenschappen van XEN-D0101: een nieuwe atriale selectieve Kv1.5/IKur remmer. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J. W., and Milnes, J. T. (2008). New drugs targeting the cardiac ultra-rapid delayed-rectifier current (I Kur): rationale, farmacology and evidence for potential therapeutic value. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e3181719b0c
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J., and Chavez, M. (1997). Electrical remodeling of the human atrium: similar effects in patients with chronic atrial fibrillation and atrial flutter. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gintant, G. A. (2000). Karakterisering en functionele gevolgen van vertraagde gelijkrichtstroomtransienten in ventriculaire repolarisatie. Am. J. Physiol. Heart Circ. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. (1998). Spontane initiatie van atriumfibrilleren door ectopische slagen afkomstig uit de pulmonale venen. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM199809033391003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lynch, J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Antiaritmische werkzaamheid van selectieve blokkade van de traag activerende vertraagde gelijkrichterstroom, I(Ks), in canine modellen van kwaadaardige ischemische ventriculaire aritmie. Circulation 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mays, D.J., Foose, J.M., Philipson, L.H., and Tamkun, M.M. (1995). Localization of the Kv1.5 K+ channel protein in explanted cardiac tissue. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. (2006). Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., Lazarus, N., Lynch, J. J., Salata, J. J., et al. (2012). MK-0448, een specifieke Kv1.5 remmer: veiligheid, farmacokinetiek en farmacodynamische elektrofysiologie in experimentele diermodellen en bij de mens. Circ. Arrhythm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. (2006). Functional modulation of the transient outward current Ito by KCNE beta-subunits and regional distribution in human non-failing and failing hearts. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U. (2010). Antiaritmische therapie bij atriumfibrilleren. Pharmacol. Ther. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Ultra-snelle vertraagde gelijkrichterkanalen: moleculaire basis en therapeutische implicaties. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L., and Lynch, J. J. Jr. (2006). In vivo cardiale elektrofysiologische effecten van een nieuwe difenylfosfine oxide IKur blokker, (2-Isopropyl-5-methylcyclohexyl) difenylfosfine oxide, in rat en niet-menselijke primaat. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Snyders, D. J., Tamkun, M. M., and Bennett, P. B. (1993). Een snel activerend en langzaam inactiverend kalium kanaal gekloond uit het menselijk hart. Functional analysis after stable mammalian cell culture expression. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tamargo, J., Caballero, R., Gomez, R., and Delpon, E. (2009). I(Kur)/Kv1.5 channel blockers for the treatment of atrial fibrillation. Expert Opin. Investig. Drugs 18, 399-416. doi: 10.1517/13543780902762850
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, Z., Fermini, B., and Nattel, S. (1993). Aanhoudende depolarisatie-geïnduceerde uitgaande stroom in menselijke atriale myocyten. Bewijs voor een nieuwe vertraagde rectifier K+ stroom gelijkaardig aan Kv1.5 gekloonde kanaalstromen. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. (2004). Rol van IKur in de controle van actiepotentiaal vorm en contractiliteit in het menselijk atrium: invloed van chronische atriale fibrillatie. Circulation 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text