De Flaviviradae is een grote familie van virale ziekteverwekkers die verantwoordelijk zijn voor het veroorzaken van ernstige ziekte en sterfte bij mens en dier. De familie bestaat uit drie geslachten: Flavivirus, Pestivirus en Hepacivirus. Het geslacht Flavivirus, het grootste van de drie, bevat meer dan 70 virussen, waaronder het knokkelkoortsvirus (DV), het Japanse encefalitisvirus (JEV), het West-Nijlvirus (WNV), het gele koortsvirus (YFV) en het Zika-virus (ZIKV). Flavivirussen vertonen morfologische uniformiteit met een icosaëdervormig kapsel en een nauwsluitende, puntige omhulling. De grootte van het capside is ongeveer 30 nm en het hele virion meet 45 nm. Het genoom van de flavivirussen is een enkelstrengs sense RNA van ongeveer 10 kb groot. Het codeert voor 3 structurele eiwitten: capside (C-eiwit), membraan (M, dat wordt uitgedrukt als prM, de voorloper van M en envelope (E-eiwit) en 7 niet-structurele eiwitten: NS1, NS2A, NS2B, NS3, NS4A, NS4B en NS5 (figuur 1 a,b).
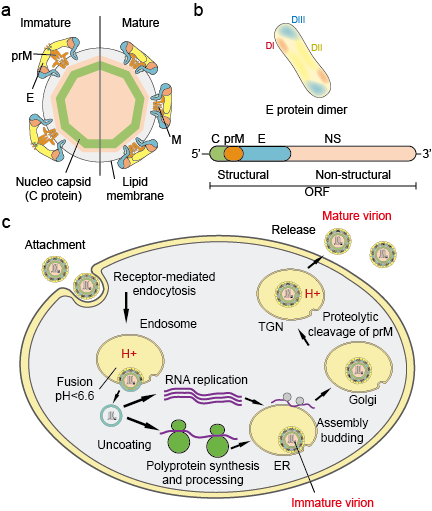
Figuur 1. Flavivirusdeeltjes (a), eiwitten (b) en levenscyclus (c).
Browse All Flavivirus Related Products
Flaviviruslevenscyclus:
Virionen hechten zich aan het oppervlak van een gastheercel en dringen vervolgens de cel binnen door receptorgemedieerde endocytose (figuur 1c). Er zijn verschillende primaire receptoren en co-receptoren met lage affiniteit voor flavivirussen geïdentificeerd. Verzuring van het endosomale blaasje leidt tot conformatieveranderingen in het virion, fusie van de virale en celmembranen, en ontmanteling van het deeltje. Zodra het genoom in het cytoplasma is vrijgekomen, wordt het positieve-sense RNA vertaald in een enkel polyproteïne dat co- en post-translationeel wordt verwerkt door virale en gastheerproteasen. De genoomreplicatie vindt plaats op intracellulaire membranen. Virusassemblage vindt plaats aan het oppervlak van het endoplasmatisch reticulum (ER) wanneer de structurele eiwitten en het nieuw gesynthetiseerde RNA in het lumen van het ER ontkiemen. De resulterende niet-infectieuze, onrijpe virale en subvirale deeltjes worden door het trans-Golgi netwerk (TGN) getransporteerd. De onrijpe viriondeeltjes worden door het gastheerprotease furine gesplitst, waardoor rijpe, infectieuze deeltjes ontstaan. Subvirale deeltjes worden ook door furine gekliefd. Volgroeide virionen en subvirale deeltjes worden vervolgens door exocytose vrijgemaakt.
Flavivirus Epidemiologie:
Mosquito-borne flavivirussen worden in de natuur overgedragen in een of meer afzonderlijke of overlappende cycli die een muggenvector omvatten, over het algemeen Aedes-muggen voor YFV en DENV en Culex-muggen voor JEV en WNV, en een gastheer van zoogdieren of vogels. Transmissie tussen muggen en gewervelde gastheren wordt horizontale transmissie genoemd en veroorzaakt ziekte bij gewervelde dieren. In tegenstelling tot horizontale transmissie kunnen door muggen overgedragen flavivirussen in het milieu in stand gehouden worden door verticale, d.w.z. transgenerationele, transmissies die de verspreiding van flavivirussen alleen in muggen mogelijk maken. Het meest directe bewijs voor de verticale overdracht van door muggen overgedragen flavivirussen is afkomstig van de isolatie van virus uit geïnfecteerde larven, vermoedelijk via transovariële overdracht. Deze observatie is consistent met de detectie van virale antigenen in ovariumweefsels van geïnfecteerde muggen. (Figuur 2)
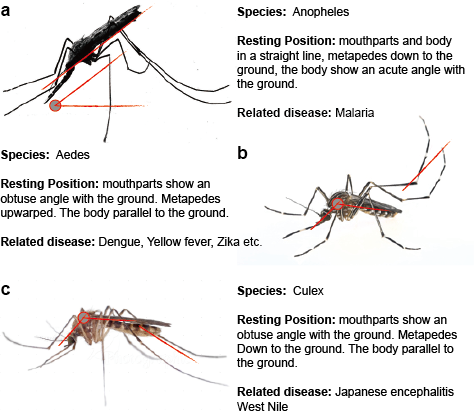
Figuur 2. Drie typische muggen die ziekten overbrengen.
Flavivirussen zijn wereldwijd verspreid, en sommige leden van het genus vormen een groot probleem voor de volksgezondheid (bv. gele koorts virus , dengue virus , West-Nijl virus en Japanse encefalitis virus ), met een hoge morbiditeit en/of mortaliteit. In het laatste decennium hebben flavivirussen een verhoogde prevalentie laten zien, waardoor ze een risico vormen voor meer dan 3 miljard mensen wereldwijd, wat ze tot een paradigma van opkomende ziekten maakt.
In de laatste 50 jaar hebben veel flavivirussen, zoals dengue-, West-Nijl- en gele-koortsvirussen, een dramatische toename laten zien in incidentie, ernst van de ziekte en/of geografisch bereik. Van het milieu afkomstige virale ziekteverwekkers vertonen betrekkelijk uniforme epidemiologische kenmerken. Muggen, teken en bijtende vliegen fungeren als vectoren voor de meeste menselijke virale ziekten. Menselijke ziekten treden op wanneer de vectoren actief zijn, meestal in het voorjaar, de zomer en de herfst in een gematigd klimaat, en vertonen vaak duidelijke epidemiologische kenmerken die overeenkomen met de habitat van de vector (figuur 3).
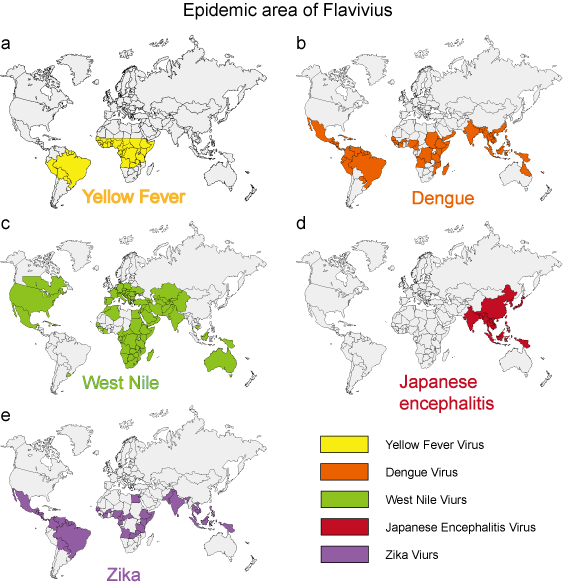
Figuur 3. Het epidemische gebied van 5 typische flavivirussen.
Manifestaties:
Flavivirussen variëren sterk in hun pathogeen potentieel en mechanismen voor het veroorzaken van ziekte bij de mens (tabel 1). Menselijke infectie met zowel door muggen als teken overgedragen flavivirussen wordt geïnitieerd door afzetting van virus door de huid via het speeksel van een geïnfecteerd geleedpotige. Het virus vermenigvuldigt zich plaatselijk en in regionale lymfeklieren en leidt tot viremie. Belangrijke syndromen en voorbeelden van veroorzakende flavivirussen zijn: encefalitis (Japanse encefalitis), koortsachtige ziekte met huiduitslag (dengue-virus), hemorragische koorts (Kyasanur Forest disease-virus en soms dengue-virus), en hemorragische koorts met hepatitis (gele-koortsvirus).
Tabel 1 Overzicht van de belangrijkste Flavivirussen
| Virale soort | Overbrengende vector | Geografische verspreiding | Syndroom |
|---|---|---|---|
| Gele koorts | Mosquito (Aedes) | Zie figuur 3a | Hemorrhagische koorts |
| Dengue | Mosquito (Aedes, Stegomyia) |
Zie figuur 3b | Dengue syndroom, DHF, DSS |
| West-Nijlkoorts | Mosquito (Culex), teken (Argasidae) |
Zie figuur 3c | Dengue syndrome, encefalitis |
| Japanse encefalitis | Mosquito (Culex) | Zie figuur 3d | Encefalitis |
| Zika | Mosquito (Aedes) | Zie figuur 3e | Microcefalie |
Diagnostiek:
De klinische diagnose van de verschillende flavivirussen is niet betrouwbaar vanwege de aspecifieke symptomen, en laboratoriumdiagnose is verplicht om de etiologie van de ziekte te bevestigen. Bij flavivirusinfecties kan het virus in serum of plasma worden aangetroffen, in het algemeen 2-7 dagen na het begin van de ziekte, en de duur van deze viremische fase en de gedetecteerde virale belasting variëren naar gelang van het infecterende virus (tabel 2). Gewoonlijk ontstaat na 5-7 dagen na het begin van de ziekte een immuunrespons tegen de infectie, met IgM-antilichamen die na 15 dagen een piek bereiken. Deze IgM-antilichamen kunnen maanden (zoals in het geval van DENV) tot jaren (zoals in het geval van WNV-infecties) aanhouden. Het verschijnen van IgG treedt op na 8-10 dagen vanaf het begin en kan het hele leven worden opgespoord. De bijzondere kenmerken van elk flavivirus zijn van grote invloed op de diagnostische algoritmen die moeten worden toegepast bij de identificatie van flavivirale infecties. In het algemeen hebben veel laboratoria gekozen voor serologische tests om door flavivirussen veroorzaakte infecties te diagnosticeren, vanwege de nauwkeurigheid daarvan en de beschikbaarheid van commerciële tests op basis van hoge kwaliteitsnormen. De aanwezigheid van serologische kruisreacties tussen de verschillende virussen en de tijd die nodig is om de antilichamen bij sommige infecties op te sporen, belemmeren echter de bruikbaarheid van serologie als diagnostisch instrument voor acute flavivirusinfecties. Virale isolatie vormt de ‘gouden standaard’ methode om tot een bevestigde flavivirus diagnose te komen.
Browse All Flavivirus ELSIA Kit and Flavivirus RDT Products
Tabel 2. Flavivirus diagnose algoritmen.
| Acute fase | Convalescent fase | Voorkeur monster† | Verwachte virale belasting | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, virusisolatie | IgM, IgG | Serum, plasma en weefsel | High |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, virusisolatie | IgM, IgG | Serum, plasma, CSF en PBMC’s | Up to 106 virions/ml |
| WNV | RT-PCR, IgM, IgG | IgM, IgG | CSF en serum | Low |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, serum, bloed en PBMC’s | Laag |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF en serum | Laag |
| Gould E A, Solomon T. Pathogene flavivirussen. The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. Phylogenetic relationships of flaviviruses correlate with their epidemiology, disease association and biogeography . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Fylogenie van het genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle. Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Flavivirus-mosquito interacties. Viruses, 2014, 6(11): 4703-4730. |