De sulfonering van methylbenzeen
Methylbenzeen is reactiever dan benzeen vanwege de neiging van de methylgroep om elektronen naar de ring te “duwen”.
Het effect van deze grotere reactiviteit is dat methylbenzeen zal reageren met rokend zwavelzuur bij 0°C, en met geconcentreerd zwavelzuur als ze worden verwarmd onder reflux gedurende ongeveer 5 minuten.
Naast het effect op de reactiesnelheid, moet je bij methylbenzeen ook nadenken over waar de sulfonzuurgroep op de ring terechtkomt ten opzichte van de methylgroep. Methylgroepen hebben de neiging om nieuwe groepen naar de 2- en 4-positie aan de ring te “dirigeren” (ervan uitgaande dat de methylgroep op de 1-positie zit). Van methylgroepen wordt gezegd dat ze 2,4-directief zijn.
Dus krijg je een mengsel dat hoofdzakelijk uit twee isomeren bestaat. Slechts ongeveer 5 – 10% van het 3-isomeer wordt gevormd. De belangrijkste reacties zijn:
![]()
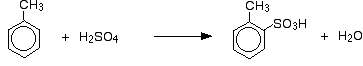
en:
![]()
In het geval van sulfonering hangt de precieze verhouding van de gevormde isomeren af van de temperatuur van de reactie. Naarmate de temperatuur stijgt, krijg je steeds meer van het 4-isomeer en steeds minder van het 2-isomeer. Dit komt omdat sulfonering omkeerbaar is. De sulfonzuurgroep kan weer van de ring vallen, en ergens anders weer aanhechten. Dit bevordert de vorming van de thermodynamisch meest stabiele isomeer. Deze uitwisseling gebeurt meer bij hogere temperaturen.
De 4-isomer is stabieler omdat er geen rommel in het molecuul is zoals het geval zou zijn als de methylgroep en de sulfonzuurgroep naast elkaar zouden zitten.