Moleculaire Elementen
Er zijn veel stoffen die bestaan als twee of meer atomen die zo sterk met elkaar verbonden zijn dat ze zich als één deeltje gedragen. Deze multi-atoomcombinaties worden moleculen genoemd. Een molecuul is het kleinste deel van een stof dat de fysische en chemische eigenschappen van die stof heeft. In sommige opzichten is een molecuul vergelijkbaar met een atoom. Een molecuul bestaat echter uit meer dan één atoom.
| Hydrogen, H | Oxygen | Nitrogen | Fluor | Chlorine | Bromine | Iodine |
Sommige elementen bestaan van nature als moleculen. Zo bestaan waterstof en zuurstof als twee-atomige moleculen. Andere elementen bestaan ook in natuurlijke vorm als diatomeeënmoleculen – moleculen met slechts twee atomen (tabel PageIndex{1}). Zoals bij elk molecuul worden ook deze elementen aangeduid met een molecuulformule, een formele opsomming van wat en hoeveel atomen er in een molecuul zitten. (Soms wordt alleen het woord formule gebruikt, en wordt de betekenis ervan afgeleid uit de context). Bijvoorbeeld, de moleculaire formule voor elementaire waterstof is H2, met H als symbool voor waterstof en het subscript 2 dat aangeeft dat er twee atomen van dit element in het molecuul zijn. Andere diatomeeënelementen hebben soortgelijke formules: O2, N2, enzovoort. Andere elementen bestaan in de vorm van moleculen – zwavel bijvoorbeeld bestaat normaal gesproken als een molecuul met acht atomen, S8, terwijl fosfor bestaat als een molecuul met vier atomen, P4 (figuur).
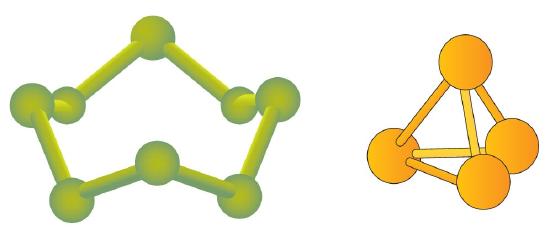
Figuur (PaginaIndex{1}) toont twee voorbeelden van de manier waarop moleculen in deze tekst zullen worden weergegeven. Een atoom wordt voorgesteld door een klein bolletje of bolletje, dat meestal aangeeft waar de kern zich in het molecuul bevindt. Een cilindrische lijn die de bolletjes verbindt, stelt de verbinding voor tussen de atomen die van deze verzameling atomen een molecuul maken. Deze verbinding wordt een chemische binding genoemd.