分子構造、極性、その他の特性を理解するには、与えられた化合物とそのルイス構造の基本特性をいくつか知る必要があります。 SF4はSulfur Tetrafluorideの化学式である。 無色の腐食性ガスで、いくつかの有機フッ素化合物の合成に使用される。 SF4はかなり危険な化合物だが、化学会社や製薬会社で広く使用されている。
| 分子名 | |
| SF4のハイブリット化 | sp3 ハイブリッド化 |
| 結合角 | 102度と173度 |
| SF4の分子形状 | 三方両錐 |
この分子の特性を理解するために。 反応性、極性など、まずSF4のルイス構造を知る必要があります。
目次
SF4の分子構造
分子式やVSEPRモデルを使って、ある分子の分子構造を理解するのは簡単である。 分子式は、与えられた化合物中に存在する原子の正確な数と種類を知るのに役立つ。 ここでは、硫黄原子1個とフッ素原子4個が含まれており、AX4Eの分子式と類似している。
分子式がAX4Eである分子は、三角両錐型の分子構造をしている。 ここでは硫黄原子と結合する2つのフッ素原子が赤道上にあり、残りの2つは軸上にある。 中央の原子には1つの孤立ペアがあるため、結合する電子のペアに反発し、形状が少しゆがんでシーソーのように見えるのです。 電子はVSEPR規則に従ってこのような配置パターンをとることで、孤立電子対の間の反発力を最小にし、分子の安定性を最大にします。
したがって、SF4は三角両錐型の分子構造をしている。
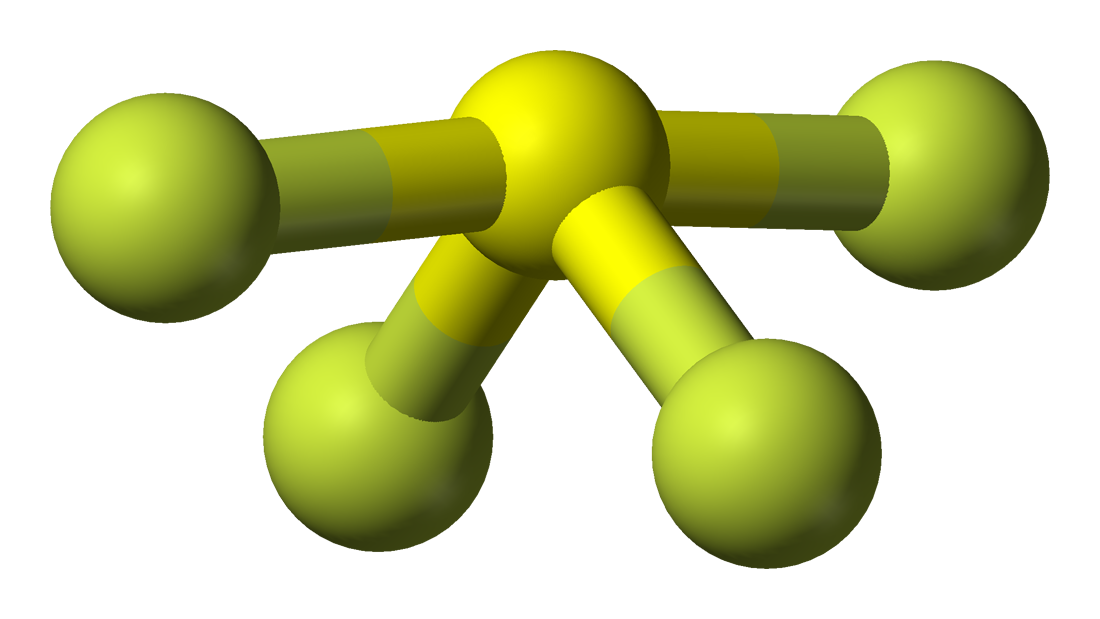
SF4のルイス構造
ルイス構造とは、分子内の結合と価電子を絵にしたものです。 2つの原子間に形成される結合は線で、結合を形成しない価電子は点で描かれる。 結合に関与する価電子を結合電子対、結合に関与しない価電子を非結合電子対または孤立電子対と呼ぶ。
また、SF4のルイス構造を描くには、まずこの分子の価電子の総数を知る必要がある。
おわかりのように、この化合物には硫黄原子が1つ、フッ素原子が4つあります。 この化合物の価電子の総数を知るには、両方の原子の価電子を個別に知る必要があります。
- 硫黄の価電子数:6
- フッ素の価電子数:4。 4* (7)
(フッ素原子は4つなので。 SF4の価電子総数=硫黄の価電子数+フッ素の価電子数
= 6 + 28
= 34価電子
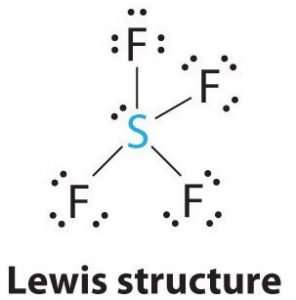
これで価電子総数がわかったので、次にこの価電子総数から、SF4ルイス構造について考察する。 原子の間の結合の形成や分子の完全な配置を理解することも容易になるでしょう。
硫黄は最も電気陰性なので、この分子の中心原子になり、この中心原子の両側に4つのフッ素原子が結合を形成します。 すべてのフッ素原子が中心原子と結合するので、フッ素原子の価電子4個と硫黄原子の価電子4個を使って、分子構造中に4つの結合があることになります。 つまり、今、8個の価電子が使われ、価電子の数は34個から24個に減少する。 フッ素原子はすべて6価の電子を持ち、中心原子は2価の電子を持っています。
SとFの間に線を引いて結合を示し、一対の電子は点で表します。 各フッ素原子には3組の6価の電子(ドットで示す)があり、硫黄と1つの結合を持つことになります。
したがって、SF4のルイス構造では、中心原子の硫黄は、1つの単独電子と4つの結合電子を持つことになります。 同時に、フッ素原子はそれぞれ3個の孤立電子を持つことになります。
SF4は極性ですか?
与えられた化合物のルイス構造と分子構造がわかると、その分子の極性を描くのが容易になります。 ここでは、中央の硫黄原子に1つの単独ペアと4つの結合電子があるため、中央の原子の電子分布が非対称になります。
また、分子の形がシーソーのようになっているので、2つのフッ素原子は互いの双極子モーメントを打ち消すことができますが、残りの2つは電子の配列の関係で打ち消すことができません。 そして、フッ素原子は硫黄原子よりも電気陰性度が高いため、電荷の分布が不均一になる。 したがって、双極子モーメントが打ち消されず、分子が極性を持つことになる。 そう、SF4は極性を持つのです。
SF4 Hybridization
SF4分子の混成を知るために、まず中心原子の電子密度領域を見てみましょう。
硫黄は4つの結合電子と1つの孤立電子を持っており、電子密度の領域は全部で5つあります。 したがって、硫黄原子は5つの混成軌道、1つの3s軌道、3つの3p軌道、1つの3d軌道を使う。 このように原子の周りに電子が配置され、混成軌道を持つことで、sp3d混成となる。 また、立体数を使って混成度を知ることもできる。ここでは、硫黄原子の立体数は5である。
したがってSF4はsp3d混成であることがわかります。
SF4 結合角度と形状
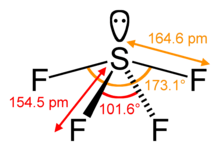
中心の硫黄原子は隣接するフッ素原子と4つの結合を結び、1つの単独電子を持つ。 赤道上のフッ素原子は102度、軸上のフッ素原子は173度の結合角を持ち、三角両錐型分子構造とは少し異なるシーソー型になる。
中心原子にローンペアがあるため、赤道上のフッ素原子は結合角が120度から102度に、軸上のフッ素原子は180度から173度に変化していることがわかります。
Conclusion Remarks
すべての特性を結論づけると、
- Sulfur Tetrafluorideは34価の電子を持っており、そのルイス構造で4つの共有結合と中心原子の1つの単独電子対を形成していると言えるでしょう。
- 各フッ素原子に3つの孤立対があります。
- 式AX4Eの分子形状を持ち、シーソー型を形成し、三角両錐の分子形状を持ちます。
- SF4はsp3d混成で極性を持っています。