Multiplex ligation-dependent probe amplification (MLPA) は、2002年にMRC-オランダが開発した分子技術で、その名の通り多重プローブ増幅法です。 一言で言えば、MLPAは核酸配列の定量を迅速かつ効率的に行うことができる高感度な技術です。 遺伝子のコピー数変化の検出(欠失や重複など)、DNAのメチル化状態の特定、一塩基多型(SNP)や点突然変異の検出、mRNAの定量などに応用でき、世界中の多くの研究室で実施されています。 そのため、細胞遺伝学、がん研究、人類遺伝学など、多くの研究・診断分野で利用されています。
どのように機能するのですか?
MLPAは以下のステップで構成されています(図1)。
- 変性
- ハイブリダイゼーション
- ライゲーション
- 増幅(PCRによる)
- 断片分離とデータ解析
図1 MLPA法の可視化 (Schouten, Jan P. から引用) – 図1-MLPA技術の可視化(Schouten, Jan P., ら1)。 また、MLPA解析で得られた典型的なエレクトロフェログラムでは、エクソン46の欠失(赤矢印)が観察される。 (Electropherogram adapted from https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1-変性と2-ハイブリダイゼーション
変性では、アニールしたDNA鎖を分離し、二本鎖DNAを一本鎖にする。
ハイブリダイゼーションではDNAサンプルと特定のプローブとをハイブリッド化する。 マルチプレックス技術であるため、各サンプルを最大60のプローブで同時に分析することができ、異なる部位をターゲットにすることができます!
これらのプローブは、増幅過程でPCRプライマーに結合するプライマー配列を持っています。 すべての異なるプローブは、同じプライマー結合配列を持つことになります。 さらに、プローブはターゲット部位に相補的なハイブリダイゼーション配列も持っており、プローブがDNAに結合することができるようになる。 両方のプローブはDNA鎖上の隣接する部位にハイブリダイズする。
ペアのプローブのうちの1つは、標的部位ごとに長さが異なるスタッファー配列を含んでいる。 このstuffer配列の長さがプローブごとに異なるため、マルチプレックスが可能になる。 そのため、それぞれの増幅産物が固有の長さを持つことが期待できる!
3-Ligation
Ligationのステップでは、2つのプローブを結合させる。 このステップでは、DNAリガーゼと呼ばれる特定の酵素が使われる。 この酵素は、標的部位のDNA鎖の隣接部位に既にハイブリダイズしているプローブを結合させる。 MLPAプロトコルで使用されているリガーゼは、NAD依存性のリガーゼ酵素であるligase-65で、他のアプリケーションでも有用です
さて、ここで疑問が生じます。もし私たちの目的が両方のプローブを結合することなら、なぜ最初から別々の分子になっているのでしょうか? そう、どちらのプローブもPCRプライマーの結合部位を含んでいるのです。 つまり、もしプローブを1つの分子として使えば、DNAの標的部位がなくても増幅産物が得られるので、非特異的な増幅ができるのである。 リガーゼという酵素は極めて特異的であり、プローブと標的部位の間にミスマッチがあれば、リガーゼはプローブと結合できず、増幅は起きない。 その結果、MLPAでは特定の点変異を検出し、偽遺伝子と本当の標的遺伝子を区別することもできる
4-Amplification
次のステップは増幅で、これは基本的にポリメラーゼ連鎖反応(PCR)である(表1)。 PCRでは、ポリメラーゼ、dNTPs、フォワードプライマーとリバースプライマーが加えられる。 すべてのプローブは同じPCRプライマー配列を持っているので、1組のユニバーサルプライマーを加えるだけで、すべての標的を研究することができる。 フォワードプライマーは蛍光標識されており、解析中の可視化と定量を可能にする。
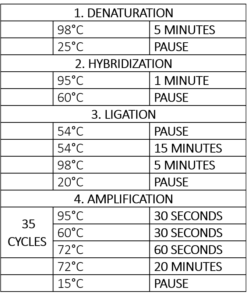
Table 1 – MLPA反応のサーモサイクラープログラム
5-Fragment Separation and Data Analysis
増幅後、フラグメントはキャピラリー電気泳動で分離される。 キャピラリー電気泳動では、断片をその長さに基づいて分離し、異なる長さの断片をエレクトロフェログラムと呼ばれるピークパターンとして表示します(図1)。 各アンプリコンは、特定のプローブ上のスタッファー配列により、それぞれ異なる既知のサイズを持つため、データ解析時に各アンプリコンを定量することができる
キャピラリー電気泳動で得られたデータは、解析のための入力となる。 MRC-Hollandでは、データ解析用のソフトウェアCoffalyserを無償で提供しています。
各サンプルと参照サンプルを比較することで、プローブ比率を求めることができます。 このプローブ比から、ある遺伝子がいくつのコピー数を持っているかがわかる。 ヒトの遺伝子は2倍体であるため、サンプルが2つのコピーを持つ場合、比率は1.0となる。つまり、サンプルのプローブは参照サンプルと同じ数の遺伝子を得ている。
MRC-Hollandでは、様々なキットを提供しており、お客様の問題解決の糸口となるようなキットが見つかるかもしれません。 しかし、もう少し曖昧なものを見つけたい、あるいはどのキットにもないものを研究したい場合は、自分でプローブをデザインすることができます。
MLPAの利点
- MLPAは高感度、堅牢、ハイスループットな技術です。 したがって、点変異しか見つけることができないシーケンサーのような他の技術よりも大きな利点があります。 さらに、FISHとは異なり、MLPAでは小さな遺伝子変化を検出することができます。
- 結果は24時間以内に得られ、マルチプレックス反応であるため、迅速かつ効率的に情報収集ができます。
- MLPAプロトコルに小さな変更を加えることにより、様々な応用が可能になります。 例えば、消化ステップを追加することで、MLPAはDNAのメチル化パターンの検出にも使用できます(Methylation specific-MLPA (MS-MLPA))。
Limitations of MLPA
- MLPA は不純物に極めて敏感なものです。 そのため、試料の調製や技法の実施には細心の注意が必要です。
- まれな多型や突然変異により、プローブからのシグナルが減少することがあり、他の技法で検査する必要がある場合があります。 しかし、欠点がないわけではありません。 ご存知のように、どの手法にも欠点があり、最も効率的で感度の高い手法を使用するために、それぞれの用途について十分に検討する必要があります」
MLPAを使ったことがありますか? この技術についてどのようにお考えですか?