By Alyssa Cecchetelli and Lukas Morgan
Model organisms are vital tools used by researchers around the globe. これらの生物はヒトと多くの遺伝子を共有しており、研究室での維持が容易で、世代時間が短いため、遺伝子操作の効果を研究しやすくなっています。 このブログ記事では、人気のある 5 種類のモデル生物を取り上げますが、他にもたくさんあります。
The house mouse (Mus musculus)
 多くの研究者が最も好む哺乳類モデル生物、マウス (Mus musculus) から始めましょう。 マウスは、哺乳類としては比較的短い世代時間(生まれてから出産するまでの期間)が10週間程度であり、科学者にとって哺乳類モデル生物として多くの利点を持っている。 成体マウスは3週間ごとに繁殖するので、科学者は一度に数世代のマウスを同時に観察できる。
多くの研究者が最も好む哺乳類モデル生物、マウス (Mus musculus) から始めましょう。 マウスは、哺乳類としては比較的短い世代時間(生まれてから出産するまでの期間)が10週間程度であり、科学者にとって哺乳類モデル生物として多くの利点を持っている。 成体マウスは3週間ごとに繁殖するので、科学者は一度に数世代のマウスを同時に観察できる。
マウスは他の多くのモデル生物よりも遺伝的にも生理的にも人間に似ているので、人間の病気の研究によく使われる。 マウスの病気は人間の病気と似たような表現型を多く示し、研究者がさまざまな治療法を開発するのに役立ってきました。 例えば、癌などの疾患の研究では、他のモデル生物や細胞培養による研究よりも、癌細胞、治療薬、体内の他の部分の間の複雑な相互作用をマウスの方が再現しやすいため、多くの科学者がマウスを利用している。 例えば、Scott Loweの研究室では、マウスを利用して、白血病におけるさまざまな変異が治療法の違いにどのような影響を及ぼすかを研究した(Zuber et al.) Lowe研究室は、白血病に見られるさまざまな変異を保有するレトロウイルスベクターをマウスに注射することで、がん細胞を化学療法に対してより抵抗性にする一連の変異を特定することができたのです。 これらのプラスミドはAddgeneで入手できます。
モデル生物としてのマウスのもうひとつの利点は、遺伝的に扱いやすいということです。 マウスはCRISPRなどのツールで簡単に操作でき、トランスジェニック系統を作ることができます。
 Drosophila melanogaster(ショウジョウバエ)も人気のあるモデル生物で、一般的には「ミバエ」と呼ばれています。 ショウジョウバエは 1 世紀以上にわたって科学研究に利用されてきましたが、ショウジョウバエ研究の「父」として知られるトーマス・ハント・モーガンによって最前線に引き出されたのです。 モーガンは、私たちがDNAを遺伝物質と認識するよりもずっと前に、ミバエを使って染色体の中に遺伝子があることを発見したのです(Jennings, 2011)。
Drosophila melanogaster(ショウジョウバエ)も人気のあるモデル生物で、一般的には「ミバエ」と呼ばれています。 ショウジョウバエは 1 世紀以上にわたって科学研究に利用されてきましたが、ショウジョウバエ研究の「父」として知られるトーマス・ハント・モーガンによって最前線に引き出されたのです。 モーガンは、私たちがDNAを遺伝物質と認識するよりもずっと前に、ミバエを使って染色体の中に遺伝子があることを発見したのです(Jennings, 2011)。
ミバエは、研究室での栽培と維持が簡単で安価であり、ライフサイクルが8~14日と短く、外部に産卵する多数の子を産むため、優れたモデル生物となる。 また、ミバエは遺伝子操作が比較的容易である。 トランスジェニックマウスを作るのに数ヶ月かかるのに比べ、ミバエの新系統はわずか6週間で作ることができるのだ。 長年にわたり、ハエは発生、遺伝学、神経系などさまざまなテーマを研究するための理想的なモデル生物となっています。 また、ヒトの疾患原因遺伝子の75%にハエの機能的ホモログがあると推定されることから、ハエは治療薬発見の可能性を持つ重要なヒト疾患モデルとしても浮上しています (Pandey and Nichols, 2011)。
ミバエを用いる大きな利点は、GAL4/UASやLexAシステムなどの遺伝子ツールが揃っていて、目的の遺伝子のレベルや時空の表現を容易に制御できることにあります。 このような遺伝子発現の制御は、他のモデル系でも可能ですが、非常に困難で時間がかかる場合があります。 GAL4/UASは1993年にNorbert Perrimonの研究室によって初めて報告され、それ以来継続的に改良が加えられている。 もしこれらのシステムに興味があるなら、ハエの特定の細胞で遺伝子発現を最適に制御するために使用できるモジュール式ベクターのセットを作成したGerald Rubinの研究室をチェックしてください (Pfeiffer et al., 2010)
Yeast (Saccharomyces cerevisiae)
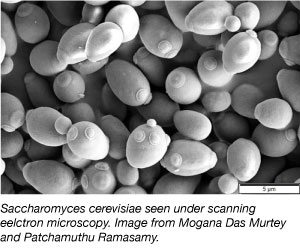 真核生物の中で最もシンプルである酵母は科学研究でよく用いられるモデル生物であり、この系は、真核生物の中で最も重要なものの一つです。 そう、私たちがパンやその他の焼き菓子に使っているのと同じ種類です! 酵母は、さまざまな環境条件下で生存でき、2時間ごとに2倍になるため、安価でシンプル、かつ研究しやすい生物です。 酵母はまた、完全に配列が決定された最初の真核生物のゲノムであり、遺伝子操作に非常に適しています。
真核生物の中で最もシンプルである酵母は科学研究でよく用いられるモデル生物であり、この系は、真核生物の中で最も重要なものの一つです。 そう、私たちがパンやその他の焼き菓子に使っているのと同じ種類です! 酵母は、さまざまな環境条件下で生存でき、2時間ごとに2倍になるため、安価でシンプル、かつ研究しやすい生物です。 酵母はまた、完全に配列が決定された最初の真核生物のゲノムであり、遺伝子操作に非常に適しています。
酵母細胞は、上記の理由だけでなく、実際に私たち自身の細胞と多くの生物学的特性やプロセスを共有しているので、素晴らしいモデル生物といえます。 ヒト細胞と同様に、酵母のDNAは染色体にパッケージされており、酵母遺伝子の約23%はヒトに対応する遺伝子を持っている(Liuら、2017) 。 したがって、酵母は、特定の遺伝子によって引き起こされるヒトの病気の分子基盤を研究するために使用することができます。 例えば、ヒトの癌で変異したいくつかの遺伝子には、酵母の細胞分裂に関与するホモログが存在します(Pray, 2008)。 酵母での科学的発見は、その後、ヒトと同様の生体内条件をよりよく再現する他のモデル生物でさらに研究することができる。
例えば、酵母はその単純さゆえに、パーキンソン病(PD)などの神経疾患の研究において重要な実験モデルになっている。 PDは、主にタンパク質のミスフォールディングによって、脳内に「リーウィー小体」と呼ばれるタンパク質凝集体が蓄積することが特徴である。 PDの酵母モデルは、毒性タンパク質であるαシヌクレイン(リーワイ小体に含まれる最も一般的なタンパク質)を過剰発現させるものなどであり、この疾患の基礎となる分子メカニズムを理解する上で貴重な存在となっている(Menezes et al.、2015)。 酵母は単細胞生物であるため、1回の実験で複数の治療化合物を容易にスクリーニングするためにも使用できる。
Zebrafish (Danio rerio)
 1960年代以降、ゼブラフィッシュは徐々に重要なモデル生物となった。 彼らはヒトと約70%の遺伝子を共有しており、疾患に関連するヒト遺伝子の85%はゼブラフィッシュにホモログがある(Howeら、2013)。 ゼブラフィッシュは小型で、大きな群れで飼育されるため維持が容易で、繁殖も容易で、一度に50~300個の卵を産みます。 また、ゼブラフィッシュの胚は外部で産み、受精するため、科学者は容易に胚を操作することができる。 1354>
1960年代以降、ゼブラフィッシュは徐々に重要なモデル生物となった。 彼らはヒトと約70%の遺伝子を共有しており、疾患に関連するヒト遺伝子の85%はゼブラフィッシュにホモログがある(Howeら、2013)。 ゼブラフィッシュは小型で、大きな群れで飼育されるため維持が容易で、繁殖も容易で、一度に50~300個の卵を産みます。 また、ゼブラフィッシュの胚は外部で産み、受精するため、科学者は容易に胚を操作することができる。 1354>
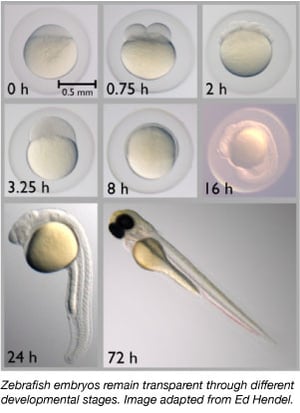
ゼブラフィッシュは、胚が完全に透明であるため、胚発生研究の理想的なモデル生物である。 そのため、他の脊椎動物では困難な初期の発生段階を容易に観察することができます。 例えば、Stainier研究室は、発達中のゼブラフィッシュの膵臓におけるβ細胞の増殖と分化を研究しました。 彼らはまずプラスミドを使ってこれらの細胞にタグを付けました。 次に、熱誘導を用いて異なる導入遺伝子の時間的発現を制御する方法であるHOTcreを用いて、Stainerグループは、膵臓の異なる領域に由来し、異なるレベルのインスリンを産生するβ細胞の2つの異なる集団が実際に存在することを明らかにした (Hesselson et al.)。 1354>
The worm (Caenorhabditis elegans)
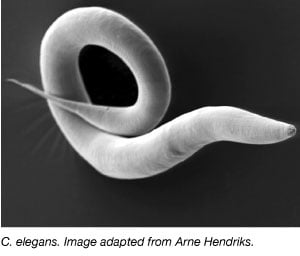 The worm, Caenorhabditis elegans は、1970年代に Sydney Brenner が神経細胞の発生を研究するために研究室に持ち込んで以来、モデル生物として広く使用されている (Brenner, 1973)。 線虫は小型で透明な虫で、ライフサイクルが早く、子ガメのサイズも大きい。 また、線虫の大部分は自家不和合性雌雄同体であるため、複数世代にわたる大規模な実験が容易に行える。 他のモデル生物と同様に、線虫のゲノムも完全に解読されており、ヒトの遺伝子の60%以上が線虫にオルソログを持っているため、分子生物学の基礎過程を研究するのに理想的な生物です。 蛍光マーカーを発現する動物のように、DNAを虫にマイクロインジェクションするだけでトランスジェニック動物を作ることができる(Melloら、1991)。 また、RNA干渉(RNAi)により、目的の遺伝子を含む特定のプラスミド(L4440)を発現するバクテリアをワームに与えることで、簡単に遺伝子をノックダウンすることができる(Fireら、1998年)。 線虫の RNAi の発見により、寄贈者の Andrew Fire 氏と Craig Mello 氏は 2006 年にノーベル賞を受賞しました。 そのため、蛍光タンパク質の発現や遺伝子の破壊など、あらゆる遺伝子改変を胚発生から成体まで生体内で容易に可視化することができる。 このように、細胞や組織を遺伝子操作によって可視化できるため、他のモデル生物では非常に困難な生体内研究を行うことができるのである。 ミミズは、神経系、発生、細胞シグナル伝達、老化、機械伝導など、さまざまな生物学的システムおよびプロセスの研究に利用されています。 例えば、Andrew Leiferの研究室では、遺伝的にコードされたカルシウムセンサーであるGCaMP6を発現するプラスミドを用いて、成体脳全体におけるカルシウムシグナルの研究にワームを利用した(Nguyen et al.、2015)。 線虫のプラスミドやリソースに興味があれば、AddgeneのWorm Expressionページをチェックしてください。
The worm, Caenorhabditis elegans は、1970年代に Sydney Brenner が神経細胞の発生を研究するために研究室に持ち込んで以来、モデル生物として広く使用されている (Brenner, 1973)。 線虫は小型で透明な虫で、ライフサイクルが早く、子ガメのサイズも大きい。 また、線虫の大部分は自家不和合性雌雄同体であるため、複数世代にわたる大規模な実験が容易に行える。 他のモデル生物と同様に、線虫のゲノムも完全に解読されており、ヒトの遺伝子の60%以上が線虫にオルソログを持っているため、分子生物学の基礎過程を研究するのに理想的な生物です。 蛍光マーカーを発現する動物のように、DNAを虫にマイクロインジェクションするだけでトランスジェニック動物を作ることができる(Melloら、1991)。 また、RNA干渉(RNAi)により、目的の遺伝子を含む特定のプラスミド(L4440)を発現するバクテリアをワームに与えることで、簡単に遺伝子をノックダウンすることができる(Fireら、1998年)。 線虫の RNAi の発見により、寄贈者の Andrew Fire 氏と Craig Mello 氏は 2006 年にノーベル賞を受賞しました。 そのため、蛍光タンパク質の発現や遺伝子の破壊など、あらゆる遺伝子改変を胚発生から成体まで生体内で容易に可視化することができる。 このように、細胞や組織を遺伝子操作によって可視化できるため、他のモデル生物では非常に困難な生体内研究を行うことができるのである。 ミミズは、神経系、発生、細胞シグナル伝達、老化、機械伝導など、さまざまな生物学的システムおよびプロセスの研究に利用されています。 例えば、Andrew Leiferの研究室では、遺伝的にコードされたカルシウムセンサーであるGCaMP6を発現するプラスミドを用いて、成体脳全体におけるカルシウムシグナルの研究にワームを利用した(Nguyen et al.、2015)。 線虫のプラスミドやリソースに興味があれば、AddgeneのWorm Expressionページをチェックしてください。
Looking for more model organisms? 人気のあるモデル生物シリーズのパート2をチェックし、新たなモデル生物のために開発されている新しいシステムについての記事を読んでください!
Brenner, Sydney. “The genetics of Caenorhabditis elegans(線虫の遺伝学)” Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. “Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling. “膵臓β細胞の静止期と増殖期の細胞集団を特定した。 米国科学アカデミー紀要 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. “The zebrafish reference genome sequence and its relationship to the human genome.”(ゼブラフィッシュの参照ゲノム配列とヒトゲノムとの関係)。 Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. “Drosophila-a versatile model in biology & medicine.”. Materials today 14.5 (2011): 190-195.
Mello, Craig C., et al. “Efficient gene transfer in C. elegans: Extrachromosomal maintenance and integration of transforming sequences.” (エレガンスにおける効率的な遺伝子導入) The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. また、このような研究成果を踏まえて、「環境と社会との調和」をテーマに、環境と社会との調和を目指した研究を進めている。 米国科学アカデミー紀要 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan, and Charles D. Nichols. “Drosophila melanogasterにおけるヒト疾患モデルと治療薬探索におけるハエの役割”. ファーマコロジカルレビュー 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.
.