Introduction
Cette néoplasie, qui prend naissance dans l’épithélium des canaux biliaires, ou cholangiocarcinome (CC), représente 10% des tumeurs hépatobiliaires et 2% des tumeurs malignes1,2. Le CC peut être divisé en 3 sous-types, selon leur origine anatomique dans le canal biliaire : le CC intrahépatique ou périphérique (ICC), le CC périhilaire ou tumeur de Klatskin (PHC) et le CC distal.
Le PHC, qui fait l’objet de cette révision, est le plus fréquent, et il représente environ 40%-60% de tous les CC.2,3 Cette tumeur est agressive et silencieuse, avec des symptômes non spécifiques jusqu’à des stades avancés, conduisant à un diagnostic tardif et une survie courte sans chirurgie de 6 à 12 mois.4 La chirurgie, qui est la seule option curative disponible, n’est possible que chez environ 47% des patients au moment du diagnostic.5-8 Les facteurs pronostiques les plus importants pour cette tumeur sont généralement associés aux options chirurgicales, et le stade de la tumeur, sa taille, l’implication ganglionnaire et vasculaire, les métastases intra-hépatiques et le type histologique sont les facteurs les plus importants9.-11
Espace anatomique
L’espace anatomique occupé par les CC serait délimité par l’entrée du canal cystique au niveau distal, et la bifurcation des canaux hépatiques droit et gauche au niveau proximal.1,12 Les classifications les plus utilisées incluent tous les CC qui prennent naissance dans le confluent biliaire ou ses environs. Certains groupes ont suggéré que les CC originaires du parenchyme hépatique peuvent parfois envahir le confluent biliaire, avec une origine dans l’espace anatomique délimité par la source de la branche arrière de la veine porte droite et le ligament falciforme.13-15 Ces CCI impliquant le confluent biliaire seraient traitées de la même manière que les tumeurs d’origine extrahépatique, et la survie est similaire à celle des CSP au même stade. Ce sont généralement des tumeurs très développées avec un envahissement vasculaire et ganglionnaire locorégional. Des doutes sur le comportement biologique de ces tumeurs ont conduit de nombreux groupes à les exclure des tumeurs périhilaires. Dans une étude publiée par Ebata et al.13,15 portant sur 250 patients réséqués pour une CC avec atteinte du confluent, le stade et la survie ont été analysés selon que la tumeur était intrahépatique avec atteinte du confluent (ICC), ou que l’origine de la tumeur était dans le canal biliaire extrahépatique (PHC). Au total, 83 patients présentaient un ICC et 167 un PHC. Lorsque l’on compare les stades, les patients atteints d’ICC présentent une fréquence plus élevée d’atteinte vasculaire et ganglionnaire, avec un TNM supérieur à celui du groupe PHC, présentant des stades iii et iv dans 59% des cas, contre 38% dans le groupe PHC. Néanmoins, si l’on divise la survie en fonction des stades dans les deux groupes, il n’y a pas de différences statistiquement significatives à 5 ans, avec une survie globale légèrement supérieure dans le groupe PHC (20 % contre 29 %, respectivement ; P=.057), de sorte que l’on a conclu qu’ils sont comparables en termes de traitement et de survie. Avec l’amélioration des tests diagnostiques et des connaissances histopathologiques, nous pourrons peut-être mieux définir à l’avenir s’il s’agit de 2 entités distinctes ou si elles sont cliniquement et biologiquement les mêmes.
Caractéristiques histopatologiques
90% des PHC sont des adénocarcinomes. 10% sont des carcinomes adénosquameux ou squameux, qui dans certains cas ont été associés à des antécédents de lithiase, de kystes ou d’anomalies des canaux biliaires. Selon l’aspect de la tumeur, le type de croissance et le comportement biologique et clinique des SSP, ils sont classés en16,17:
- –
CCC tumoral ou « formant une masse » : c’est la forme de présentation la plus fréquente dans les CCI, bien qu’elle puisse également être trouvée dans un grand nombre de SSP. Elle se caractérise par la formation d’une masse tumorale aux marges bien définies. Elle présente une réaction fibrotique importante et la nécrose centrale est également fréquente. Cette tumeur prend naissance dans l’ouverture du canal biliaire, envahit la paroi et se dissémine en se développant de manière tridimensionnelle, formant une masse nodulaire qui donne lieu à des symptômes obstructifs.16-19
- –
CCC periductal infiltrant : les tumeurs de ce type se développent le long d’un canal biliaire sous la forme d’un épaississement longitudinal concentrique à travers le tissu conjonctif autour du canal, provoquant une sténose ou une obstruction complète du canal biliaire affecté.19 La majorité des CPS sont de ce type et ils sont difficiles à identifier à l’aide de techniques d’imagerie.17
- –
CCC intraductal ou papillaire intraductal : cette variété est caractérisée par la présence de tumeurs superficielles et intraluminales dans le canal biliaire. Elles produisent de la mucine et provoquent l’obstruction partielle et la dilatation des canaux.16 Cette tumeur a un faible degré de malignité et est généralement de petite taille, bien qu’elle puisse s’étendre à travers le mucus biliaire, donnant lieu à des tumeurs multiples (papilomatose ou carcinomatose papillaire).20
L’importance de cette différenciation réside dans les variations de survie en fonction du sous-type en question. Plusieurs études ont montré que les patients présentant le type papillaire intraductal ont un meilleur pronostic que ceux présentant les variétés scléro-nodulaires,21 avec une survie moyenne de 55 et 33 mois, respectivement,22 alors que les atteintes vasculaires et ganglionnaires sont moins fréquentes dans le sous-type papillaire intraductal.
En résumé, la majorité des PHC sont des adénocarcinomes avec un schéma de croissance périductale qui leur confère un plus mauvais pronostic, tandis que la variante à croissance intraductale est la moins fréquente, bien qu’elle ait un meilleur pronostic.
Systèmes de stadification
Les systèmes de stadification des PHC peuvent être différenciés en classifications pré et postopératoires. Parmi les premières, qui sont utilisées lors de la planification de la chirurgie, le système le plus important est la classification de Bismuth-Corlette. Elle indique quel lobe est préférentiellement affecté, et elle indique donc le type d’hépatectomie qui doit être utilisé (Fig. 1).23 Cette classification a été inventée dans les années 1970 et ne prend en compte ni l’atteinte ganglionnaire ni les métastases, de sorte qu’elle a aujourd’hui une valeur pronostique moindre.
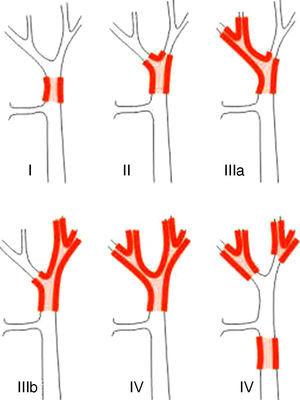
La classification de Bismuth-Corlette23.
Une autre classification préopératoire utilisée aux USA est celle publiée par Jarnagin et al.10 du Memorial Sloan Kettering Cancer Centre, New York. Cette classification vise à prédire la résécabilité des tumeurs en prenant en compte 3 facteurs d’extension locale. Il s’agit de l’extension biliaire, de l’atteinte vasculaire et de l’atrophie des lobes. Cette classification ne prend en compte ni l’atteinte ganglionnaire ni les métastases, ce qui lui confère une valeur pronostique moindre. La résécabilité étant différente d’un groupe à l’autre, alors que la tendance est aux traitements de plus en plus agressifs, sa valeur dépendra des critères de non-résécabilité de chaque centre. L’atteinte locale ne devrait désormais plus être un critère de non-résécabilité, à condition de pouvoir obtenir un R0 avec une résection chirurgicale.
Parmi les classifications postopératoires, la plus utilisée est la classification TNM de l’Union for International Cancer Control (UICC), septième édition12. Cette classification prend en compte les données pathologiques, telles que l’extension locale, l’atteinte vasculaire, l’atteinte des ganglions lymphatiques et les métastases, pour établir une classification qui inclut l’extension de la tumeur et qui est de nature pronostique.
Récemment, le « Japanese Study Group on Perihilar Cholangiocarcinoma » (JSGPH) a publié une étude qui propose de modifier la classification de l' »Union for International Cancer Control ». Les différences fondamentales sont indiquées dans le tableau 1, et elles consistent principalement à13:
-
Ne pas considérer le Bismuth IV comme T4. La classification du JSGPH ne prend donc pas en compte l’extension biliaire bilatérale comme un mauvais pronostic si une résection R0 est réalisée.
-
En ce qui concerne les stades, elle privilégie l’atteinte ganglionnaire comme le pire pronostic. Ils considèrent donc l’atteinte des ganglions lymphatiques comme un stade iva et non iiib (TNM7).
Comparaison des différences fondamentales entre la classification TNM 7 de l’UICC et la proposition du JSGPH.
| Classification des tumeurs | UICC | Proposition du JSGPH |
|---|---|---|
| Tis. | Carcinome in situ | |
| T1 | Tumeur confinée au canal biliaire | |
| T2a | Surpasse la paroi du canal et envahit le tissu adipeux périhilaire | |
| T2b | Envahit le parenchyme hépatique | |
| T3 | Invasion unilatérale de l’artère/veine hépatique | |
| T4 | Invasion de la branche principale de l’AH/PV, Bismuth IV, ou Bismuth III avec invasion controlatérale de l’A/V | Invasion vasculaire de la branche principale de l’HA/PV, avec invasion vasculaire bilatérale ou controlatérale |
| TNM stade | ||
| 0 | Tis N0 M0 | |
| I | T1 N0 M0 | |
| II | T2 N0 M0 | |
| IIIa | T3 N0 M0 | |
| IIIb | T1-3 N1 M0 | T4 N0 M0 |
| Iva | T4 N× M0 | T× N1 M0 |
| Tx | ||
| Ivb | T× N× M1 | |
HA, artère hépatique ; JSGPH, groupe d’étude japonais sur le cholangiocarcinome périhilaire ; TNM, métastase des ganglions tumoraux ; UICC, Union internationale de lutte contre le cancer ; PV, veine porte.
Au niveau européen, un registre international des tumeurs périhilaires traitées chirurgicalement a été créé, dirigé par le « International Cholangiocarcinoma Group for the Staging of PHC ». Ce groupe a publié une nouvelle classification1 qui prend en compte la taille de la tumeur, ainsi que l’atteinte biliaire, veineuse, artérielle, ganglionnaire et métastatique, tant en préopératoire qu’en postopératoire. Néanmoins, les limites de cette classification sont qu’elle se contente de décrire les caractéristiques de la tumeur et l’intervention chirurgicale à réaliser, sans aller jusqu’à diviser les patients en groupes ou stades en fonction de ces variables. Par conséquent, il n’est pas possible d’extraire des conclusions pronostiques et il est également impossible de comparer les résultats des différents groupes.
Les publications antérieures montrent que la classification préopératoire la plus utilisée actuellement pour décider du type de résection est celle de Bismuth-Corlette, tandis que la classification TNM 7 est utilisée pour définir le pronostic à long terme.
Stratégies diagnostiques
Les symptômes associés le plus fréquemment aux SSP sont : l’ictère (90%), la perte de poids et les douleurs abdominales (35%), le prurit (26%) et la cholangite aiguë (10%).17 En raison de ces symptômes, le diagnostic initial est généralement posé à l’aide d’une échographie abdominale, ce qui constitue un bon test de dépistage. D’autres examens diagnostiques pour ce type de tumeur seraient :
- –
Échographie Doppler abdominale : elle permet d’évaluer la perméabilité artérielle et portale (thrombose), ce qui peut conditionner la résécabilité de la tumeur et la stratégie thérapeutique, bien qu’elle ne soit pas l’examen de choix pour l’évaluation de l’atteinte vasculaire.
- –
Tomographie axiale informatisée abdominale : elle est utile pour le diagnostic de la tumeur primaire et de l’extension de la maladie, avec une sensibilité de 80% dans l’évaluation de l’extension biliaire. C’est la technique de choix pour l’évaluation préopératoire de l’anatomie vasculaire, avec une sensibilité de 93% et 87% pour l’évaluation de l’atteinte artérielle et portale, respectivement. Sa sensibilité est faible pour l’évaluation préopératoire de l’atteinte ganglionnaire (50 %).14,24 Elle est également utile pour réaliser des tests volumétriques et calculer le volume hépatique restant après résection chirurgicale. C’est aussi le test le plus économique pour la stadification préopératoire.
- –
Cholangiographie par résonance magnétique et résonance magnétique (RM-cholangiographie) : le meilleur test pour le diagnostic de la tumeur primaire et pour évaluer l’extension biliaire. Elle a une sensibilité de 86 % à 100 %, et elle est meilleure que la cholangiographie directe, tout en étant un test non invasif25. En revanche, elle a une faible sensibilité pour l’évaluation de l’atteinte vasculaire (73%) et une sensibilité de 80% pour l’invasion du parenchyme hépatique.
- –
Cholangiographie directe : cholangiopancréatographie rétrograde endoscopique (CPRE) et cholangiographie hépatique transpariétale (CHPT) : elles nous renseignent sur le niveau d’obstruction biliaire et permettent de réaliser des prélèvements de la lésion pour la cytologie, avec une sensibilité de 20%. Elles sont aujourd’hui remplacées dans le diagnostic par la cholangiographie par résonance magnétique. Elles sont très utiles pour le drainage biliaire préopératoire et dans le traitement palliatif des PHC, avec la mise en place de stents préférentiellement métallisés26.-28
- –
Échographie endoscopique : elle est utile pour évaluer l’atteinte ganglionnaire dans la zone du tronc cœliaque et de la région péripancréatique, établir une stadification préopératoire et permettre la réalisation de biopsies par aspiration à l’aiguille fine.
- –
Tomographie par émission de positons : elle est utile dans l’étude des patients ayant une suspicion d’atteinte métastatique ainsi que d’atteinte des adénopathies dans le tronc cœliaque. Sa sensibilité est controversée, et elle peut varier de 38% à 90%, selon les séries publiées.14,24,29
- –
Marqueurs tumoraux : ils ont une utilité limitée, et le CA 19,9 est le plus utilisé. La majorité des études les ont évalués dans les néoplasies pancréatiques et dans le CC dans une moindre mesure, sans préciser leur localisation ou leurs caractéristiques. Les niveaux dans le sérum de ces marqueurs sont fortement influencés par l’obstruction biliaire et l’ictère en raison de leur élimination biliaire. Différentes valeurs normales ont été proposées, en fonction de la présence d’une hépatopathie (300U/ml) ou d’un ictère (1000U/ml), alors que dans le cancer du pancréas on obtient des sensibilités supérieures à 70%, avec des niveaux de spécificité supérieurs à 95%. Sa concentration chez ces patients est très variable et n’est pas corrélée à la taille de la tumeur, bien qu’elle soit corrélée à la présence de métastases. La sensibilité et la spécificité de ce marqueur peuvent être augmentées en le combinant avec l’ACE, surtout dans les cas négatifs de Lewis A (non producteurs de CA 19.9).30
On peut déduire des données ci-dessus que nous commençons généralement l’étude par une échographie pour le diagnostic de l’HCP. Ceci a lieu dans le contexte d’un patient présentant une jaunisse, tandis que la tomographie informatisée et la cholangiographie par RM sont les meilleurs tests de stadification et les plus recommandables avant la chirurgie. La RM ou la tomographie informatisée peuvent être utilisées pour les tests volumétriques, en fonction du type d’appareil ou des programmes informatiques disponibles dans chaque hôpital. En cas de doute sur la propagation dans les ganglions lymphatiques, qui pourrait contre-indiquer la chirurgie, la tomographie par émission de positons ou l’endoscopie par aspiration à l’aiguille fine sont recommandées.
Critères de non-résection
La chirurgie est le seul traitement curatif des SSP, et elle offre la meilleure survie à long terme. Les critères adoptés pour la résection chirurgicale se sont étendus ces dernières années, depuis ceux décrits initialement par l’équipe du Memorial Sloan Kettering Cancer Center de Burke et al.31 en 1998, jusqu’à l’introduction récente d’approches utilisant la résection vasculaire et les hépatectomies étendues.3,5,32-34 Les critères de non-résécabilité varient d’un hôpital à l’autre, et les plus répandus sont : une atteinte vasculaire d’un côté avec une atteinte biliaire controlatérale jusqu’à la division des radicaux de deuxième niveau, des métastases hépatiques à distance, une atteinte vasculaire des deux lobes hépatiques, une atteinte extra-hépatique ou péritonéale et une atteinte adénopathique du tronc cœliaque, de l’artère mésentérique supérieure ou de la région para-aortique.3,5,8,31
Dans une étude multicentrique publiée par De Jong et al.34 qui a analysé 305 patients opérés pour un PHC dans 7 centres différents aux USA et en Europe, et qui incluait des patients avec une atteinte portale, en analyse multivariable les 2 seuls facteurs pronostiques statistiquement significatifs étaient l’atteinte de la marge de résection et l’atteinte ganglionnaire (P=.02). Dans l’étude publiée par Ebata et al15, analysant 1352 patients opérés dans 8 hôpitaux japonais pour des SSP avec intention curative, l’analyse multivariable des facteurs pronostiques statistiquement significatifs a montré que ceux-ci étaient : l’invasion vasculaire, l’invasion du pancréas, l’atteinte des ganglions lymphatiques, la présence de métastases et l’atteinte de la marge de résection. L’atteinte ganglionnaire et les métastases étaient les facteurs qui entraînaient une moins bonne survie à 5 ans par rapport aux autres (10%, 20% et 63%, respectivement). Ces résultats soutiennent le recours à la chirurgie pour ces tumeurs, si malgré l’extension locale il est possible de réaliser une résection R0, étant donné qu’il est possible d’augmenter la survie à 5 ans indépendamment de l’extension locale.
En raison de toutes les considérations ci-dessus, il est recommandé d’évaluer chaque cas individuellement et de recourir à la chirurgie si une résection R0 peut être réalisée en l’absence de métastases à distance ou d’atteinte péritonéale. L’atteinte biliaire bilatérale et l’atteinte vasculaire locale ne devraient donc pas être des critères de non-résécabilité s’il est possible d’opérer tout en préservant plus de 30% du volume hépatique et en réalisant une résection oncologique.
Stratégies thérapeutiquesDrainage biliaire
Étant donné que la majorité des patients atteints de SSP débutent avec un ictère, l’un des dilemmes les plus importants concerne l’utilité du drainage biliaire préopératoire. Cependant, celui-ci n’est pas exempt de complications, et celles associées à la CPRE avec insertion d’un stent sont : la pancréatite, la perforation duodénale, la migration duodénale, l’obstruction du cathéter et, surtout, la cholangite. Le drainage par CTPH présente une fréquence plus faible de cholangite préopératoire, mais il est associé à des hémorragies, à la migration du cathéter, à une dissémination tumorale jusqu’à 5% dans la trajectoire du cathéter et à un inconfort et une douleur dans la zone d’entrée. Globalement, selon les études publiées, la CPRE est associée à une morbidité de 60%, et le chiffre correspondant pour la CTPH est de 31%.14,35
Pour ces raisons, l’utilité du drainage biliaire préopératoire en chirurgie hépatobiliopancréatique a été remise en question.36,37 Ces études, qui incluent tous les types de chirurgie hépatobiliaire, ont montré que le drainage biliaire préopératoire chez les patients atteints d’ictère augmente la morbidité associée sans améliorer la survie, augmentant principalement les complications impliquant des infections. L’étude multicentrique européenne publiée en 2013 par Farges et al.38 a analysé rétrospectivement 366 patients qui avaient subi une hépatectomie ou une hépatectomie étendue et une résection biliaire en raison d’un SSP. Ils ont été classés en fonction de la réalisation ou non d’un drainage biliaire préopératoire. Le groupe sans drainage préopératoire (non-PBD) était composé de 186 patients, et le groupe avec drainage biliaire (PBD) contenait 180 patients. Les groupes étaient homogènes en termes d’âge, de stade tumoral et de résection portale. Le groupe PBD présentait plus d’hépatectomies droites (56% vs 44%). Lorsque les deux groupes ont été comparés selon le type de chirurgie pratiquée, les patients soumis à une hépatectomie droite ont présenté un nombre plus élevé d’insuffisance hépatique postopératoire s’ils appartenaient au groupe non-PBD, avec une incidence de 16% contre 4% dans le groupe PBD (P=.009). Dans l’analyse multivariable des facteurs associés à une mortalité plus élevée dans le groupe d’hépatectomie droite, le fait d’avoir un taux de bilirubine inférieur à 3mg/dL avant l’opération était un facteur statistiquement significatif. Cependant, si l’on compare les deux groupes de patients ayant subi une hépatectomie gauche, le groupe PBD a présenté un nombre plus élevé de septicémies postopératoires, avec une incidence de 6%, contre 0% dans le groupe non-PBD (P=.014). Cette étude montre que même s’il est vrai que le drainage biliaire augmente l’incidence de la septicémie postopératoire, le drainage biliaire devrait être effectué chez les patients qui vont subir une hépatectomie droite afin de réduire la morbimortalité associée à l’insuffisance hépatique postopératoire, et d’autres études soutiennent cette théorie.39 Étant donné que dans le traitement des SSP, les seules études qui ont montré une plus grande survie sont celles qui soutiennent les résections extensives pour obtenir une résection R0, le drainage biliaire est recommandé lorsque la chirurgie est indiquée, et il peut éventuellement nécessiter une hépatectomie extensive de plus de 50% du volume hépatique ou une trisegmentectomie, ou en cas de cholangite. Il y a une controverse quant au seuil de bilirubine pour indiquer le drainage, et >10mg/dL est l’un des plus largement utilisés.5,37 Il est recommandé de réaliser un drainage biliaire par CTPH, avec mise en place d’un drainage externe, ce qui évite la manipulation de la tumeur. Cette méthode présente une incidence d’infections plus faible que la CPRE et permet, chez les patients ayant bénéficié d’un drainage unilatéral et qui ne parviennent pas à normaliser leur taux de bilirubine, d’utiliser un drainage biliaire bilatéral.35,40
Une dissémination tumorale au niveau du point de ponction a été décrite dans jusqu’à 5 %-10 % des cas où la CTPH a été utilisée,14,24 bien que ces études ne précisent pas quand un drainage externe ou interne-externe a été utilisé et qu’elles ne tiennent pas compte du temps écoulé jusqu’à la chirurgie. Certains auteurs recommandent l’utilisation d’un drainage nasobiliaire positionné par endoscopie pour éviter la dissémination au point de ponction, avec une incidence plus faible de cholangite et d’obstruction du stent que dans le cas de la CPRE41. Cependant, les mêmes études admettent la difficulté du drainage biliaire bilatéral préopératoire à l’aide de ce système, ce qui entrave la normalisation des taux de bilirubine avant la chirurgie chez les patients chez qui le drainage unilatéral a échoué.42
Pour réduire la morbidité associée aux infections après un drainage biliaire préopératoire, il est suggéré que la bile soit systématiquement mise en culture après le drainage et pendant la chirurgie. Plusieurs études ont montré que 78%-94% de ces cultures sont positives pour les patients drainés, contre 20%-30% pour les patients non drainés,43-45 et que l’entérocoque est l’organisme le plus fréquemment isolé. Ces groupes défendent l’utilisation d’antibiotiques prophylactiques qui, bien qu’ils augmentent la résistance aux antibiotiques des espèces isolées, permettent, selon les études publiées, d’obtenir une morbidité infectieuse postopératoire similaire à celle des groupes non drainés. L’antibiotique choisi dépendra des cultures et de l’antibiogramme, bien que la majorité des groupes aient utilisé au moins une céphalosporine de troisième génération ou des fluoroquinolones+métronidazole, lorsqu’aucune culture n’était disponible ou lorsqu’elle était négative.43,44,46
Le drainage biliaire palliatif est utilisé chez les patients qui ne peuvent pas subir de résection. Le drainage peut se faire par CPRE, en laissant un stent métallique revêtu, ou par CTPH dans les cas où il est impossible d’obtenir un drainage correct des deux canaux biliaires en utilisant la CPRE.
Donc définitivement, le drainage biliaire préopératoire doit être utilisé chez tous les patients ayant une bilirubine supérieure ou égale à 10mg/dL et chez ceux où les résections hépatiques seront supérieures à 50% du volume hépatique. Le type d’approche dépend de l’hôpital, bien que la CTPH avec drainage externe soit recommandable pour éviter la manipulation de la tumeur et la plus faible incidence de cholangite. Certains auteurs recommandent que les patients drainés reçoivent des antibiotiques prophylactiques adaptés à leurs cultures biliaires.
Embolisation portale préopératoire
L’embolisation portale préopératoire a été décrite dans les années 1980, initialement par Makuuchi et al.47 puis par Kinoshita et al.48 Le but de l’embolisation portale est d’augmenter le volume hépatique restant dans les cas où il est considéré comme insuffisant dans la volumétrie préopératoire, réduisant ainsi la probabilité d’insuffisance hépatique postopératoire. Dans une méta-analyse publiée récemment par Higuchi et Yamamoto49 qui a inclus 836 patients atteints de SSP avec embolisation portale préopératoire, la morbidité était de 1% et la mortalité de 0,09%. La progression tumorale au cours de l’intervention qui a empêché la chirurgie s’est élevée à 19,4 %. Ces résultats soutiennent l’idée que son utilisation dans les SSP est justifiée chez les patients dont le volume hépatique préopératoire restant est inférieur à 30%.
Laparoscopie de stadification
Avec les progrès de la sensibilité et de la spécificité des tests d’imagerie non invasifs au cours des dernières années, la laparoscopie de stadification tombe en désuétude. Les critères les plus importants de non-résécabilité sont l’atteinte ganglionnaire, l’extension biliaire et l’invasion vasculaire. Ces critères sont difficiles à évaluer lors de la laparoscopie, dont la précision et l’efficacité sont en baisse depuis des années. En témoigne la récente révision de Rotellar et Pardo50, dont la précision et l’efficacité étaient respectivement de 41% et 72% en 2002, et de 14% et 32% dans les études publiées en 2011. Cette baisse est principalement due à l’amélioration des tests non invasifs comme la cholangiographie par résonance magnétique. Son efficacité augmente si l’on sélectionne des patients qui présentent un risque élevé de présenter une dissémination péritonéale ou des métastases hépatiques, ce qui permet d’éviter des laparotomies inutiles.50-52 Les techniques d’imagerie non invasives sont recommandées dans les stades avancés (T2/3/4) qui présentent une possible atteinte péritonéale ou ganglionnaire avancée, et qui ne peuvent pas être ponctionnés par écho-endoscopie avant de créer le drainage biliaire préopératoire. Nous effectuons toujours une laparoscopie de stadification en utilisant l’échographie peropératoire pour améliorer la sensibilité à l’implication locorégionale et ganglionnaire.53
Traitement chirurgical
La chirurgie est toujours le seul traitement curatif pour les SSP,3,14 et elle atteint un taux de survie de 20 % à 40 % à 5 ans (tableau 2).10,11 La résection chirurgicale doit toujours être effectuée s’il est possible d’obtenir une résection R0. Les principaux facteurs qui affectent la survie après la chirurgie sont l’atteinte des marges de résection, soit au niveau microscopique (R1), soit au niveau macroscopique (R2), ainsi que l’atteinte des ganglions lymphatiques (N1 et N2).14,17,44,54 Plusieurs études ont montré que la survie augmente si la résection est élargie pour créer des marges négatives.3,5,33,45 Les techniques proposées comprennent des hépatectomies élargies avec résection du segment caudé, une résection biliaire, une lymphadectomie hilaire jusqu’au tronc cœliaque et une reconstruction avec hépato-jéjunostomie.
Survie après résection du PHC selon les séries publiées.
| Auteur | Année | Cas | Survie à 5 ans (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20,2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Survie après résection hépatique due à un cholangiocarcinome périhilaire.
Suivi de deux ans seulement.
La « technique sans contact » décrite pour la première fois par Neuhaus et al.32 implique la résection en bloc du hile hépatique sans manipulation de la tumeur, augmentant la survie des patients à 5 ans dans plus de 15% des cas.3,33,34,55 Cette technique consiste essentiellement en la résection de la veine porte et de l’artère hépatique droite lorsqu’elles sont proches de la tumeur, empêchant ainsi sa dissection si celle-ci implique une manipulation de la tumeur, ainsi qu’une résection biliaire complète avec une large lymphadénectomie jusqu’à la racine du tronc cœliaque et une reconstruction avec hépaticojéjunostomie. Il sera préférable de sélectionner le lobe hépatique droit (l’indispensable « technique sans toucher », selon Neuhaus)33, à condition que l’extension tumorale permette d’inclure l’artère hépatique droite, qui est la plus proche de la tumeur. Ce type de chirurgie radicale entraîne un taux de morbidité postopératoire acceptable, de 50%-70% selon les séries, avec une mortalité de 10%-20%.3,5 La survie des patients atteints de SSP à 5 ans est de 20 à 40%, alors que les études publiées qui incluent une résection portale et les séries utilisant la « technique sans contact » atteignent 58% à 5 ans (Figs. 2 et 3).3,5,33
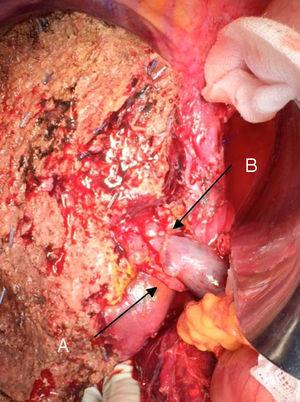
Hépatectomie gauche pour tumeur de Klatskin, avec résection de la veine porte : (A) artère hépatique droite du mésentère supérieur ; (B) veine porte.
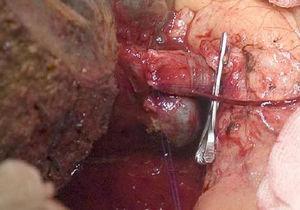
Hépatectomie droite avec reconstruction de la veine porte.
Il est également important de souligner les études récentes qui montrent une augmentation de la survie des patients ayant une atteinte vasculaire préopératoire après résection portale. Ils atteignent même des taux de survie égaux ou supérieurs à ceux des patients sans atteinte vasculaire préopératoire et qui n’ont donc pas été soumis à une résection portale.33,56,57 Dans ces études, l’incidence des complications hépatiques et vasculaires est similaire à celle du groupe sans résection portale, sauf pour les patients soumis à une résection artérielle, car ceux-ci présentent un taux de morbimortalité plus élevé que les autres. En raison de toutes ces considérations, la chirurgie est recommandée pour les patients présentant une atteinte portale unilatérale ou une atteinte du confluent lors des tests préopératoires, en effectuant une résection en bloc et une reconstruction vasculaire. La résection et la reconstruction artérielle ne sont pas recommandées, sauf si l’artère est clairement affectée, car cela est associé à de moins bons résultats postopératoires, de sorte que dans ces cas, l’hépatectomie droite est préférable.
En résumé, les principes chirurgicaux à suivre seront : une chirurgie radicale avec résection biliaire et caudale et lymphadénectomie, avec des marges R0 et sans manipulation de la tumeur, même si cela implique la résection et la reconstruction de la veine porte et de l’artère hépatique.
Conclusions
À l’heure actuelle, le seul traitement curatif consiste en une résection chirurgicale. La résection radicale en bloc et la reconstruction vasculaire est la technique qui a obtenu le plus haut taux de survie à long terme. Pour réduire la morbimortalité postopératoire, il est recommandé d’effectuer un drainage biliaire pour prévenir l’insuffisance hépatique, avec une prophylaxie antibiotique après le drainage et une embolisation portale lorsque le futur volume hépatique restant sera inférieur à 30%. La résection R0, l’atteinte des ganglions lymphatiques et les métastases à distance restent les facteurs pronostiques les plus importants.
Conflit d’intérêts
Cette révision n’a pas été présentée ou publiée partiellement ou totalement dans une revue ou un congrès.