Les Flaviviradae constituent une grande famille d’agents pathogènes viraux responsables de maladies graves et de mortalité chez l’homme et les animaux. La famille se compose de trois genres : Flavivirus, Pestivirus et Hepacivirus. Le genre Flavivirus, qui est le plus grand des trois, contient plus de 70 virus dont le virus de la dengue (DV), le virus de l’encéphalite japonaise (JEV), le virus du Nil occidental (WNV), le virus de la fièvre jaune (YFV) et le virus Zika (ZIKV). Les flavivirus présentent une uniformité morphologique avec une capside icosaédrique et une enveloppe fermée en forme de pointe. La taille de la capside est d’environ 30 nm et le virion entier mesure 45 nm. Le génome des flavivirus est un ARN sens unique d’environ 10 kb. Il code pour 3 protéines structurelles : la capside (protéine C), la membrane (M, qui est exprimée en tant que prM, le précurseur de M et l’enveloppe (protéine E) et 7 protéines non structurelles : NS1, NS2A, NS2B, NS3, NS4A, NS4B et NS5 (Figure 1 a.b).
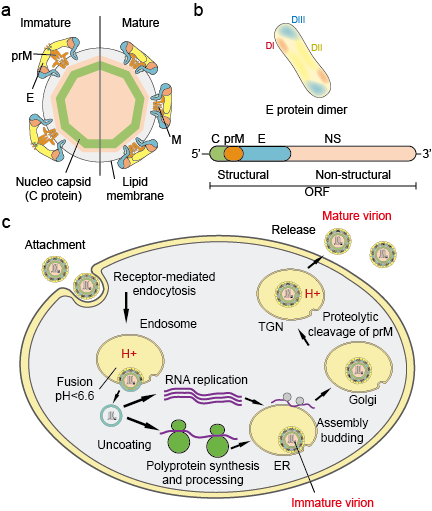
Figure 1. Particules de flavivirus (a), protéines (b) et cycle de vie (c).
Recherche de tous les produits liés aux flavivirus
Cycle de vie des flavivirus:
Les virions se fixent à la surface d’une cellule hôte et pénètrent ensuite dans la cellule par endocytose médiée par les récepteurs (figure 1c). Plusieurs récepteurs primaires et corécepteurs de faible affinité pour les flavivirus ont été identifiés. L’acidification de la vésicule endosomale déclenche des changements de conformation du virion, la fusion des membranes virale et cellulaire et le désassemblage de la particule. Une fois le génome libéré dans le cytoplasme, l’ARN positif est traduit en une seule polyprotéine qui est traitée de manière co- et post-traductionnelle par des protéases virales et de l’hôte. La réplication du génome a lieu sur les membranes intracellulaires. L’assemblage du virus se produit à la surface du réticulum endoplasmique (RE) lorsque les protéines structurelles et l’ARN nouvellement synthétisé bourgeonnent dans la lumière du RE. Les particules virales et subvirales immatures non infectieuses qui en résultent sont transportées par le réseau transgolgien (TGN). Les particules virales immatures sont clivées par la furine, la protéase de l’hôte, ce qui donne des particules matures et infectieuses. Les particules subvirales sont également clivées par la furine. Les virions matures et les particules subvirales sont ensuite libérés par exocytose.
Épidémiologie des flavivirus :
Les flavivirus transmis par les moustiques sont transmis dans la nature selon un ou plusieurs cycles distincts ou qui se chevauchent et qui incluent un moustique vecteur, généralement des moustiques Aedes pour le VYF et le DENV et des moustiques Culex pour le VJE et le VNO, et un hôte mammifère ou aviaire. La transmission entre les moustiques et les hôtes vertébrés est appelée transmission horizontale et provoque des maladies chez les vertébrés. Contrairement à la transmission horizontale, les flavivirus transmis par les moustiques peuvent être maintenus dans l’environnement par des transmissions verticales, c’est-à-dire transgénérationnelles, qui permettent la propagation des flavivirus uniquement chez les moustiques. La preuve la plus directe de la transmission verticale des flavivirus transmis par les moustiques provient de l’isolement du virus à partir de larves infectées, vraisemblablement par transmission transovarienne. Cette observation est cohérente avec la détection d’antigènes viraux dans les tissus ovariens de moustiques infectés. (Figure 2)
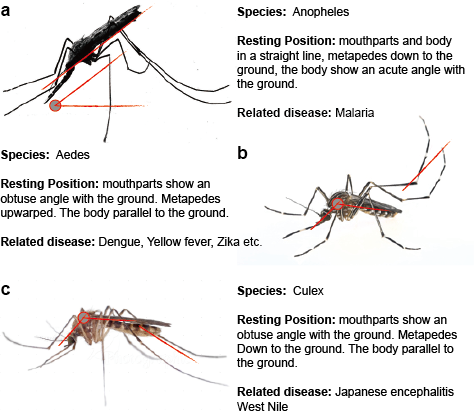
Figure 2. Trois moustiques typiques qui transmettent des maladies.
Les flavivirus ont une distribution mondiale, et certains membres du genre constituent un problème de santé publique majeur (par exemple, le virus de la fièvre jaune , le virus de la dengue , le virus du Nil occidental et le virus de l’encéphalite japonaise ), avec une morbidité et/ou une mortalité élevées. Au cours de la dernière décennie, les flavivirus ont démontré une prévalence accrue, représentant un risque pour plus de 3 milliards de personnes dans le monde, ce qui en fait un paradigme des maladies émergentes.
Au cours des 50 dernières années, de nombreux flavivirus, tels que les virus de la dengue, du Nil occidental et de la fièvre jaune, ont présenté une augmentation spectaculaire de leur incidence, de la gravité de la maladie et/ou de leur aire de répartition géographique. Les agents pathogènes viraux d’origine environnementale présentent des caractéristiques épidémiologiques relativement uniformes. Les moustiques, les tiques et les mouches piqueuses sont les vecteurs de la plupart des maladies virales humaines. Les maladies humaines surviennent lorsque les vecteurs sont actifs, généralement au printemps, en été et en automne dans les climats tempérés, et présentent souvent des caractéristiques épidémiologiques distinctes qui correspondent à l’habitat du vecteur (figure 3).
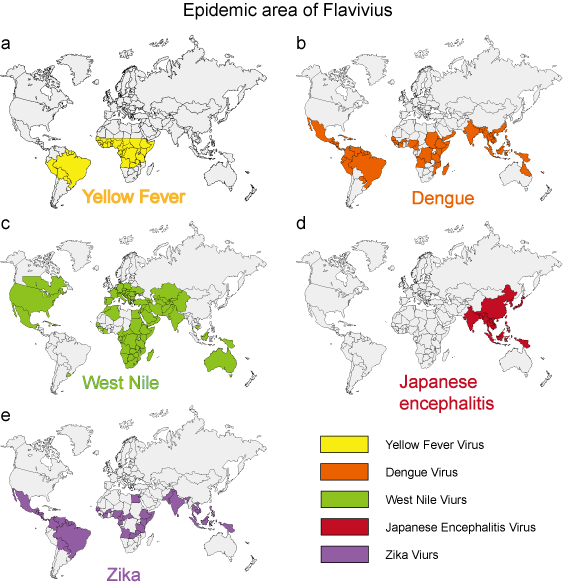
Figure 3. La zone épidémique de 5 flavivirus typiques.
Manifestations:
Les flavivirus varient considérablement dans leur potentiel pathogène et leurs mécanismes de production de maladies humaines (tableau 1). L’infection humaine par les flavivirus transmis par les moustiques et les tiques est initiée par le dépôt du virus à travers la peau via la salive d’un arthropode infecté. Le virus se réplique localement et dans les ganglions lymphatiques régionaux et entraîne une virémie. Les principaux syndromes et exemples de flavivirus responsables sont les suivants : encéphalite (encéphalite japonaise), maladie fébrile avec éruption cutanée (virus de la dengue), fièvre hémorragique (virus de la maladie de la forêt de Kyasanur et parfois virus de la dengue) et fièvre hémorragique avec hépatite (virus de la fièvre jaune).
Tableau 1 Aperçu des plus importants Flavivirus
| Espèce virale | Vecteur de transmission | Propagation géographique | Syndrome. |
|---|---|---|---|
| Fièvre jaune | Moustique (Aedes) | Voir figure 3a | Fièvre hémorragique |
| Dengue | Moustique (Aedes, Stegomyia) |
Voir figure 3b | Syndrome de la dengue, DHF, DSS |
| Fièvre du Nil occidental | Moustique (Culex), moustiques (Argasidae) |
Voir Figure 3c | Syndrome de la Dengue, encéphalite |
| Encéphalite japonaise | Moustique (Culex) | Voir Figure 3d | Encéphalite |
| Zika | Moustique (Aedes) | Voir figure 3e | Microcéphalie |
Diagnostics :
Le diagnostic clinique des différents flavivirus n’est pas fiable en raison de la non-spécificité des symptômes, et le diagnostic de laboratoire est obligatoire pour confirmer l’étiologie de la maladie. Dans les infections à flavivirus, le virus peut être retrouvé dans le sérum ou le plasma, généralement 2 à 7 jours après le début de la maladie, et la durée de cette phase virémique et la charge virale détectée varient en fonction du virus infectant (tableau 2). En général, 5 à 7 jours après l’apparition de la maladie, une réponse immunitaire contre l’infection se met en place, avec un pic d’anticorps IgM après 15 jours. Ces anticorps IgM peuvent durer des mois (comme dans le cas du DENV) à des années (comme dans le cas des infections par le WNV). L’apparition des IgG se produit après 8-10 jours à partir du début de l’infection et peut être détectée tout au long de la vie. Les caractéristiques particulières de chaque flavivirus influencent fortement les algorithmes de diagnostic à appliquer pour l’identification des infections flavivirales. En général, de nombreux laboratoires ont choisi les tests sérologiques pour diagnostiquer les infections causées par les flavivirus, en raison de leur précision et de la disponibilité de tests commerciaux basés sur des normes de qualité élevées. Cependant, la présence de réactions sérologiques croisées entre les différents virus, et le temps nécessaire à la détection des anticorps dans certaines infections, entravent l’utilité de la sérologie comme outil de diagnostic des infections aiguës à flavivirus. L’isolement viral constitue la méthode « de référence » pour obtenir un diagnostic confirmé de flavivirus.
Parcourir tous les produits de kit ELSIA pour flavivirus et de TDR pour flavivirus
Tableau 2. Algorithmes de diagnostic du flavivirus.
| Phase aiguë | Phase convalescente | Echantillon préféré† | Charge virale attendue | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, isolement du virus | IgM, IgG | Sérum, plasma et tissu | Haut |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, isolement du virus | IgM, IgG | Sérum, plasma, LCR et PBMCs | Jusqu’à 106 virions/ml |
| VNO | RT-PCR, IgM, IgG | IgM, IgG | CSF et sérum | Low |
| JeV | RT-PCR, IgM, IgG | IgM, IgG | CSF, sérum, sang et PBMCs | Low |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF et sérum | faible |
| Gould E A, Solomon T. Pathogenic flaviviruses . The Lancet, 2008, 371(9611) : 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. Les relations phylogénétiques des flavivirus sont en corrélation avec leur épidémiologie, leur association aux maladies et leur biogéographie . Journal of General Virology, 2001, 82(8) : 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Phylogénie du genre Flavivirus . Journal of virology, 1998, 72(1) : 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle. Nature Reviews Microbiology, 2005, 3(1) : 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Interactions flavivirus-moustique. Virus, 2014, 6(11) : 4703-4730. |
.