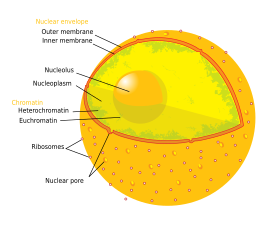
Le noyau contient presque tout l’ADN de la cellule, entouré d’un réseau de filaments intermédiaires fibreux et enveloppé d’une double membrane appelée « enveloppe nucléaire ». L’enveloppe nucléaire sépare le fluide à l’intérieur du noyau, appelé nucléoplasme, du reste de la cellule. La taille du noyau dépend de la taille de la cellule dans laquelle il est contenu, un noyau occupant généralement environ 8 % du volume total de la cellule. Le noyau est le plus grand organite des cellules animales.:12 Dans les cellules de mammifères, le diamètre moyen du noyau est d’environ 6 micromètres (µm).
Enveloppe et pores nucléaires

L’enveloppe nucléaire est constituée de deux membranes, une membrane nucléaire interne et une membrane nucléaire externe.:649 Ensemble, ces membranes servent à séparer le matériel génétique de la cellule du reste du contenu cellulaire, et permettent au noyau de maintenir un environnement distinct du reste de la cellule. Malgré leur étroite apposition autour d’une grande partie du noyau, les deux membranes diffèrent considérablement par leur forme et leur contenu. La membrane interne entoure le contenu du noyau, ce qui lui confère sa forme définitive. :14 Au sein de la membrane interne, diverses protéines lient les filaments intermédiaires qui donnent au noyau sa structure. :649 La membrane externe entoure la membrane interne et est en continuité avec la membrane du réticulum endoplasmique adjacent.:649 En tant que partie de la membrane du réticulum endoplasmique, la membrane nucléaire externe est constellée de ribosomes qui traduisent activement les protéines à travers la membrane.:649 L’espace entre les deux membranes, appelé « espace périnucléaire », est continu avec la lumière du réticulum endoplasmique.:649
Les pores nucléaires, qui fournissent des canaux aqueux à travers l’enveloppe, sont composés de plusieurs protéines, collectivement appelées nucléoporines. Les pores ont un poids moléculaire d’environ 60 à 80 millions de daltons et sont constitués d’environ 50 (chez la levure) à plusieurs centaines de protéines (chez les vertébrés).:622-4 Les pores ont un diamètre total de 100 nm ; cependant, l’espace à travers lequel les molécules diffusent librement n’a qu’une largeur d’environ 9 nm, en raison de la présence de systèmes de régulation au centre du pore. Cette taille permet sélectivement le passage de petites molécules hydrosolubles tout en empêchant les molécules plus grandes, telles que les acides nucléiques et les grosses protéines, d’entrer ou de sortir du noyau de manière inappropriée. Ces grosses molécules doivent plutôt être transportées activement dans le noyau. Le noyau d’une cellule de mammifère typique présente environ 3 000 à 4 000 pores dans son enveloppe, chacun d’entre eux contenant une structure en forme d’anneau à symétrie octuple à l’endroit où les membranes interne et externe fusionnent. Une structure appelée panier nucléaire, qui s’étend dans le nucléoplasme, et une série d’extensions filamenteuses qui s’étendent dans le cytoplasme sont attachées à l’anneau. Ces deux structures servent à faciliter la liaison avec les protéines de transport nucléaire.:509-10
La plupart des protéines, des sous-unités ribosomiques et certains ARN sont transportés à travers les complexes de pores dans un processus médié par une famille de facteurs de transport connus sous le nom de caryophérines. Les caryophérines qui interviennent dans le déplacement vers le noyau sont également appelées importines, tandis que celles qui interviennent dans le déplacement hors du noyau sont appelées exportines. La plupart des caryophérines interagissent directement avec leur chargement, bien que certaines utilisent des protéines adaptatrices. Les hormones stéroïdiennes telles que le cortisol et l’aldostérone, ainsi que d’autres petites molécules liposolubles impliquées dans la signalisation intercellulaire, peuvent traverser la membrane cellulaire et se diffuser dans le cytoplasme, où elles se lient aux protéines des récepteurs nucléaires qui sont transportées dans le noyau. Là, ils servent de facteurs de transcription lorsqu’ils sont liés à leur ligand ; en l’absence de ligand, beaucoup de ces récepteurs fonctionnent comme des histones désacétylases qui répriment l’expression des gènes.:488
Lampe nucléaire
Dans les cellules animales, deux réseaux de filaments intermédiaires assurent le support mécanique du noyau : La lamina nucléaire forme un maillage organisé sur la face interne de l’enveloppe, tandis qu’un support moins organisé est fourni sur la face cytosolique de l’enveloppe. Les deux systèmes fournissent un support structurel pour l’enveloppe nucléaire et des sites d’ancrage pour les chromosomes et les pores nucléaires.
La lamelle nucléaire est composée principalement de protéines laminaires. Comme toutes les protéines, les lamines sont synthétisées dans le cytoplasme et ensuite transportées à l’intérieur du noyau, où elles sont assemblées avant d’être incorporées dans le réseau existant de lamines nucléaires. Les lamines que l’on trouve sur la face cytosolique de la membrane, comme l’émerine et la nesprine, se lient au cytosquelette pour fournir un support structurel. Les lamines se trouvent également à l’intérieur du nucléoplasme où elles forment une autre structure régulière, appelée voile nucléoplasmique, qui est visible par microscopie à fluorescence. La fonction réelle du voile n’est pas claire, bien qu’il soit exclu du nucléole et qu’il soit présent pendant l’interphase. Les structures de lamine qui composent le voile, comme LEM3, lient la chromatine et la perturbation de leur structure inhibe la transcription des gènes codant pour les protéines.
Comme les composants d’autres filaments intermédiaires, le monomère de lamine contient un domaine alpha-hélicoïdal utilisé par deux monomères pour s’enrouler l’un autour de l’autre, formant une structure dimère appelée bobine enroulée. Deux de ces structures dimères se joignent ensuite côte à côte, dans une disposition antiparallèle, pour former un tétramère appelé protofilament. Huit de ces protofilaments forment un arrangement latéral qui est torsadé pour former un filament en forme de rouleau. Ces filaments peuvent être assemblés ou désassemblés de manière dynamique, ce qui signifie que les changements dans la longueur du filament dépendent des taux concurrents d’ajout et de retrait des filaments.
Les mutations dans les gènes de la lamine entraînant des défauts dans l’assemblage des filaments provoquent un groupe de troubles génétiques rares connus sous le nom de laminopathies. La laminopathie la plus notable est la famille de maladies connue sous le nom de progéria, qui provoque l’apparition d’un vieillissement prématuré chez ses victimes. Le mécanisme exact par lequel les changements biochimiques associés donnent lieu au phénotype âgé n’est pas bien compris.
Chromosomes

Le noyau cellulaire contient la majorité du matériel génétique de la cellule sous la forme de multiples molécules d’ADN linéaires organisées en structures appelées chromosomes. Chaque cellule humaine contient environ deux mètres d’ADN :405 Pendant la majeure partie du cycle cellulaire, ceux-ci sont organisés en un complexe ADN-protéine appelé chromatine, et pendant la division cellulaire, on peut voir la chromatine former les chromosomes bien définis familiers d’un caryotype. Une petite fraction des gènes de la cellule se trouve plutôt dans les mitochondries.:438
Il existe deux types de chromatine. L’euchromatine est la forme d’ADN la moins compacte, et contient les gènes qui sont fréquemment exprimés par la cellule. L’autre type, l’hétérochromatine, est la forme la plus compacte, et contient l’ADN qui est rarement transcrit. Cette structure est encore catégorisée en hétérochromatine facultative, constituée de gènes qui ne sont organisés en hétérochromatine que dans certains types de cellules ou à certains stades de développement, et en hétérochromatine constitutive, constituée de composants structurels des chromosomes tels que les télomères et les centromères. Pendant l’interphase, la chromatine s’organise en plaques individuelles discrètes, appelées territoires chromosomiques. Les gènes actifs, qui se trouvent généralement dans la région euchromatique du chromosome, ont tendance à être localisés vers la limite du territoire du chromosome.
Les anticorps dirigés contre certains types d’organisation de la chromatine, en particulier les nucléosomes, ont été associés à un certain nombre de maladies auto-immunes, comme le lupus érythémateux systémique. Ils sont connus sous le nom d’anticorps antinucléaires (ANA) et ont également été observés de concert avec la sclérose en plaques dans le cadre d’un dysfonctionnement général du système immunitaire.
Nucléole

Le nucléole est la plus grande des structures discrètes densément colorées et sans membrane connues sous le nom de corps nucléaires que l’on trouve dans le noyau. Il se forme autour des répétitions en tandem de l’ADNr, ADN codant pour l’ARN ribosomal (ARNr). Ces régions sont appelées régions organisatrices nucléolaires (NOR). Les principaux rôles du nucléole sont de synthétiser l’ARNr et d’assembler les ribosomes. La cohésion structurelle du nucléole dépend de son activité, car l’assemblage des ribosomes dans le nucléole entraîne l’association transitoire des composants nucléolaires, ce qui facilite un nouvel assemblage des ribosomes, et donc une nouvelle association. Ce modèle est soutenu par les observations selon lesquelles l’inactivation de l’ADNr entraîne l’entremêlement des structures nucléolaires.
Dans la première étape de l’assemblage des ribosomes, une protéine appelée ARN polymérase I transcrit l’ADNr, qui forme un grand précurseur de pré-ARNr. Ce dernier est clivé en deux grandes sous-unités d’ARNr – 5.8S et 28S – et en une petite sous-unité d’ARNr 18S.:328 La transcription, le traitement post-transcriptionnel et l’assemblage de l’ARNr ont lieu dans le nucléole, avec l’aide de petites molécules d’ARN nucléolaires (snoRNA), dont certaines proviennent d’introns épissés d’ARN messagers codant pour des gènes liés à la fonction ribosomique. Les sous-unités ribosomiques assemblées sont les plus grandes structures qui passent à travers les pores nucléaires.:526
Lorsqu’on l’observe au microscope électronique, on peut voir que le nucléole est constitué de trois régions distinctes : les centres fibrillaires (CF) les plus internes, entourés par le composant fibrillaire dense (CFD) (qui contient de la fibrillarine et de la nucléoline), qui est à son tour bordé par le composant granulaire (CG) (qui contient la protéine nucléophosmine). La transcription de l’ADNr se produit soit dans le FC, soit à la limite FC-DFC, et, par conséquent, lorsque la transcription de l’ADNr dans la cellule est augmentée, davantage de FC sont détectés. La plupart du clivage et de la modification des ARNr se produit dans le CFD, tandis que les dernières étapes impliquant l’assemblage des protéines sur les sous-unités ribosomiques se produisent dans le CG.
Autres corps nucléaires
| Nom de la structure | Diamètre de la structure | Réf. |
|---|---|---|
| Corps de Cajal | 0,2-2,0 µm | |
| Clastosomes | 0,2-0.5 µm | |
| PIKA | 5 µm | |
| Corps PML | 0,2-1,0 µm | |
| Paraspeckles | 0.5-1,0 µm | |
| Paraspeckles | 20-25 nm |
En dehors du nucléole, le noyau contient un certain nombre d’autres corps nucléaires. Il s’agit notamment des corps de Cajal, des corps géminés de Cajal, de l’association caryosomique polymorphe interphase (PIKA), des corps de la leucémie promyélocytaire (PML), des paraspeckles et des splicing speckles. Bien que l’on sache peu de choses sur un certain nombre de ces domaines, ils sont importants car ils montrent que le nucléoplasme n’est pas un mélange uniforme, mais contient plutôt des sous-domaines fonctionnels organisés.
D’autres structures subnucléaires apparaissent dans le cadre de processus pathologiques anormaux. Par exemple, la présence de petits bâtonnets intranucléaires a été signalée dans certains cas de myopathie némaline. Cette affection résulte généralement de mutations de l’actine, et les bâtonnets eux-mêmes sont constitués d’actine mutante ainsi que d’autres protéines du cytosquelette.
Corps de Cajal et gemmes
Un noyau contient généralement entre une et dix structures compactes appelées corps de Cajal ou corps enroulés (CB), dont le diamètre mesure entre 0,2 µm et 2,0 µm selon le type de cellule et l’espèce. Observés au microscope électronique, ils ressemblent à des boules de fils emmêlés et constituent des foyers denses de distribution de la protéine coiline. Les CB sont impliqués dans un certain nombre de rôles différents liés au traitement de l’ARN, en particulier la maturation des petits ARN nucléolaires (snoRNA) et des petits ARN nucléaires (snRNA), et la modification des ARNm des histones.
Similaires aux corps de Cajal sont les corps de Gemini de Cajal, ou gemmes, dont le nom est dérivé de la constellation des Gémeaux en référence à leur étroite relation « jumelle » avec les CB. Les gemmes ont une taille et une forme similaires aux CB, et sont en fait pratiquement impossibles à distinguer au microscope. Contrairement aux CB, les gemmes ne contiennent pas de petites ribonucléoprotéines nucléaires (snRNP), mais elles contiennent une protéine appelée survie du motoneurone (SMN), dont la fonction est liée à la biogenèse des snRNP. On pense que les gemmes aident les CB dans la biogenèse des snRNP, bien qu’il ait également été suggéré, à partir de preuves microscopiques, que les CB et les gemmes sont des manifestations différentes de la même structure. Des études ultrastructurales ultérieures ont montré que les gems sont des jumeaux des corps de Cajal, la différence se situant au niveau du composant coiline ; les corps de Cajal sont SMN positifs et coiline positifs, et les gems sont SMN positifs et coiline négatifs.
DomainesPIKA et PTF
Les domainesPIKA, ou associations caryosomiques polymorphes en interphase, ont été décrits pour la première fois dans des études microscopiques en 1991. Leur fonction reste peu claire, bien que l’on ne pensait pas qu’ils soient associés à la réplication active de l’ADN, à la transcription ou au traitement de l’ARN. On a constaté qu’ils s’associent souvent à des domaines discrets définis par une localisation dense du facteur de transcription PTF, qui favorise la transcription de petits ARN nucléaires (snRNA).
Corps PML
Les corps de leucémie myéloïde (corps PML) sont des corps sphériques que l’on trouve dispersés dans le nucléoplasme, mesurant environ 0,1-1,0 µm. Ils sont connus sous un certain nombre d’autres noms, notamment domaine nucléaire 10 (ND10), corps de Kremer et domaines oncogènes de la PML. Les corps PML doivent leur nom à l’un de leurs principaux composants, la protéine de la leucémie promyélocytaire (PML). Ils sont souvent observés dans le noyau en association avec les corps de Cajal et les corps de clivage. Les souris Pml-/-, qui sont incapables de créer des corps PML, se développent normalement sans effets néfastes évidents, ce qui montre que les corps PML ne sont pas nécessaires pour la plupart des processus biologiques essentiels.
Speckles d’épissage
Les speckles sont des structures subnucléaires qui sont enrichies en facteurs d’épissage de l’ARN pré-messager et sont situées dans les régions interchromatiniennes du nucléoplasme des cellules de mammifères. Au niveau du microscope à fluorescence, ils apparaissent comme des structures irrégulières et ponctuées, dont la taille et la forme varient, et lorsqu’ils sont examinés au microscope électronique, ils sont vus comme des amas de granules d’interchromatine. Les mouchetures sont des structures dynamiques, et leurs composants protéiques et ARN-protéiques peuvent circuler continuellement entre les mouchetures et d’autres emplacements nucléaires, y compris les sites de transcription actifs. Les études sur la composition, la structure et le comportement des speckles ont fourni un modèle permettant de comprendre la compartimentation fonctionnelle du noyau et l’organisation de la machinerie d’expression des gènes ; les snRNP d’épissage et autres protéines d’épissage nécessaires au traitement du pré-ARNm. En raison de l’évolution des besoins d’une cellule, la composition et l’emplacement de ces corps changent en fonction de la transcription de l’ARNm et de la régulation par phosphorylation de protéines spécifiques. Les mouchetures d’épissage sont également connues sous le nom de mouchetures nucléaires (nuclear specks), de compartiments de facteurs d’épissage (splicing factor compartments), d’amas de granules d’interchromatine (interchromatin granule clusters) et de snurposomes B.Les snurposomes B sont présents dans les noyaux des ovocytes des amphibiens et dans les embryons de Drosophila melanogaster. Les snurposomes B apparaissent seuls ou attachés aux corps de Cajal dans les micrographies électroniques des noyaux d’amphibiens. Les IGCs fonctionnent comme des sites de stockage pour les facteurs d’épissage.
Paraspeckles
Découverts par Fox et al. en 2002, les paraspeckles sont des compartiments de forme irrégulière dans l’espace interchromatin du noyau. D’abord documentés dans les cellules HeLa, où il y en a généralement 10 à 30 par noyau, les paraspeckles sont maintenant connus pour exister également dans toutes les cellules primaires humaines, les lignées cellulaires transformées et les coupes de tissus. Leur nom provient de leur distribution dans le noyau ; le « para » est l’abréviation de parallèle et les « speckles » font référence aux speckles d’épissage dont ils sont toujours très proches.
Les paraspeckles séquestrent les protéines nucléaires et l’ARN et semblent donc fonctionner comme une éponge moléculaire qui participe à la régulation de l’expression des gènes. De plus, les paraspeckles sont des structures dynamiques qui sont modifiées en réponse aux changements de l’activité métabolique cellulaire. Ils sont dépendants de la transcription et en l’absence de transcription de l’ARN Pol II, le paraspeckle disparaît et tous ses composants protéiques associés (PSP1, p54nrb, PSP2, CFI(m)68 et PSF) forment une coiffe périnucléolaire en forme de croissant dans le nucléole. Ce phénomène est démontré au cours du cycle cellulaire. Dans le cycle cellulaire, les paraspeckles sont présents pendant l’interphase et pendant toute la mitose sauf la télophase. Pendant la télophase, lorsque les deux noyaux filles sont formés, il n’y a pas de transcription de l’ARN Pol II, donc les composants protéiques forment plutôt une coiffe périnucléolaire.
Fibrilles de périchromatine
Les fibrilles de périchromatine ne sont visibles qu’au microscope électronique. Elles sont situées à côté de la chromatine transcriptionnellement active et sont supposées être les sites de traitement actif du pré-ARN.
Clastosomes
Les clastosomes sont de petits corps nucléaires (0,2-0,5 µm) décrits comme ayant une forme d’anneau épais en raison de la capsule périphérique autour de ces corps. Ce nom est dérivé du grec klastos, brisé et soma, corps. Les clastosomes ne sont généralement pas présents dans les cellules normales, ce qui les rend difficiles à détecter. Ils se forment dans des conditions de forte protéolyse à l’intérieur du noyau et se dégradent lorsqu’il y a une diminution de l’activité ou si les cellules sont traitées avec des inhibiteurs du protéasome. La rareté des clastosomes dans les cellules indique qu’ils ne sont pas nécessaires à la fonction du protéasome. Il a également été démontré que le stress osmotique provoque la formation de clastosomes. Ces corps nucléaires contiennent des sous-unités catalytiques et régulatrices du protéasome et de ses substrats, ce qui indique que les clastosomes sont des sites de dégradation des protéines.