La néprilysine est devenue un centre d’intérêt en cardiologie, en raison des avantages impressionnants de la combinaison de l’inhibition de la néprilysine et du blocage des récepteurs de l’angiotensine démontrés dans le récent essai PARADIGM-HF, qui a testé le LCZ696 (désormais connu sous le nom de sacubitril/valsartan et commercialisé par Novartis sous le nom d’Entresto) dans le traitement de l’insuffisance cardiaque systolique à fraction d’éjection réduite (HFrEF).1 Cependant, la néprilysine EC 3.4.24.11 (également connue sous le nom d’endopeptidase neutre, d’endoprotéase 24.11, de NEP, d’antigène commun de la leucémie lymphoblastique aiguë, d’antigène de différenciation du groupe des antigènes neutrophiles 10, de métalloendopeptidase membranaire EC 3.4.24.11 et d’enképhalinase) est une enzyme très polyvalente, qui est revenue sur le devant de la scène, après une carrière mouvementée de > 40 ans2.
Dans le système cardiovasculaire, la néprilysine clive de nombreux peptides vasoactifs. Certains de ces peptides ont des effets vasodilatateurs (notamment les peptides natriurétiques, l’adrénomédulline et la bradykinine), et d’autres ont des effets vasoconstricteurs (angiotensine I et II, et endothéline-1, entre autres). Néanmoins, la néprilysine présente diverses affinités relatives parmi les différents substrats ; sa plus grande affinité est pour le peptide natriurétique auriculaire, le peptide natriurétique de type C et les angiotensines I et II ; sa plus faible affinité est pour le peptide natriurétique de type B (BNP), l’endothéline-1 et la bradykinine.3
Depuis des décennies, la néprilysine est une cible biologique importante. Le monde universitaire et l’industrie ont combiné des efforts actifs pour rechercher des inhibiteurs de la néprilysine (NEPI) qui pourraient être utiles en pratique clinique. Dans un premier temps, à la fin des années 1980 et au début des années 1990, des NEPI ont été testés en monothérapie. Le candoxatril a montré des effets préliminaires prometteurs sur les paramètres hémodynamiques. Cependant, un autre NEPI, l’ecadotril, a entraîné une mortalité plus élevée, sans preuve d’efficacité clinique par rapport au placebo chez les patients souffrant d’insuffisance cardiaque.4,5 Par conséquent, le développement de la monothérapie NEPI pour l’insuffisance cardiaque a été interrompu. Par la suite, certaines études ont mis en évidence une activation simultanée du système rénine-angiotensine-aldostérone, ainsi qu’une augmentation de la bioactivité des peptides natriurétiques. Ces résultats ont inspiré le développement et l’essai d’agents combinant l’activité de l’IENP et de l’inhibiteur de l’enzyme de conversion de l’angiotensine (IECA), ce qui a donné naissance aux médicaments connus sous le nom d’inhibiteurs de la vasopeptidase. Plusieurs inhibiteurs de la vasopeptidase ont été développés, notamment l’omapatrilat, le fasidotril, le sampatrilat et le mixanpril. Après de nombreuses études, les spécialistes ont été très déçus de constater que l’omapatrilat provoquait un nombre croissant d’épisodes d’œdème de Quincke cliniquement pertinents.6 Après plus d’une décennie d’errance dans le désert, un nouveau concept a été mis au point, l’association de l’IENP et des antagonistes des récepteurs de l’angiotensine II (ARA), qui a donné naissance à une nouvelle classe de médicaments appelés inhibiteurs de la néprilysine des récepteurs de l’angiotensine. Le sacubitril/valsartan est le premier inhibiteur de la néprilysine des récepteurs de l’angiotensine de sa catégorie, qui a montré des résultats meilleurs que prévu dans l’essai PARADIGM-HF1 (figure).
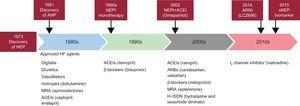
Schéma des faits marquants historiques de la néprilysine. IECA, inhibiteur de l’enzyme de conversion de l’angiotensine ; PNA, peptide natriurétique auriculaire ; ARA, antagoniste des récepteurs de l’angiotensine II ; ARNI, inhibiteur de la néprilysine des récepteurs de l’angiotensine ; HF, insuffisance cardiaque ; ARM, antagoniste des récepteurs des minéralocorticoïdes ; NEP, néprilysine ; NEPI, inhibiteur de la néprilysine ; sNEP, néprilysine soluble.
PARADIGM-HF était une étude multinationale, randomisée, en double aveugle, portant sur 8442 patients. L’objectif était de comparer le sacubitril/valsartan à l’énalapril chez des patients adultes souffrant d’insuffisance cardiaque chronique (classe II-IV de la New York Heart Association) et d’une fraction d’éjection ventriculaire gauche réduite (FEVG ≤ 40%, modifiée ultérieurement à ≤ 35%), en plus d’un autre traitement de l’insuffisance cardiaque.Le critère d’évaluation principal était le composite décès cardiovasculaire ou hospitalisation pour insuffisance cardiaque. Avant de participer à l’étude, les patients étaient traités avec le traitement standard de soins, qui comprenait des IEC/ARA (> 99 %), des bêta-bloquants (94 %), des antagonistes des minéralocorticoïdes (58 %) et des diurétiques (82 %). La durée médiane du suivi était de 27 mois, et les patients ont été traités jusqu’à 4,3 ans.
Les patients devaient interrompre leur traitement existant par IEC ou ARA et entrer dans une période de rodage séquentielle en simple aveugle. Pendant la période de rodage, ils ont reçu un traitement par énalapril 10mg deux fois par jour, suivi d’un traitement en simple aveugle par sacubitril/valsartan 100mg deux fois par jour, qui a été augmenté à 200mg deux fois par jour. Ils ont ensuite été randomisés pour la période en double aveugle de l’étude. Pendant cette période, ils ont reçu soit 200 mg de sacubitril/valsartan, soit 10 mg d’énalapril, deux fois par jour. L’âge moyen de la population étudiée était de 64 ans, et 19% avaient 75 ans ou plus. Au moment de la randomisation, 70 % des patients étaient en classe II de la NYHA, 24 % en classe III et 0,7 % en classe IV. La FEVG moyenne était de 29 %, et il y avait 963 (11,4 %) patients avec une FEVG de base > 35 % et ≤ 40 %. L’étude a été interrompue prématurément, en raison des réductions écrasantes des décès de causes cardiovasculaires et de la réduction du critère primaire composite (décès cardiovasculaire ou hospitalisation secondaire à une insuffisance cardiaque). L’essai PARADIGM-HF est également appelé l’essai 20%, en raison des réductions relatives homogènes de ∼20% de tous les critères d’évaluation étudiés, y compris le critère d’évaluation primaire composite (décès d’origine cardiovasculaire, mort subite d’origine cardiaque et hospitalisation pour insuffisance cardiaque) (tableau 1).
Essai PARADIGM-HF : Effets du traitement sur le critère composite primaire, ses composantes et la mortalité toutes causes confondues, sur un suivi médian de 27 moissuivi médian de 27 mois
| Points d’aboutissement | Ratio de risque (95%CI) | Réduction du risque relatif | P |
|---|---|---|---|
| Critère composite primaire de décès CV et d’hospitalisations dues à une insuffisance cardiaque | 0.80 (0,73-0,87) | 20% | .0000002 |
| Composants individuels du critère composite primaire | |||
| Décès CV | 0,80 (0,71-0.89) | 20% | .00004 |
| Première hospitalisation pour insuffisance cardiaque | 0,79 (0,71-0,89) | 21% | .00004 |
| Mesure secondaire | |||
| Mortalité toutes causes | 0,84 (0,76-0,93) | 16% | .0005 |
95%CI, intervalle de confiance à 95% ; CV, lié aux maladies cardiovasculaires.
Bien que le sacubitril/valsartan se soit montré extrêmement prometteur, il existe des défis et des questions non abordées qui méritent des études supplémentaires et des éclaircissements supplémentaires (tableau 2). Certaines de ces questions ont été soulevées et discutées dans le rapport d’évaluation de l’Agence européenne des médicaments sur Entresto7.
Résumé des préoccupations de sécurité pour le sacubitril/Valsartan
| Risques importants identifiés | Hypotension Affection rénale Hyperkaliémie Angioedème |
| Risques potentiels importants | Hépatotoxicité Affection cognitive Interaction statine-médicament .médicamenteuse Thrombocytopénie Neutropénie |
| Informations manquantes | Patients pédiatriques atteints d’HF Patients atteints d’insuffisance rénale sévère Données à long terme.données à long terme sur l’utilisation du sacubitril/valsartan dans l’HF Effets chez les patients naïfs d’IEC/ARB atteints d’HF |
ACEI, inhibiteur de l’enzyme de conversion de l’angiotensine ; ARA, antagoniste des récepteurs de l’angiotensine II ; HF, insuffisance cardiaque.
Modifié à partir du rapport d’évaluation de l’Agence européenne des médicaments7.
Premièrement, lorsque les patients rencontrent des problèmes de tolérance (par exemple, pression artérielle systolique ≤ 95mmHg, hypotension symptomatique, hyperkaliémie, dysfonctionnement rénal), les recommandations actuelles sont d’ajuster les médicaments concomitants, et/ou de diminuer ou d’arrêter temporairement le sacubitril/valsartan. En fait, l’Agence européenne des médicaments recommande de ne pas initier le traitement chez les patients présentant des taux de potassium sérique > 5,4 mmol/L ou une pression artérielle systolique
mmHg.
Deuxièmement, les données sont limitées pour les patients qui prennent actuellement des doses faibles ou nulles d’IEC ou d’ARA. Par conséquent, les recommandations actuelles pour ces patients sont de commencer par une dose de 50 mg deux fois par jour et d’augmenter la dose lentement (doublement toutes les 3 à 4 semaines).
Troisièmement, le sacubitril/valsartan ne doit pas être coadministré avec un IEC ou un ARA. En cas d’utilisation concomitante avec un IEC, il existe un risque potentiel élevé d’angioedème. Par conséquent, le sacubitril/valsartan ne doit pas être débuté pendant au moins 36 heures après l’arrêt du traitement par IEC.
Quatrièmement, aucun ajustement de la dose n’est nécessaire chez les patients présentant une insuffisance rénale légère (débit de filtration glomérulaire estimé à 60-90mL/min/1,73 m2). Cependant, une dose initiale de 50mg deux fois par jour doit être envisagée chez les patients présentant une insuffisance rénale modérée (taux de filtration glomérulaire estimé à 30-60mL/min/1,73 m2). Il n’existe pas de données sur les patients atteints d’insuffisance rénale terminale, mais l’utilisation du sacubitril/valsartan n’est pas recommandée pour ces patients.
Cinquièmement, il convient d’être prudent lors de l’initiation du sacubitril/valsartan chez les patients présentant une classification fonctionnelle IV de la NYHA, en raison de l’expérience clinique limitée dans cette population.
Sixièmement, le BNP n’est pas un biomarqueur approprié de l’insuffisance cardiaque chez les patients traités par sacubitril/valsartan, car il est un substrat de la néprilysine. Il est recommandé de passer au NT-proBNP comme biomarqueur du peptide natriurétique.
Septièmement, un risque théorique associé à l’inhibition de la néprilysine est lié à l’accumulation du substrat de la néprilysine, l’amyloïde-β, dans le cerveau.8 Aucune augmentation de l’incidence des effets indésirables liés à la cognition ou à la démence n’a été signalée dans l’essai PARADIGM-HF. Cependant, il est possible que ces effets n’aient pas été détectés à ce jour, car la démence peut prendre plus de temps à se développer que la période d’observation actuelle des participants à l’essai. De plus, il n’était pas prévu que les sujets atteints de démence légère participent à l’essai. Cependant, l’essai de phase III en cours PARAGON-HF a mis en place une évaluation de la fonction cognitive.
Huitièmement, la coadministration de sacubitril/valsartan et d’atorvastatine a augmenté la Cmax de l’atorvastatine et de ses métabolites jusqu’à 2 fois. Il n’y a pas eu d’augmentation significative des effets indésirables potentiels liés aux statines chez les patients qui ont reçu à la fois le sacubitril/valsartan et une statine dans l’essai PARADIGM-HF. Néanmoins, d’autres analyses ont montré que des doses plus élevées de statines étaient associées à un plus grand nombre d’événements indésirables, lorsqu’elles étaient associées soit au sacubitril/valsartan, soit à l’énalapril. Cependant, les tendances étaient différentes selon la statine spécifique administrée. En attendant les résultats d’autres études, la prudence a été recommandée pour cette association médicamenteuse.7
L’essai PARADIGM-HF est axé sur l’insuffisance cardiaque chronique avec une FEVG limitée. La question se pose donc : Qu’en est-il des autres 50 % de patients souffrant d’insuffisance cardiaque, mais dont la fraction d’éjection est préservée, également connus sous le nom de patients HFpEF ? Actuellement, il n’y a pas assez d’essais cliniques sur l’HFpEF qui ont démontré les avantages thérapeutiques des agents couramment utilisés chez les patients à fraction d’éjection réduite. Par conséquent, les traitements de l’HFpEF sont orientés vers la gestion des symptômes et des facteurs de risque cardiovasculaire. Cependant, chez les patients atteints d’HFpEF, le sacubitril/valsartan a montré des résultats prometteurs en termes de sécurité et d’efficacité dans un essai de phase 2. L’essai PARAMOUNT était un essai contrôlé actif, randomisé, en double aveugle, à groupes parallèles, qui comparait le sacubitril/valsartan au valsartan seul.9 Le critère d’évaluation principal était la variation du NT-proBNP par rapport aux valeurs initiales à 12 semaines. Les groupes présentaient des caractéristiques de départ similaires. La plupart des patients étaient âgés, de sexe féminin, en surpoids et classés dans la classe II de la NYHA. Une réduction plus importante du NT-proBNP a été détectée à la semaine 4 dans le groupe sacubitril/valsartan par rapport au groupe valsartan, mais elle n’était pas significative (P = 0,063). Après 12 semaines, le NT-proBNP était significativement réduit dans le groupe sacubitril/valsartan par rapport au valsartan (P = 0,005). Les résultats de PARAMOUNT suggèrent que le sacubitril/valsartan pourrait avoir des effets favorables chez les patients atteints d’HFpEF. D’autres études sur la population atteinte d’HFpEF sont en cours dans l’étude PARAGON, une étude multicentrique, randomisée, en double aveugle, à groupes parallèles, contrôlée par un traitement actif. Cette étude vise à évaluer l’efficacité et la sécurité du sacubitril/valsartan par rapport au valsartan sur la morbidité et la mortalité chez les patients souffrant d’insuffisance cardiaque (classe NYHA II-IV) et ayant une fraction d’éjection préservée.
En dernier lieu, et non des moindres, très récemment, la néprilysine soluble circulante (sNEP) a été proposée comme biomarqueur putatif2. A l’heure actuelle, les données sur la sNEP suggèrent qu’elle pourrait jouer un rôle pronostique dans l’insuffisance cardiaque chronique10 et dans l’insuffisance cardiaque aiguë décompensée,11 mais les résultats sont controversés dans l’HFpEF.12 Il est intéressant de noter que la sNEP circulante s’est avérée être catalytiquement active.13 De plus, un rapport récent a démontré que la sNEP pourrait même être supérieure au NT-proBNP en tant que biomarqueur pronostique de substitution de l’axe neurohormonal dans l’insuffisance cardiaque.14 D’autres améliorations des tests de la sNEP sont obligatoires avant son introduction dans la pratique clinique. Cependant, les données rapportées à ce jour suggèrent qu’il pourrait devenir un outil précieux pour le pronostic des patients et éventuellement l’orientation thérapeutique.
En guise d’épilogue, le coût du traitement avec ce nouvel agent est susceptible de représenter un obstacle à son utilisation dans la pratique clinique réelle quotidienne, puisque le coût des agents efficaces tels que l’IEC enalapril est très faible (comparable au coût d’un chewing-gum dans de nombreux pays). On peut imaginer que la mise en œuvre d’une stratégie basée sur les biomarqueurs pourrait être proposée pour passer préférentiellement d’un traitement par IEC à Entresto chez les patients les plus malades. Dans cette optique, il convient de noter que l’utilisation de peptides natriurétiques figurait parmi les critères d’inclusion de l’essai PARADIGM-HF. Le rapport coût-efficacité et le coût par année de vie gagnée ajustée à la qualité de vie du sacubitril/valsartan par rapport à l’énalapril pour le traitement de l’HFrEF méritent des recherches intensives dans des scénarios du monde réel ajustés par pays et système de soins de santé.15
CONFLITS D’INTÉRÊTS
A. Bayes-Genis et J. Lupón ont déposé une demande de brevet pour le sNEP comme biomarqueur pronostique, qui est en attente d’approbation. A. Bayes-Genis a donné des conférences et a participé à des conseils consultatifs de Novartis.