- Introduction
- Types de Spina Bifida
- Embryologie
- Pathophysiologie
- Epidémiologie
- Aétiologie
- Procédures de diagnostic
- Mesures des résultats
- Gestion / Interventions
- Gestion de la physiothérapie
- Complications
- Les complications courantes de la MMC comprennent les éléments suivants.
- Complications neurochirurgicales
- Conclusion
Introduction
Le spina bifida est un défaut variable dans lequel l’arc vertébral de la colonne vertébrale est soit incomplètement formé, soit absent. Le terme Bifida vient du mot latin Bifidus, ou « laissé en 2 parties ». Il est classé comme une anomalie du tube neural (c’est-à-dire la structure embryonnaire qui donne naissance à la moelle épinière et au cerveau). Les anomalies du tube neural peuvent se présenter de différentes manières, de la mortinaissance à la découverte radiographique fortuite d’une spina bifida occulta. Le terme myélodysplasie a été utilisé comme synonyme de spina bifida. Les lésions se produisent le plus souvent dans les régions lombaire et sacrée, mais elles peuvent se trouver n’importe où sur toute la longueur de la colonne vertébrale. Il s’agit d’une malformation de la moelle épinière traitable qui se produit à des degrés de gravité variables.
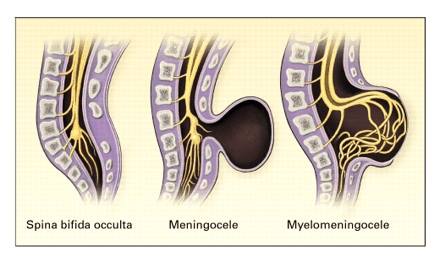
Types de Spina Bifida
Spina bifida occulta : Il peut se produire sans défauts neurologiques.
Méningocèle : Un gonflement kystique de la dure-mère et de l’arachnoïde, fait saillie à travers le défaut de spina bifida dans l’arc vertébral.
Méningomyelocèle : lorsque le tissu de la moelle s’étend dans le méningocèle.
Myeloschisis : Si la moelle épinière est exposée à la surface du dos, on parle de myéloschisis
Embryologie
Les anomalies du tube neural se produisent entre le 17e et le 30e jour de gestation. Cette anomalie perturbe alors l’ensemble des tissus sus-jacents, empêchant la fermeture de l’arc vertébral.Si l’arc vertébral postérieur et les tissus sus-jacents ne se forment pas normalement, la moelle épinière et les méninges normales peuvent alors faire une hernie à travers l’anomalie et provoquer une méningomyélocèle (MMC) .Si l’arc vertébral ne parvient pas à croître et à fusionner normalement et que la moelle épinière et les méninges ne sont pas perturbées, il en résulte une spina bifida occulta.
Pathophysiologie
La MMC est associée à un développement anormal du tube neural crânien, ce qui entraîne plusieurs anomalies caractéristiques du SNC. La malformation de Chiari de type II est caractérisée par une hypoplasie cérébelleuse et des degrés variables de déplacement caudal du tronc cérébral inférieur dans le canal cervical supérieur à travers le foramen magnum. Cette déformation entrave l’écoulement et l’absorption du liquide céphalo-rachidien (LCR) et provoque une hydrocéphalie, qui survient chez plus de 90 % des nourrissons atteints de MMC. De nombreuses autres malformations du système nerveux y sont associées, notamment la syringomyélie, la diastématomyélie et l’agénésie du corps calleux. Les associations non neurologiques comprennent les malformations de la colonne vertébrale, l’hydronéphrose, les anomalies cardiaques et les anomalies gastro-intestinales.
Epidémiologie
Il existe des variations d’incidence entre certaines populations raciales. L’incidence de la MMC en Amérique : 1,1 sur 1000 naissances. L’incidence actuelle en Amérique est d’environ 0,6 pour 1000, et il y a de bonnes raisons de penser que cette incidence est en baisse constante. Les cas afro-américains représentent souvent un tiers de ceux trouvés chez les Américains blancs, tandis que ceux des Hispano-Américains sont deux à trois fois plus élevés.On rapporte 1 cas sur 10 000 en Finlande et 5 sur 1000 en Irlande du Nord 5. Il y a au moins 2000 cas/an aux USA
Aétiologie
Le risque qu’un adulte atteint de MMC ait un enfant présentant une anomalie du tube neural est de 5% . Les femmes ayant un faible taux de folates dans les globules rouges en début de grossesse ont un risque jusqu’à 6 fois plus élevé d’avoir un enfant présentant une anomalie du tube neural. Exposition intra-utérine à des médicaments antiépileptiques, en particulier le valproate et la carbamazépine, et à des médicaments utilisés pour provoquer l’ovulation. Les expositions maternelles aux fumonisines, aux champs électromagnétiques, aux sites de déchets dangereux, aux sous-produits de désinfection présents dans l’eau potable et aux pesticides.Parmi les autres facteurs de risque de MMC figurent l’obésité maternelle, l’hyperthermie (résultant d’une fièvre ou d’une maladie fébrile chez la mère ou de l’utilisation de saunas, de bains à remous ou de lits de bronzage) et la diarrhée maternelle.
Procédures de diagnostic
La mesure du taux d’α-fœtoprotéine sérique maternelle (MSAFP) est un test de dépistage courant. Si le taux est élevé, indiquant qu’une partie du fœtus n’est pas recouverte de peau, ce test de dépistage est alors suivi d’une échographie détaillée. L’échographie permet de diagnostiquer 92 % des anomalies du tube neural. Les mères présentant des niveaux élevés de MSAFP et une échographie d’apparence normale peuvent être évaluées par amniocentèse pour la présence de niveaux élevés d’acétylcholinestérase dans le liquide amniotique.
Mesures des résultats
La mesure de l’indépendance fonctionnelle (FIM) est la mesure fonctionnelle la plus largement acceptée. Le FIM se compose de 18 échelles notées de 1 à 7 ; des chiffres plus élevés signifient une plus grande capacité. D’autres comprennent le questionnaire sur la santé de l’enfant (CHQ), l’indice de Barthel (BI).
Gestion / Interventions
Généralement, la chirurgie suit dans les premiers jours de vie pour fermer le défaut de la moelle épinière. Il est également important de prévenir les infections et les traumatismes supplémentaires sur les tissus exposés. D’autres interventions chirurgicales peuvent être nécessaires pour gérer d’autres problèmes au niveau des pieds, des hanches ou de la colonne vertébrale. Les personnes atteintes d’hydrocéphalie devront également subir d’autres interventions chirurgicales en raison de la nécessité de remplacer la dérivation. En raison des problèmes intestinaux et vésicaux qui sont souvent causés par l’anomalie du tube neural, le cathétérisme peut être nécessaire.
L’étude sur la gestion de la myéloméningocèle (MOMS).L’essai MOMS est un essai clinique multicentrique parrainé par les NIH qui a débuté en 2002 pour évaluer quel était le meilleur traitement de la myéloméningocèle – la chirurgie fœtale ou la réparation chirurgicale après la naissance.
Les résultats de l’essai clinique ont montré que la chirurgie prénatale réduisait de manière significative la nécessité de détourner, ou de dériver, le liquide du cerveau, améliorait le développement mental et la fonction motrice et augmentait la probabilité que l’enfant marche sans assistance. L’essai MOMS a prouvé que certains des facteurs à l’origine de problèmes comme la malformation de Chiari II et l’hydrocéphalie sont en fait ceux qui se développent au cours de la deuxième moitié de la grossesse. La fermeture précoce du dos du fœtus peut permettre de restaurer une partie de la fonction nerveuse pendant la grossesse et, en fait, d’inverser le développement de cette grave affection.
Gestion de la physiothérapie
Une approche multidisciplinaire envers la gestion des patients atteints de MMC est essentielle pour obtenir de bons résultats. Le patient doit être évalué le plus tôt possible après la naissance. À différents stades, l’orientation de la physiothérapie changera en fonction de l’évolution des besoins du patient. Un examen régulier est essentiel pour répondre aux besoins du patient. Les parents et les soignants doivent être impliqués dans les soins du patient.
- PRESENTATION CLINIQUE – Les éléments suivants peuvent être observés dans le cas de la MMC.Paralysie flasque ou spastique des membres inférieurs, Incontinence urinaire et ou fécale, Hydrocéphalie, Mauvais contrôle du tronc, Complications musculo-squelettiques, Scoliose, Dysplasie de la hanche, Luxation de la hanche, Contracture de la hanche/du genou, Pied bot, Atrophie musculaire
- ÉVALUATION PHYSIQUE- Les éléments suivants peuvent être observés lors de l’évaluation physique.
- Plaie ouverte
- Déformations
- Anomalies cutanées
- Sensation
- Tonus musculaire
- Force musculaire
- Amplitude de mouvement
- Contractures
- Dislocation
- . Jalons de développement
- PLAN DE SOINS
- Prévenir/corriger les déformations
- Maintenir/améliorer les propriétés physiologiques des articulations et des muscles
- Surveiller le développement moteur normal
- Éduquer les parents, soignants
- Encourager et maximiser la mobilité indépendante
- Encourager la participation à une activité physique régulière.
- MOYENS DE TRAITEMENT
- Moulage en série (CTEV)
- Mobilisation passive, exercices et étirements gradués.
- Stimulation tactile
- Équilibre & Exercices de contrôle du tronc
- Positionnement
- Orthèse & Appareils d’assistance
- Éducation des parents : Les parents doivent être informés de l’état, de l’évolution et du pronostic de l’enfant et participer à la planification du traitement et aux programmes à domicile. Moulage en série pour le CTEV.
Complications
Les complications courantes de la MMC comprennent les éléments suivants.
- Influence des organes reproducteurs
- Vessie neurogène : La grande majorité des enfants atteints de MMC ont une vessie neurogène.
- Seuls 5,0 % à 7,5 % de la population MMC ont une fonction urologique normale.
- Intestin neurogène : La continence intestinale traditionnelle est présente chez environ 10% des enfants atteints de MMC.
- Complications musculo-squelettiques.
- Problèmes psychosociaux : Le syndrome de l’enfant vulnérable.
- Escarres
- Troubles de l’apprentissage
Complications neurochirurgicales
- Les taux d’infection des plaies varient de 7% à 12%
- Hydrocéphalie ; déficience visuelle
- Ventriculite : QI ultérieur faible
- Échec de la dérivation
- 5 % à 32 % des nourrissons atteints de MMC présenteront des signes de compression de Chiari, ce qui en fait la cause la plus fréquente de décès chez les patients atteints de MMC
- La compression de Chiari peut survenir à tout moment, la présentation au cours de la première année de vie est associée à une mortalité pouvant atteindre 50 %.
- Les céphalées chroniques sont le symptôme le plus fréquemment rapporté.
- Obésité – L’obésité est prévalente chez les enfants atteints de MMC. Plus le niveau de la lésion le long de la colonne vertébrale est élevé, plus son pourcentage de graisse corporelle est élevé.Chez les enfants présentant des lésions L1-L3, l’effet de l’obésité croissante est un facteur critique dans la perte de la déambulationTypiquement, les enfants atteints de MMC atteignent leurs capacités ambulatoires maximales vers l’âge de 10 ans. Ils connaissent ensuite un lent déclin fonctionnel au cours des 10 années suivantes. Les enfants qui déambulent davantage ont un pourcentage de graisse corporelle plus faible.
Conclusion
Environ 90% des bébés nés avec un spina-bifida vivent maintenant jusqu’à l’âge adulte, environ 80% ont une intelligence normale et environ 75% font du sport et d’autres activités amusantes. La plupart réussissent à l’école et beaucoup font du sport.
Une étude transversale (août 2020) menée par une équipe multidisciplinaire décrivant les problèmes de santé et les conditions de vie d’une cohorte d’adultes vivant avec le Spina Bifida suggère la présence d’une prévalence plus élevée d’incontinence urinaire et fécale, de douleurs et de surpoids chez les adultes atteints de Spina Bifida. Les personnes âgées de plus de 46 ans présentaient des conditions médicales moins compliquées, de meilleures fonctions physiques et cognitives, et un niveau d’éducation plus élevé, une vie indépendante et une participation à la société, tandis que les personnes âgées de < 46 ans présentaient davantage de conditions secondaires telles que l’hydrocéphalie, la malformation de Chiari II, les symptômes de cordon captif et l’allergie au latex.
- 1,0 1,1 Lundy-Ekman L (2007). Neurosciences : Principes fondamentaux de la réadaptation. 3e édition. Louis : Saunders, 2007
- 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13 2.14 Spina Bifida : Contexte, physiopathologie, étiologie . Emedicine.medscape.com. 2019 . Disponible à partir de : http://emedicine.medscape.com/article/311113-overview
- 4. Burke R, Liptak G. Fournir une maison médicale de soins primaires pour les enfants et les jeunes atteints de spina-bifida. PEDIATRICS. 2011;128(6):e1645-e1657.
- Fletcher JM, Copeland K, Frederick JA (2005). Niveau de lésion spinale dans le spina bifida : une source d’hétérogénéité neuronale et cognitive. Journal of Neurosurgery. 102(3 Suppl):268-79
- 5.0 5.1 5. Shin M, Besser L, Siffel C, Kucik J, Shaw G, Lu C et al. Prevalence of Spina Bifida Among Children and Adolescents in 10 Regions in the United States. PEDIATRICS. 2010;126(2):274-279.
- 6.0 6.1 6. Canfield M, Ramadhani T, Shaw G, Carmichael S, Waller D, Mosley B et al. Anencéphalie et spina bifida chez les Hispaniques : Maternal, sociodemographic, and acculturation factors in the National Birth Defects Prevention Study. Recherche sur les anomalies congénitales, partie A : tératologie clinique et moléculaire. 2009;85(7):637-646.
- 7. McLone D, Knepper P. The Cause of Chiari II Malformation : A Unified Theory. Neurochirurgie pédiatrique. 1989;15(1):1-12.
- 8. McDonnell G, McCann J. Issues of medical management in adults with spina bifida. Système nerveux de l’enfant. 2000;16(4):222-227.
- 9.0 9.1 Campbell, SK, Linden, DW, Palisano RJ (2000). Physical Therapy for Children (2e édition). Philadelphie, PA : W.B. Saunders.
- Bendt M, Gabrielsson H, Riedel D, Hagman G, Hultling C, Franzén E, Eriksson M, Seiger Å. Adultes atteints de spina-bifida : Une étude transversale des problèmes de santé et des conditions de vie. Cerveau et comportement. 2020 Aug;10(8):e01736.