Il faut connaître certaines propriétés de base du composé donné et sa structure de Lewis pour comprendre sa géométrie moléculaire, sa polarité et d’autres propriétés de ce type. SF4 est une formule chimique pour le tétrafluorure de soufre. C’est un gaz corrosif incolore qui est utilisé dans la synthèse de plusieurs composés organofluorés. Le SF4 est un composé plutôt dangereux mais il est largement utilisé dans les entreprises chimiques et pharmaceutiques.
| Nom de la molécule | Tétrafluorure de soufre ( SF4) |
| Nombre d’électrons de valence dans la molécule | 34 |
| Hybridation du SF4 | sp3. hybridation |
| Angles de liaison | 102 degrés et 173 degrés |
| Géométrie moléculaire du SF4 | Trigonal bipyramidal |
Pour comprendre les propriétés de cette molécule, telles que sa réactivité, sa polarité, et plus encore, il faut d’abord connaître la structure de Lewis du SF4.
Contenu
Géométrie moléculaire du SF4
Il est facile de comprendre la géométrie moléculaire d’une molécule donnée en utilisant la formule moléculaire ou le modèle VSEPR. Une formule moléculaire permet de connaître le nombre exact et le type d’atomes présents dans le composé donné. Ici, il y a un atome de soufre et quatre atomes de fluor dans le composé, ce qui le rend similaire à la formule moléculaire de AX4E.
Les molécules ayant une formule moléculaire de AX4E ont une géométrie moléculaire bipyramidale trigonale. Ici, deux atomes de fluor formant des liaisons avec l’atome de soufre sont sur les positions équatoriales, et les deux autres sont sur les positions axiales. Comme il y a une paire solitaire sur l’atome central, elle repousse la paire d’électrons de liaison, ce qui modifie un peu la forme et la fait apparaître comme une balançoire. Les électrons suivent ce modèle d’arrangement selon la règle VSEPR pour minimiser les forces de répulsion entre les paires d’électrons solitaires afin de maximiser la stabilité de la molécule.
Donc, SF4 a une géométrie moléculaire bipyramidale trigonale.
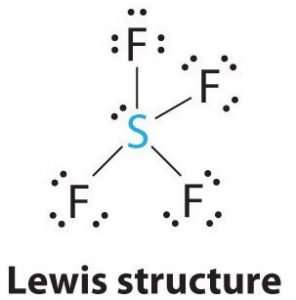
Structure de Lewis du SF4
La structure de Lewis est une représentation imagée des liaisons et des électrons de valence dans la molécule. Les liaisons formées entre deux atomes sont représentées à l’aide de lignes, tandis que les électrons de valence ne formant aucune liaison sont représentés par des points. Les électrons de valence qui participent à la formation de liaisons sont appelés paires d’électrons de liaison, tandis que les électrons qui ne participent pas ou ne forment aucune liaison sont appelés paires d’électrons non liants ou paires solitaires.
Et pour dessiner la structure de Lewis de SF4, nous devons d’abord connaître le nombre total d’électrons de valence dans cette molécule.
Comme on peut probablement le voir, il y a un atome de soufre dans ce composé et quatre atomes de fluor. Pour connaître le total des électrons de valence de ce composé, nous devons connaître les électrons de valence de ces deux atomes individuellement.
- Electrons de valence du soufre : 6
- Electrons de valence du fluor : 4* (7)
( comme il y a quatre atomes de fluor, nous devons considérer les électrons de valence de tous les atomes)
Nombre total d’électrons de valence dans SF4 = nombre d’électrons de valence du soufre + nombre d’électrons de valence du fluor
= 6 + 28
= 34 électrons de valence
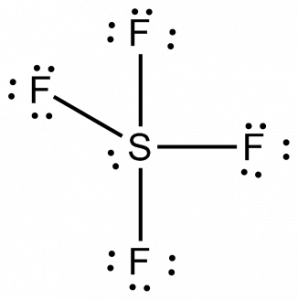
Maintenant que nous connaissons le nombre total d’électrons de valence, il deviendrait facile pour nous de comprendre la formation des liens entre les atomes et l’arrangement complet de la molécule aussi.
Le soufre sera l’atome central de cette molécule car il est le moins électronégatif, avec quatre atomes de fluor formant des liaisons sur les côtés de cet atome central. Chaque atome de fluor formera une liaison avec l’atome central, ce qui signifie qu’il y aura quatre liaisons dans la structure de la molécule utilisant quatre électrons de valence des atomes de fluor et 4 électrons de l’atome de soufre. Donc maintenant, huit électrons de valence sont utilisés, ce qui réduit le nombre d’électrons de valence de 34 à 24. Tous les atomes de fluor ont six électrons de valence, et l’atome central a deux électrons de valence.
Dessinez des lignes entre S et F pour montrer les liaisons et pour les paires d’électrons solitaires, utilisez des points. Chaque atome de fluor aura trois paires de 6 électrons de valence ( représentés par des points) sur l’atome, ainsi qu’une liaison avec le soufre. En revanche, l’atome central aura deux électrons de valence et quatre liaisons.
Donc, l’atome central, le soufre, aura une paire d’électrons solitaires et quatre paires d’électrons de liaison dans la structure de Lewis de SF4. En même temps, chaque atome de fluor aura trois paires solitaires.
Le SF4 est-il polaire ?
Une fois que l’on connaît la structure de Lewis et la géométrie moléculaire du composé donné, il devient plus facile de représenter la polarité de la molécule. Ici, une paire solitaire sur l’atome central de soufre et quatre paires d’électrons de liaison conduisent à la distribution asymétrique des électrons sur l’atome central.
De plus, comme la forme de la molécule est comme une balançoire, deux atomes de fluor peuvent annuler le moment dipolaire de chacun, mais les deux autres ne le peuvent pas à cause de l’arrangement des électrons. Et comme les atomes de fluor sont plus électronégatifs que les atomes de soufre, il en résulte une distribution inégale de la charge. Le moment dipolaire n’est donc pas annulé, ce qui rend la molécule polaire. Donc oui, le SF4 est polaire.
Hybridation du SF4
Pour connaître l’hybridation de la molécule de SF4, regardons d’abord les régions de densité électronique pour l’atome central.
Le soufre possède quatre paires d’électrons de liaison et une paire solitaire, ce qui fait que son nombre total de régions de densité électronique est de 5. Par conséquent, l’atome de soufre utilise cinq orbitales hybridées, une orbitale 3s, trois orbitales 3p et une orbitale 3d. Cette disposition des électrons autour de l’atome et des orbitales hybridées conduit à l’hybridation sp3d. On peut aussi utiliser le nombre stérique pour connaître l’hybridation ; ici, le nombre stérique est de 5 pour l’atome de soufre.
Donc SF4 a une hybridation sp3d.
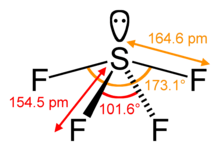
SF4 Angles et forme des liaisons
L’atome de soufre central forme quatre liaisons avec les atomes de fluor voisins et possède une paire d’électrons solitaires. Les atomes de fluor sur les positions équatoriales ont les angles de liaison de 102 degrés, et les axiaux ont 173 degrés, qui sont un peu différents de la géométrie moléculaire bipyramidale trigonale conduisant à une forme de see-saw.
La paire solitaire sur l’atome central conduit au changement des angles de liaison de 120 degrés à 102 degrés pour les atomes de fluor équatoriaux et 173 degrés au lieu de 180 degrés pour les atomes de fluor axiaux.
Marques finales
Pour conclure toutes les propriétés, nous pouvons dire que,
- Le tétrafluorure de soufre possède 34 électrons de valence, parmi lesquels il forme quatre liaisons covalentes et une paire d’électrons solitaires sur l’atome central dans sa structure de Lewis.
- Il y a trois paires solitaires sur chaque atome de fluor.
- Il a une géométrie moléculaire de formule AX4E ; il forme une forme en scie et a une géométrie moléculaire bipyramidale trigonale.
- Le SF4 a une hybridation sp3d et est de nature polaire.