15 février 2010 (Vol. 30, n°4)
Scott B. Mohler
Étapes simples pour réussir l’imagerie animale par bioluminescence
La luciférine est le substrat de base des tests de bioluminescence. Basée sur une réaction simple où l’ATP alimente la catalyse par la luciférase de la luciférine de la luciole (coléoptère) pour produire de la lumière, la bioluminescence a de larges applications. Son emploi comme indicateur de biomasse permet de détecter les micro-organismes dans les produits de consommation, les surfaces des usines de fabrication, et a même été utilisé pour déterminer si la vie existe sur la lune et sur Mars.
La bioluminescence est utilisée dans la surveillance in vitro et in vivo des processus biologiques, y compris l’expression des gènes et les interactions protéine-protéine. La luciférine est utilisée, par exemple, dans les essais de gènes rapporteurs pour étudier la régulation et la fonction des gènes où l’expression du rapporteur marqué à la luciférine est un marqueur pour indiquer la réussite de l’assimilation du gène d’intérêt dans les techniques de recombinaison de l’ADN. En tant que réactif de détection, la réaction luciférine-luciférase est utilisée dans le pyroséquençage pour accomplir une détection rapide des bases dans les systèmes actuels de séquençage de l’ADN à haut débit.
Plus récemment, l’imagerie par bioluminescence est apparue comme une technique puissante pour l’étude directe de différentes populations cellulaires chez de petits animaux vivants tels que les souris. Dans cette technique, les cellules (par exemple, les cellules cancéreuses, les cellules souches, les cellules T) sont conçues pour exprimer la luciférase et s’éclairer. La visualisation non invasive chez des animaux vivants à l’aide d’une caméra sensible à dispositif à couplage de charge permet ainsi d’observer en temps réel la progression et la régression de la maladie à différents moments au cours du traitement thérapeutique. Employée pour comprendre la base moléculaire de pathologies telles que les troubles neurodégénératifs, les troubles cardiovasculaires, l’obésité et le cancer, cette technique est d’une immense valeur pour la clinique, le diagnostic et le développement de médicaments.
Les scientifiques de Regis Technologies ont identifié les faiblesses communes des tests de luciférase. Les problèmes surviennent souvent avant le début du test. La luciférine Firefly est une molécule sensible, et même des expériences bien planifiées peuvent donner des résultats erronés si la luciférine est mal manipulée et endommagée avant son utilisation. Dans cet article, nous décrivons le sel optimal, la pureté, la manipulation et le stockage de la luciférine pour assurer des résultats réussis et cohérents dans l’imagerie animale et d’autres essais.
Préoccupations d’achat
Les chercheurs se demandent souvent quelle forme de luciférine utiliser. Les sels de potassium et de sodium de la luciférine sont généralement utilisés de manière interchangeable. Cependant, la dissolution de la molécule est un facteur important à prendre en compte pour certains dosages. Le sel de sodium est plus soluble dans l’eau (>100 mg/mL) que le sel de potassium (55 mg/mL). La forme acide libre, bien qu’encore disponible, n’est pas souvent utilisée en raison de sa difficulté de dissolution.
Parce que quelques impuretés peuvent avoir un impact sur les expériences de différentes manières, la pureté initiale du réactif peut être une considération importante.
L-luciférine, un énantiomère de la D-luciférine (Figure 1), est une impureté connue dans la luciférine synthétique. Bien qu’il soit démontré qu’elle fonctionne dans les réactions de luciférase, un décalage significatif du pic d’émission de lumière est susceptible de se produire en fonction des paramètres de collecte de données utilisés. La L-luciférine est facilement détectée et quantifiée par HPLC chirale et doit être indiquée sur le certificat d’analyse du fabricant. La plupart des luciférines devraient contenir moins de 0,5 % de L-luciférine, bien que des limites plus élevées puissent probablement être tolérées tant que les niveaux de L-luciférine restent constants tout au long de l’expérience.
La déhydroluciférine (figure 1) est une impureté qui agit comme un inhibiteur de la luciférase, supprimant la hauteur du flash et l’intégration totale. Un échantillon dopé avec 1% de déhydroluciférine montre moins de la moitié de la hauteur du flash et moins de 25% de l’intégration totale sur 15 minutes. La déhydroluciférine peut se former pendant la synthèse ou le stockage de la luciférine. La sélection d’un fabricant qui fournit de faibles niveaux de déhydroluciférine aidera à assurer des résultats fiables et reproductibles.
De nombreuses impuretés communes à l’état de traces provenant de la synthèse de la luciférine peuvent inhiber d’autres enzymes dans des systèmes complexes et peuvent entraîner une variabilité expérimentale due à des différences de lot à lot ou de fabricant à fabricant.
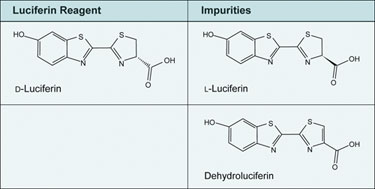
Figure 1. Comparaison structurelle de la D-luciférine et des impuretés
Stockage
Luciférine de feu est sensible à la lumière, à l’oxygène et à l’humidité et doit être protégée. La lumière et l’oxygène peuvent catalyser l’oxydation de la luciférine en déhydroluciférine. Laissée dans une bouteille ambrée sous azote à température ambiante, la luciférine commencera à se décomposer en déhydroluciférine au bout d’un mois (figure 2), mais elle est stable dans une bouteille non ouverte pendant au moins deux ans dans un congélateur. Dissoute dans l’eau avec suffisamment d’oxygène, la luciférine se transformera en déhydroluciférine en quelques jours seulement.
La luciférine doit être achetée et stockée dans la plus petite quantité possible pour éviter la décomposition en déhydroluciférine par de multiples cycles de congélation-décongélation-ouverture. Si elle est achetée en vrac, la division du réactif luciférine en flacons ambrés à usage unique permettra d’en assurer la stabilité. Le stockage à long terme sous forme de solution congelée n’est pas recommandé pour les applications sensibles telles que les études sur des animaux entiers. Pour aider à ralentir la décomposition dans les solutions congelées, faire un barbotage de la solution avec de l’azote ou de l’argon avant la congélation.

Figure 2. Décomposition de la luciférine en déhydroluciférine en fonction du temps à 25ºC et -20ºC
Manipulation
Lorsque le flacon de luciférine est ouvert, il faut le laisser revenir complètement à la température ambiante, puis le purger à l’azote ou à l’argon avant de le refermer. Si les solutions de luciférine doivent être utilisées dans les heures qui suivent, peu de précautions sont nécessaires. Les solutions qui seront utilisées pendant une journée doivent être purgées à l’azote ou à l’argon. Les solutions ne doivent pas être utilisées sur plusieurs jours, car il y aura formation de déshydroluciférine.
Scott B. Mohler ([email protected]) est chef de produit chez Regis Technologies. Site web : www.registech.com.