Par Alyssa Cecchetelli et Lukas Morgan
Les organismes modèles sont des outils essentiels utilisés par les chercheurs du monde entier. Ces organismes partagent de nombreux gènes avec les humains, sont facilement maintenus en laboratoire et ont des temps de génération courts qui facilitent l’étude des effets des manipulations génétiques. Dans ce billet de blog, nous couvrirons cinq organismes modèles populaires, mais il en existe beaucoup d’autres.
La souris domestique (Mus musculus)
 Débutons par l’organisme modèle mammalien le plus préféré de nombreux chercheurs : la souris (Mus musculus). La souris présente de nombreux avantages en tant qu’organisme modèle de mammifère pour les scientifiques, car elle a un temps de génération relativement court pour les mammifères – le temps entre la naissance et la mise bas – d’environ 10 semaines. Les souris adultes se reproduisent aussi souvent que toutes les trois semaines, de sorte que les scientifiques peuvent observer simultanément plusieurs générations de souris à la fois.
Débutons par l’organisme modèle mammalien le plus préféré de nombreux chercheurs : la souris (Mus musculus). La souris présente de nombreux avantages en tant qu’organisme modèle de mammifère pour les scientifiques, car elle a un temps de génération relativement court pour les mammifères – le temps entre la naissance et la mise bas – d’environ 10 semaines. Les souris adultes se reproduisent aussi souvent que toutes les trois semaines, de sorte que les scientifiques peuvent observer simultanément plusieurs générations de souris à la fois.
Parce que les souris sont plus semblables génétiquement et physiologiquement aux humains que de nombreux autres organismes modèles, elles sont souvent utilisées pour étudier les maladies humaines. Les maladies chez les souris présentent de nombreux phénotypes similaires aux maladies humaines et ont aidé avec succès les chercheurs à développer une variété de thérapies. Par exemple, de nombreux scientifiques utilisent des souris pour étudier des maladies telles que le cancer, car les souris reproduisent mieux les interactions complexes entre les cellules cancéreuses, les médicaments thérapeutiques et le reste de l’organisme que les études menées sur d’autres organismes modèles ou sur des cultures cellulaires. Par exemple, le laboratoire de Scott Lowe a utilisé des souris pour étudier l’impact de différentes mutations dans la leucémie sur différents régimes de traitement (Zuber et al., 2009). En injectant à des souris des vecteurs rétroviraux hébergeant différentes mutations présentes dans la leucémie, le laboratoire de Lowe a pu identifier un ensemble de mutations qui rendaient les cellules cancéreuses plus résistantes à la chimiothérapie. Vous pouvez trouver ces plasmides chez Addgene.
Un autre avantage des souris comme organismes modèles est qu’elles sont génétiquement tractables. Les souris peuvent être facilement manipulées avec des outils comme CRISPR pour faire des lignées transgéniques.
La mouche à fruits (Drosophila melanogaster)
 Un autre organisme modèle populaire est Drosophila melanogaster, ou comme il est plus communément appelé : la mouche à fruits. La mouche à fruits est utilisée dans la recherche scientifique depuis plus d’un siècle, mais elle a été mise au premier plan par Thomas Hunt Morgan, qui est connu comme le « père » de la recherche sur la drosophile. Morgan a découvert que les gènes se trouvaient dans les chromosomes en utilisant la mouche à fruits bien avant que nous sachions même que l’ADN était du matériel génétique (Jennings, 2011).
Un autre organisme modèle populaire est Drosophila melanogaster, ou comme il est plus communément appelé : la mouche à fruits. La mouche à fruits est utilisée dans la recherche scientifique depuis plus d’un siècle, mais elle a été mise au premier plan par Thomas Hunt Morgan, qui est connu comme le « père » de la recherche sur la drosophile. Morgan a découvert que les gènes se trouvaient dans les chromosomes en utilisant la mouche à fruits bien avant que nous sachions même que l’ADN était du matériel génétique (Jennings, 2011).
La mouche à fruits constitue un excellent organisme modèle car elle est facile et peu coûteuse à cultiver et à entretenir en laboratoire, elle a un cycle de vie court de 8 à 14 jours et produit un grand nombre de descendants qui sont pondus à l’extérieur. Les mouches à fruits sont également relativement simples à manipuler génétiquement. Les scientifiques peuvent créer une nouvelle lignée de mouches en seulement 6 semaines, alors qu’il faut des mois pour créer une lignée de souris transgéniques. Au fil des ans, la mouche est devenue un organisme modèle idéal pour étudier toute une série de sujets, notamment le développement, la génétique et le système nerveux. La mouche est également apparue comme un important modèle de maladie humaine avec un potentiel pour la découverte de médicaments thérapeutiques, car on estime que 75% des gènes responsables de maladies chez l’homme ont un homologue fonctionnel chez la mouche (Pandey et Nichols, 2011).
Un énorme avantage de l’utilisation de la mouche à fruits est l’éventail d’outils génétiques, tels que le système GAL4/UAS et LexA, qui permet aux scientifiques de contrôler facilement le niveau et l’expression spatio-temporelle d’un gène d’intérêt. Ce type de contrôle de l’expression des gènes est possible dans d’autres systèmes modèles, mais peut être assez difficile et prendre beaucoup de temps. Le système GAL4/UAS a été décrit pour la première fois en 1993 par le laboratoire de Norbert Perrimon et a été constamment amélioré depuis lors. Si vous êtes intéressé par ces systèmes, consultez le laboratoire de Gerald Rubin qui a créé un ensemble de vecteurs modulaires qui peuvent être utilisés pour contrôler de manière optimale l’expression des gènes dans des cellules spécifiques de la mouche (Pfeiffer et al., 2010).
Yeast (Saccharomyces cerevisiae)
 Yeast, l’un des organismes eucaryotes les plus simples, est un organisme modèle couramment utilisé dans la recherche scientifique. Oui, la même que celle que nous utilisons dans les pains et autres produits de boulangerie ! La levure est bon marché, simple et facile à travailler car elle peut survivre dans diverses conditions environnementales et se dédoubler toutes les deux heures. La levure est également le premier génome eucaryote à être entièrement séquencé et se prête très bien à la manipulation génétique.
Yeast, l’un des organismes eucaryotes les plus simples, est un organisme modèle couramment utilisé dans la recherche scientifique. Oui, la même que celle que nous utilisons dans les pains et autres produits de boulangerie ! La levure est bon marché, simple et facile à travailler car elle peut survivre dans diverses conditions environnementales et se dédoubler toutes les deux heures. La levure est également le premier génome eucaryote à être entièrement séquencé et se prête très bien à la manipulation génétique.
Les cellules de levure sont d’excellents organismes modèles non seulement pour les raisons ci-dessus, mais aussi parce qu’elles partagent en fait de nombreuses propriétés et processus biologiques avec nos propres cellules. Comme les cellules humaines, l’ADN de la levure est emballé dans des chromosomes et environ 23% des gènes de la levure ont un homologue chez l’homme (Liu et al., 2017) . Ainsi, la levure peut être utilisée pour étudier la base moléculaire des maladies humaines qui sont causées par un gène spécifique. Par exemple, plusieurs gènes mutés dans les cancers humains ont un homologue impliqué dans la division cellulaire chez la levure (Pray, 2008). Les découvertes scientifiques dans la levure peuvent ensuite être étudiées plus en profondeur dans d’autres organismes modèles qui récapitulent mieux les conditions in vivo similaires à celles des humains.
Par exemple, en raison de leur simplicité, les levures sont devenues un modèle expérimental important dans l’étude des maladies neurologiques, comme la maladie de Parkinson (PD). La MP est principalement caractérisée par un mauvais repliement des protéines qui entraîne une accumulation d’agrégats de protéines appelés « corps de Lewy » dans le cerveau. Les modèles de levure de la MP, comme ceux qui surexpriment la protéine toxique α-synucléine (la protéine la plus courante dans les corps de Lewy), ont été d’une valeur inestimable pour comprendre les mécanismes moléculaires fondamentaux qui sous-tendent la maladie (Menezes et al., 2015). Les levures étant des organismes unicellulaires, elles peuvent également être utilisées pour cribler facilement plusieurs composés thérapeutiques en une seule expérience.
Le poisson zèbre (Danio rerio)
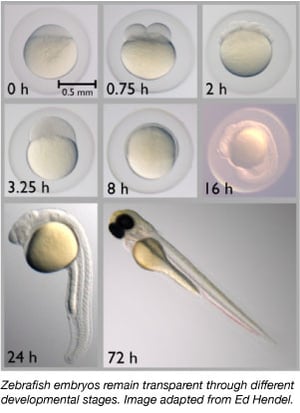 Depuis les années 1960, le poisson zèbre est progressivement devenu un organisme modèle important. Il partage environ 70 % de ses gènes avec l’homme et 85 % des gènes humains associés à une maladie ont un homologue chez le poisson zèbre (Howe et al., 2013). Le poisson zèbre est petit, facile à entretenir car il est hébergé en grands groupes, facile à élever et produit 50 à 300 œufs à la fois. Les embryons de poisson zèbre sont également pondus et fécondés en externe, ce qui permet aux scientifiques de les manipuler facilement. Les scientifiques peuvent simplement injecter aux embryons unicellulaires de l’ADN ou de l’ARN pour modifier leur génome ou créer des animaux transgéniques.
Depuis les années 1960, le poisson zèbre est progressivement devenu un organisme modèle important. Il partage environ 70 % de ses gènes avec l’homme et 85 % des gènes humains associés à une maladie ont un homologue chez le poisson zèbre (Howe et al., 2013). Le poisson zèbre est petit, facile à entretenir car il est hébergé en grands groupes, facile à élever et produit 50 à 300 œufs à la fois. Les embryons de poisson zèbre sont également pondus et fécondés en externe, ce qui permet aux scientifiques de les manipuler facilement. Les scientifiques peuvent simplement injecter aux embryons unicellulaires de l’ADN ou de l’ARN pour modifier leur génome ou créer des animaux transgéniques.
Le poisson zèbre est un organisme modèle idéal pour les études sur le développement embryonnaire car ses embryons sont complètement transparents. Ainsi, les scientifiques peuvent facilement observer les premiers stades du développement, ce qui peut être difficile chez d’autres espèces de vertébrés. La transparence permet également aux scientifiques d’observer facilement les protéines et les tissus marqués par fluorescence pour mieux évaluer les processus de développement.
Par exemple, le laboratoire de Stainier a étudié la prolifération et la différenciation des cellules β dans le pancréas du poisson zèbre en développement. Ils ont d’abord marqué ces cellules à l’aide de plasmides. Puis, à l’aide de HOTcre, une méthode qui utilise l’induction thermique pour contrôler l’expression temporelle de différents transgènes, le groupe de Stainier a déterminé qu’il existe en fait deux populations distinctes de cellules β qui proviennent de différentes régions du pancréas et produisent différents niveaux d’insuline (Hesselson et al, 2009).
Le ver (Caenorhabditis elegans)
 Le ver, Caenorhabditis elegans, a été largement utilisé comme organisme modèle depuis les années 1970 lorsque Sydney Brenner l’a introduit dans son laboratoire pour étudier le développement neuronal (Brenner, 1973). Les C. elegans sont de petits vers transparents qui ont un cycle de vie rapide et des couvées de grande taille. La majorité des C. elegans sont également des hermaphrodites auto-fertiles, ce qui facilite la réalisation de grandes expériences sur plusieurs générations. De même que d’autres organismes modèles, le génome de C. elegans est également complètement séquencé et plus de 60 % des gènes humains ont un orthologue chez C. elegans, ce qui en fait un organisme idéal pour étudier les processus de base de la biologie moléculaire.
Le ver, Caenorhabditis elegans, a été largement utilisé comme organisme modèle depuis les années 1970 lorsque Sydney Brenner l’a introduit dans son laboratoire pour étudier le développement neuronal (Brenner, 1973). Les C. elegans sont de petits vers transparents qui ont un cycle de vie rapide et des couvées de grande taille. La majorité des C. elegans sont également des hermaphrodites auto-fertiles, ce qui facilite la réalisation de grandes expériences sur plusieurs générations. De même que d’autres organismes modèles, le génome de C. elegans est également complètement séquencé et plus de 60 % des gènes humains ont un orthologue chez C. elegans, ce qui en fait un organisme idéal pour étudier les processus de base de la biologie moléculaire.
Les C. elegans se prêtent également assez bien à la manipulation génétique. Des animaux transgéniques peuvent être fabriqués par simple micro-injection d’ADN dans le ver, comme les animaux qui expriment des marqueurs fluorescents (Mello et al., 1991). Les gènes peuvent également être facilement éliminés par interférence ARN (ARNi) en nourrissant le ver avec des bactéries exprimant des plasmides spécifiques (L4440) qui contiennent le gène qui vous intéresse (Fire et al., 1998). La découverte de l’ARNi chez le ver a d’ailleurs valu aux déposants Andrew Fire et Craig Mello un prix Nobel en 2006.
L’un des avantages majeurs des C. elegans est qu’ils sont transparents tout au long de leur vie. Ainsi, toute modification génétique, comme l’expression d’une protéine fluorescente ou la perturbation d’un gène, peut être facilement visualisée dans un organisme vivant, du développement embryonnaire à l’âge adulte. Cette capacité à manipuler génétiquement et à visualiser les cellules et les tissus permet aux scientifiques de mener des études in vivo, ce qui peut être assez difficile avec d’autres organismes modèles. Les vers ont été utilisés pour étudier toute une série de systèmes et de processus biologiques, notamment le système nerveux, le développement, la signalisation cellulaire, le vieillissement et la mécanotransduction, pour n’en citer que quelques-uns. Par exemple, le laboratoire d’Andrew Leifer a utilisé le ver pour étudier la signalisation calcique dans l’ensemble du cerveau adulte, en utilisant un plasmide qui exprime un capteur de calcium génétiquement codé, GCaMP6 (Nguyen et al., 2015). Si vous êtes intéressé par les plasmides et les ressources de C. elegans, consultez la page d’expression des vers d’Addgene.
Vous cherchez d’autres organismes modèles ? Consultez la deuxième partie de la série populaire sur les organismes modèles, et lisez sur les nouveaux systèmes en cours de développement pour les organismes modèles émergents !
Brenner, Sydney. « La génétique de Caenorhabditis elegans ». Genetics 77.1 (1974) : 71-94. PubMed Central PMCID : PMC1213120.
Hesselson, Daniel, et al. « Des populations distinctes de cellules β pancréatiques quiescentes et prolifératives identifiées par un marquage médié par HOTcre. » Proceedings of the National Academy of Sciences 106.35 (2009) : 14896-14901. PubMed PMID : 19706417. PubMed Central PMCID : PMC2736433.
Howe, Kerstin, et al. « La séquence du génome de référence du poisson zèbre et sa relation avec le génome humain. » Nature496.7446 (2013) : 498. PubMed PMID : 23594743. PubMed Central PMCID : PMC3703927.
Jennings, Barbara H. « Drosophila-a versatile model in biology & medicine. » Matériaux aujourd’hui 14.5 (2011) : 190-195.
Mello, Craig C., et al. « Efficient gene transfer in C. elegans : extrachromosomal maintenance and integration of transforming sequences. » The EMBO journal 10.12 (1991) : 3959-3970. PubMed PMID : 1935914. PubMed Central PMCID : PMC453137.
Nguyen, Jeffrey P., et al. « Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans ». Actes de l’Académie nationale des sciences 113.8 (2016) : E1074-E1081. PubMed PMID : 26712014.
Pandey, Udai Bhan, et Charles D. Nichols. « Les modèles de maladies humaines chez Drosophila melanogaster et le rôle de la mouche dans la découverte de médicaments thérapeutiques ». Pharmacological reviews 63.2 (2011) : 411-436. PubMed PMID : 21415126. PubMed Central PMCID : PMC3082451.