La sulfonation du méthylbenzène
Le méthylbenzène est plus réactif que le benzène à cause de la tendance du groupe méthyle à « pousser » les électrons vers le cycle.
L’effet de cette plus grande réactivité est que le méthylbenzène réagira avec l’acide sulfurique fumant à 0°C, et avec l’acide sulfurique concentré s’ils sont chauffés à reflux pendant environ 5 minutes.
En plus de l’effet sur la vitesse de réaction, avec le méthylbenzène, vous devez également penser à l’endroit où le groupe acide sulfonique se retrouve sur le cycle par rapport au groupe méthyle. Les groupes méthyle ont tendance à « diriger » de nouveaux groupes vers les positions 2 et 4 du cycle (en supposant que le groupe méthyle soit en position 1). On dit des groupes méthyles qu’ils sont 2,4-directeurs.
On obtient donc un mélange qui se compose principalement de deux isomères. Il ne se forme qu’environ 5 à 10% de l’isomère 3. Les principales réactions sont :
![]()
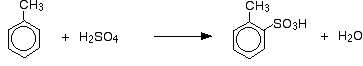
et :
![]()
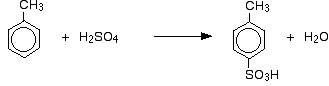
Dans le cas de la sulfonation, la proportion exacte des isomères formés dépend de la température de la réaction. Lorsque la température augmente, on obtient des proportions croissantes de l’isomère 4 et moins de l’isomère 2. Ceci est dû au fait que la sulfonation est réversible. Le groupe acide sulfonique peut à nouveau se détacher du cycle et se rattacher ailleurs. Cela tend à favoriser la formation de l’isomère le plus stable sur le plan thermodynamique. Cet échange se produit davantage à des températures plus élevées.
L’isomère 4 est plus stable car il n’y a pas d’encombrement dans la molécule comme ce serait le cas si le groupe méthyle et le groupe acide sulfonique étaient voisins.