Atomes et or
En 1911, Rutherford et ses collègues Hans Geiger et Ernest Marsden ont lancé une série d’expériences révolutionnaires qui allaient complètement changer le modèle accepté de l’atome. Ils ont bombardé de très fines feuilles d’or avec des particules alpha se déplaçant rapidement.

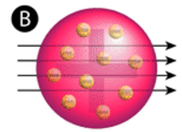

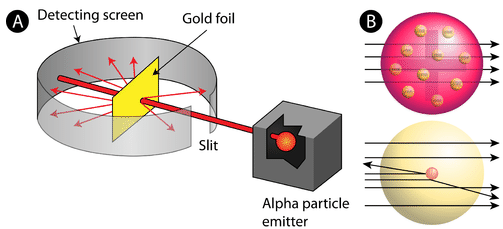
Figure \(\PageIndex{2}\) (A) Le dispositif expérimental pour l’expérience de la feuille d’or de Rutherford : Un élément radioactif qui émet des particules alpha est dirigé vers une fine feuille d’or entourée d’un écran qui permet de détecter les particules déviées. (B) Selon le modèle du plum-pudding (en haut), toutes les particules alpha auraient dû traverser la feuille d’or avec peu ou pas de déviation. Rutherford a constaté qu’un petit pourcentage de particules alpha étaient déviées à de grands angles, ce qui pourrait s’expliquer par un atome avec un noyau très petit, dense et chargé positivement en son centre (en bas).
Selon le modèle atomique accepté, dans lequel la masse et la charge d’un atome sont uniformément distribuées dans tout l’atome, les scientifiques s’attendaient à ce que toutes les particules alpha passent à travers la feuille d’or avec seulement une légère déviation ou pas du tout. Étonnamment, comme le montre la figure \(\PageIndex{2}\) (alors que la plupart des particules alpha n’étaient effectivement pas déviées, un très faible pourcentage (environ 1 particule sur 8000) a rebondi sur la feuille d’or à des angles très importants. Certaines ont même été redirigées vers la source. Aucune connaissance préalable ne les avait préparés à cette découverte. Dans une citation célèbre, Rutherford s’est exclamé que c’était « comme si vous aviez tiré un obus de 15 pouces sur un morceau de tissu et qu’il revenait vous frapper ».
Rutherford a dû proposer un modèle entièrement nouveau de l’atome pour expliquer ses résultats. Comme la grande majorité des particules alpha avaient traversé l’or, il a raisonné que la majeure partie de l’atome était un espace vide. En revanche, les particules qui ont été fortement déviées ont dû être soumises à une force extrêmement puissante au sein de l’atome. Il en a conclu que toute la charge positive et la majorité de la masse de l’atome devaient être concentrées dans un très petit espace à l’intérieur de l’atome, qu’il a appelé le noyau. Le noyau est le minuscule noyau central et dense de l’atome et est composé de protons et de neutrons.
Le modèle atomique de Rutherford est devenu connu sous le nom de modèle nucléaire. Dans l’atome nucléaire, les protons et les neutrons, qui constituent presque toute la masse de l’atome, sont situés dans le noyau au centre de l’atome. Les électrons sont répartis autour du noyau et occupent la majeure partie du volume de l’atome. Il convient de souligner à quel point le noyau est petit par rapport au reste de l’atome. Si nous pouvions faire exploser un atome pour qu’il ait la taille d’un grand stade de football professionnel, le noyau aurait la taille d’une bille.
Le modèle de Rutherford s’est avéré être une étape importante vers une compréhension complète de l’atome. Cependant, il n’abordait pas complètement la nature des électrons et la façon dont ils occupaient le vaste espace autour du noyau. Pour cette découverte et d’autres, Rutherford a reçu le prix Nobel de chimie en 1908. Malheureusement, Rutherford aurait préféré recevoir le prix Nobel de physique, car il considérait que la physique était supérieure à la chimie. Selon lui, « toute science est soit de la physique, soit une collection de timbres. »