La chimie nous aide à comprendre les propriétés et la composition du monde qui nous entoure. Vous apprendrez ici les états de la matière, ainsi que beaucoup de choses sur un état en particulier (trois devinettes – ce n’est ni solide ni liquide…).
Les états de la matière
Selon la température, la pression et les propriétés d’une substance, celle-ci peut prendre différentes formes physiques. Nous appelons ces formes physiques des états de la matière. Il existe trois états de la matière très bien connus : les solides, les liquides et les gaz. D’autres états de la matière existent également. Il s’agit notamment du Plasma (un état de la matière similaire à un gaz, mais qui contient des électrons et des ions en mouvement libre – des atomes qui ont perdu des électrons) et des condensats de Bose-Einstein (BEC) (des ondes de matière qui peuvent se produire avec certains types d’atomes à des températures super froides).
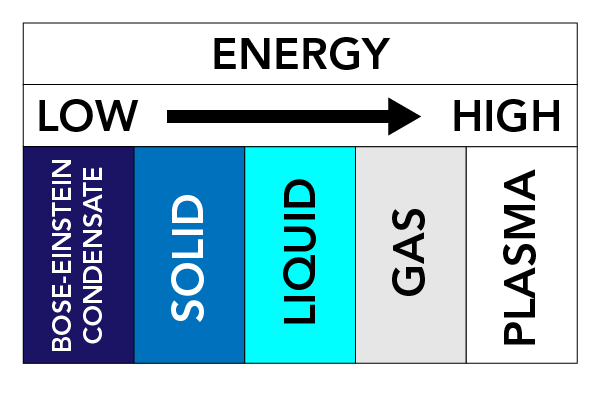
Les forces entre les particules et la pression sur les particules maintiennent les particules ensemble. Si nous réchauffons la matière (ajoutons de l’énergie), les particules commencent à se déplacer plus rapidement et ont tendance à s’écarter. Ce mouvement des particules a un grand effet sur l’état d’une substance.
Solides
Dans les solides, les forces qui maintiennent les particules ensemble sont relativement fortes, et les particules restent très proches les unes des autres. Les particules peuvent vibrer mais elles ne se déplacent pas beaucoup. C’est pourquoi les solides sont durs et rigides. Laissés à eux-mêmes, les solides gardent leur forme.
Liquides
Dans les liquides, les forces entre les particules sont plus faibles que dans les solides. Les particules sont encore assez proches les unes des autres, mais peuvent se déplacer librement. Les liquides peuvent s’écouler à l’intérieur d’un récipient et n’ont pas de forme fixe particulière.
Gaz
Les gaz sont difficiles à appréhender car ils sont souvent invisibles, mais présents partout. Vous pouvez les sentir quand, par exemple, le vent souffle. On peut parfois les sentir quand, par exemple, on sent l’odeur d’un aliment qui cuit, ou quand un putois a été contrarié. Certains gaz sont importants pour notre santé (par exemple, l’oxygène) tandis que d’autres peuvent être mortels (par exemple, le sulfure d’hydrogène et le chlore). Avant une opération, vous pouvez recevoir un gaz anesthésiant, qui contient des produits chimiques, pour soulager la douleur et vous rendre inconscient pendant l’intervention. Les gaz sont également responsables de la force des explosions. Examinons de plus près les gaz.
Types de gaz
Il existe des gaz élémentaires (constitués d’un seul élément) et des gaz qui sont des composés (constitués de plus d’un élément). Les symboles des gaz élémentaires peuvent être trouvés dans n’importe quel tableau périodique des éléments. Ils sont résumés dans le tableau ci-dessous.
Gaz diatomique |
Formule chimique |
Gaz monatomique |
. Gaz |
Formule chimique |
|
Hydrogène |
H2 |
Hélium |
He |
|
|
Oxygène |
O2 |
Néon |
Ne |
|
|
Nitrogène |
N2 |
Argon |
Ar |
|
|
Fluor |
F2 |
Krypton |
Kr |
|
|
Chlore |
Cl2 |
Xénon |
Xe |
Un gaz diatomique est un gaz dont l’unité de base est une molécule constituée de deux atomes réunis. Un gaz monatomique est un gaz dont l’unité de base est un seul atome. La plupart des gaz, cependant, sont des composés constitués de deux ou plusieurs éléments différents unis chimiquement. Le plus courant est la vapeur d’eau, H2O. Voici les noms, les formules et les utilisations de certains gaz composés :
Nom commun |
Formule chimique |
Lieu où on le trouve normalement |
. normalement le trouver |
|
Dioxyde de carbone |
CO2 |
Atmosphère, gaz d’échappement des voitures, pop, nos poumons |
|
|
Propane |
C3H8 |
BBQ, réchauds de camping, carburant pour certains véhicules |
|
|
Méthane |
CH4 |
Composant des gaz à effet de serre et du gaz naturel |
|
|
Ammonia |
NH3 |
Utilisé pour fabriquer des engrais, produits de nettoyage |
.