Alyssa Cecchetelli ja Lukas Morgan
Malliorganismit ovat elintärkeitä työkaluja, joita tutkijat käyttävät kaikkialla maailmassa. Näillä organismeilla on monia yhteisiä geenejä ihmisen kanssa, niitä on helppo ylläpitää laboratoriossa, ja niiden sukupolveutumisaika on lyhyt, minkä ansiosta geneettisten manipulaatioiden vaikutuksia on helppo tutkia. Tässä blogikirjoituksessa käsittelemme viittä suosittua malliorganismia, mutta niitä on paljon muitakin.
Kotihiiri (Mus musculus)
 Aloitetaan monien tutkijoiden suosimasta nisäkäsmalliorganismista: hiirestä (Mus musculus). Hiirillä on monia etuja nisäkkäiden malliorganismina tutkijoiden kannalta, sillä niiden sukupolveutumisaika on nisäkkäille suhteellisen lyhyt – syntymän ja synnytyksen välinen aika – noin 10 viikkoa. Aikuiset hiiret lisääntyvät jopa kolmen viikon välein, joten tutkijat voivat tarkkailla samanaikaisesti useita hiirisukupolvia kerrallaan.
Aloitetaan monien tutkijoiden suosimasta nisäkäsmalliorganismista: hiirestä (Mus musculus). Hiirillä on monia etuja nisäkkäiden malliorganismina tutkijoiden kannalta, sillä niiden sukupolveutumisaika on nisäkkäille suhteellisen lyhyt – syntymän ja synnytyksen välinen aika – noin 10 viikkoa. Aikuiset hiiret lisääntyvät jopa kolmen viikon välein, joten tutkijat voivat tarkkailla samanaikaisesti useita hiirisukupolvia kerrallaan.
Koska hiiret muistuttavat geneettisesti ja fysiologisesti enemmän ihmistä kuin monet muut malliorganismit, niitä käytetään usein ihmisen sairauksien tutkimiseen. Hiirillä esiintyvissä sairauksissa on monia samanlaisia fenotyyppejä kuin ihmisen sairauksissa, ja ne ovat auttaneet tutkijoita menestyksekkäästi kehittämään erilaisia hoitomuotoja. Monet tutkijat käyttävät hiiriä esimerkiksi syövän kaltaisten sairauksien tutkimiseen, koska hiiret kuvaavat paremmin syöpäsolujen, terapeuttisten lääkkeiden ja muun elimistön välisiä monimutkaisia vuorovaikutussuhteita kuin muilla malliorganismeilla tai soluviljelmillä tehdyt tutkimukset. Esimerkiksi Scott Lowen laboratorio käytti hiiriä tutkiessaan, miten leukemian eri mutaatiot vaikuttavat erilaisiin hoitomuotoihin (Zuber ym., 2009). Ruiskuttamalla hiiriin retrovirusvektoreita, jotka sisälsivät erilaisia leukemiassa esiintyviä mutaatioita, Lowen laboratorio pystyi tunnistamaan joukon mutaatioita, jotka tekivät syöpäsoluista vastustuskykyisempiä kemoterapiaa vastaan. Nämä plasmidit löytyvät Addgenestä.
Toinen hiirten etu malliorganismeina on se, että ne ovat geneettisesti käsiteltävissä. Hiiriä voidaan helposti manipuloida CRISPR:n kaltaisilla työkaluilla siirtogeenisten linjojen luomiseksi.
hedelmäkärpänen (Drosophila melanogaster)
 Toinen suosittu malliorganismi on Drosophila melanogaster, tai kuten se yleisemmin tunnetaan: hedelmäkärpänen. Hedelmäkärpästä on käytetty tieteellisessä tutkimuksessa jo yli vuosisadan ajan, mutta sen toi eturiviin Thomas Hunt Morgan, joka tunnetaan Drosophila-tutkimuksen ”isänä”. Morgan havaitsi, että geenit löytyivät kromosomeista hedelmäkärpäsen avulla paljon ennen kuin edes tiesimme, että DNA on geneettistä materiaalia (Jennings, 2011).
Toinen suosittu malliorganismi on Drosophila melanogaster, tai kuten se yleisemmin tunnetaan: hedelmäkärpänen. Hedelmäkärpästä on käytetty tieteellisessä tutkimuksessa jo yli vuosisadan ajan, mutta sen toi eturiviin Thomas Hunt Morgan, joka tunnetaan Drosophila-tutkimuksen ”isänä”. Morgan havaitsi, että geenit löytyivät kromosomeista hedelmäkärpäsen avulla paljon ennen kuin edes tiesimme, että DNA on geneettistä materiaalia (Jennings, 2011).
Hedelmäkärpänen on loistava malliorganismi, koska niitä on helppo ja edullinen kasvattaa ja ylläpitää laboratoriossa, niiden elinkaari on lyhyt, 8-14 päivää, ja ne tuottavat suuren määrän jälkeläisiä, jotka munivat ulkoisesti. Hedelmäkärpäsiä on myös suhteellisen helppo manipuloida geneettisesti. Tutkijat voivat valmistaa uuden kärpäslinjan vain 6 viikossa, kun taas siirtogeenisen hiirilinjan valmistaminen kestää kuukausia. Vuosien mittaan kärpäsestä on tullut ihanteellinen malliorganismi monien aiheiden, kuten kehityksen, genetiikan ja hermoston tutkimiseen. Kärpäsestä on tullut myös tärkeä ihmisen sairauksien malli, jolla on potentiaalia terapeuttisten lääkkeiden löytämisessä, sillä arviolta 75 prosentilla ihmisen sairauksia aiheuttavista geeneistä on toiminnallinen homologi kärpäsessä (Pandey ja Nichols, 2011).
Hedelmäkärpäsen käytön valtava etu on geneettisten työkalujen, kuten GAL4/UAS- ja LexA-järjestelmien, valikoima, jonka avulla tutkijat voivat helposti kontrolloida kiinnostavan geenin ilmentymisen tasoa ja spatiotemporaalista ilmentymistä. Tämäntyyppinen geeniekspression hallinta on mahdollista muissa mallijärjestelmissä, mutta se voi olla melko vaikeaa ja aikaa vievää. GAL4/UAS-järjestelmä kuvattiin ensimmäisen kerran vuonna 1993 Norbert Perrimonin laboratoriossa, ja sitä on kehitetty jatkuvasti siitä lähtien. Jos olet kiinnostunut näistä järjestelmistä, tutustu Gerald Rubinin laboratorioon, joka loi joukon modulaarisia vektoreita, joita voidaan käyttää geeniekspression optimaaliseen hallintaan kärpäsen tietyissä soluissa (Pfeiffer et al., 2010).
Härkäpapu (Saccharomyces cerevisiae)
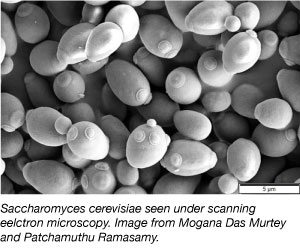 Härkäpapu, joka on yksi yksinkertaisimmista eukaryoottisista organismeista, on tieteellisessä tutkimuksessa laajalti käytetty malliorganismi. Kyllä, samaa lajia, jota käytämme leivissä ja muissa leivonnaisissa! Hiiva on halpa, yksinkertainen ja helppo työstää, sillä se voi selviytyä erilaisissa ympäristöolosuhteissa ja kaksinkertaistua kahden tunnin välein. Hiiva on myös ensimmäinen eukaryoottinen genomi, joka on sekvensoitu kokonaan, ja se on hyvin altis geneettiselle manipuloinnille.
Härkäpapu, joka on yksi yksinkertaisimmista eukaryoottisista organismeista, on tieteellisessä tutkimuksessa laajalti käytetty malliorganismi. Kyllä, samaa lajia, jota käytämme leivissä ja muissa leivonnaisissa! Hiiva on halpa, yksinkertainen ja helppo työstää, sillä se voi selviytyä erilaisissa ympäristöolosuhteissa ja kaksinkertaistua kahden tunnin välein. Hiiva on myös ensimmäinen eukaryoottinen genomi, joka on sekvensoitu kokonaan, ja se on hyvin altis geneettiselle manipuloinnille.
Hiivasolut ovat loistava malliorganismi paitsi edellä mainituista syistä myös siksi, että niillä on itse asiassa monia yhteisiä biologisia ominaisuuksia ja prosesseja omien solujemme kanssa. Ihmissolujen tavoin hiivan DNA on pakattu kromosomeihin, ja noin 23 prosentilla hiivan geeneistä on vastine ihmisessä (Liu et al., 2017) . Näin ollen hiivaa voidaan käyttää tietyn geenin aiheuttamien ihmisen sairauksien molekyyliperustan tutkimiseen. Esimerkiksi useilla ihmisen syövissä mutatoituneilla geeneillä on homologi, joka osallistuu hiivasolujen jakautumiseen (Pray, 2008). Hiivalla tehtyjä tieteellisiä löydöksiä voidaan sitten tutkia edelleen muissa malliorganismeissa, jotka toistavat paremmin ihmisen kaltaisia in vivo -olosuhteita.
Hiivasta on esimerkiksi yksinkertaisuutensa vuoksi tullut tärkeä kokeellinen malli neurologisten sairauksien, kuten Parkinsonin taudin, tutkimuksessa. Parkinsonin taudille on ensisijaisesti ominaista proteiinien vääränlainen taittuminen, joka johtaa aivoihin kertyviin proteiiniaggregaatteihin, joita kutsutaan ”lewy-kappaleiksi”. Parkinsonin taudin hiivamallit, kuten sellaiset, jotka yliekspressoivat myrkyllistä proteiinia α-synukleiinia (yleisintä lewy-kappaleissa esiintyvää proteiinia), ovat olleet korvaamattomia taudin taustalla olevien molekulaaristen perusmekanismien ymmärtämisessä (Menezes ym., 2015). Koska hiivat ovat yksisoluisia organismeja, niitä voidaan myös käyttää helposti useiden terapeuttisten yhdisteiden seulontaan yhdessä kokeessa.
Seeprakala (Danio rerio)
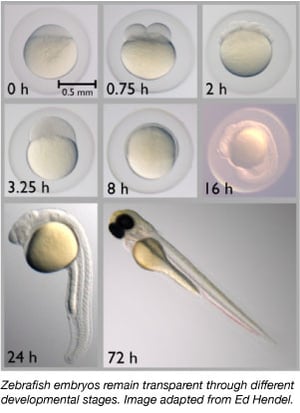 1960-luvulta lähtien seeprakalasta on vähitellen tullut tärkeä malliorganismi. Ne jakavat noin 70 % geeneistään ihmisen kanssa, ja 85 %:lla ihmisen geeneistä, jotka liittyvät johonkin sairauteen, on homologi seeprakalassa (Howe ym., 2013). Seeprakalat ovat pieniä, helposti ylläpidettäviä, koska niitä pidetään suurissa ryhmissä, ne on helppo kasvattaa ja ne tuottavat 50-300 munaa kerrallaan. Seeprakalan alkiot myös munitaan ja hedelmöitetään ulkoisesti, jolloin tutkijat voivat helposti manipuloida niitä. Tutkijat voivat yksinkertaisesti ruiskuttaa yksisoluisiin alkioihin DNA:ta tai RNA:ta muokatakseen niiden genomia tai luodakseen siirtogeenisiä eläimiä.
1960-luvulta lähtien seeprakalasta on vähitellen tullut tärkeä malliorganismi. Ne jakavat noin 70 % geeneistään ihmisen kanssa, ja 85 %:lla ihmisen geeneistä, jotka liittyvät johonkin sairauteen, on homologi seeprakalassa (Howe ym., 2013). Seeprakalat ovat pieniä, helposti ylläpidettäviä, koska niitä pidetään suurissa ryhmissä, ne on helppo kasvattaa ja ne tuottavat 50-300 munaa kerrallaan. Seeprakalan alkiot myös munitaan ja hedelmöitetään ulkoisesti, jolloin tutkijat voivat helposti manipuloida niitä. Tutkijat voivat yksinkertaisesti ruiskuttaa yksisoluisiin alkioihin DNA:ta tai RNA:ta muokatakseen niiden genomia tai luodakseen siirtogeenisiä eläimiä.
Seeprakala on ihanteellinen malliorganismi alkionkehityksen tutkimiseen, sillä sen alkiot ovat täysin läpinäkyviä. Näin tutkijat voivat helposti tarkkailla varhaisia kehitysvaiheita, mikä voi olla vaikeaa muilla selkärankaisilla lajeilla. Läpinäkyvyyden ansiosta tutkijat voivat myös helposti havainnoida fluoresoivasti leimattuja proteiineja ja kudoksia arvioidakseen paremmin kehitysprosesseja.
Stainierin laboratoriossa tutkittiin esimerkiksi β-solujen lisääntymistä ja erilaistumista kehittyvässä seeprakalan haimassa. He merkitsivät nämä solut ensin plasmidien avulla. Sen jälkeen Stainerin ryhmä käytti HOTcre-menetelmää, jossa käytetään lämpöinduktiota eri siirtogeenien ajallisen ilmentymisen kontrolloimiseksi, ja totesi, että on olemassa kaksi erillistä β-solupopulaatiota, jotka saavat alkunsa haiman eri alueilta ja tuottavat erilaista insuliinitasoa (Hesselson et al., 2009).
Mato (Caenorhabditis elegans)
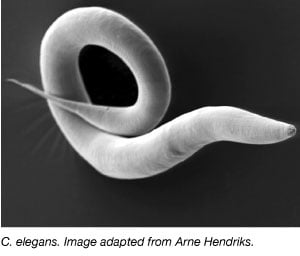 Matoa, Caenorhabditis elegansia, on käytetty laajasti malliorganismina 1970-luvulta lähtien, jolloin Sydney Brenner toi sen laboratorioonsa tutkimaan hermosolujen kehitystä (Brenner, 1973). C. elegansit ovat pieniä, läpinäkyviä matoja, joiden elinkaari on nopea ja pesäkoko suuri. Suurin osa C. eleganseista on myös itsestään hedelmöittyviä hermafrodiitteja, mikä helpottaa laajojen kokeiden tekemistä useiden sukupolvien ajan. Muiden malliorganismien tavoin myös C. elegansin genomi on sekvensoitu kokonaan, ja yli 60 prosentilla ihmisen geeneistä on ortologinsa C. elegansissa, mikä tekee siitä ihanteellisen molekyylibiologisten perusprosessien tutkimiseen.
Matoa, Caenorhabditis elegansia, on käytetty laajasti malliorganismina 1970-luvulta lähtien, jolloin Sydney Brenner toi sen laboratorioonsa tutkimaan hermosolujen kehitystä (Brenner, 1973). C. elegansit ovat pieniä, läpinäkyviä matoja, joiden elinkaari on nopea ja pesäkoko suuri. Suurin osa C. eleganseista on myös itsestään hedelmöittyviä hermafrodiitteja, mikä helpottaa laajojen kokeiden tekemistä useiden sukupolvien ajan. Muiden malliorganismien tavoin myös C. elegansin genomi on sekvensoitu kokonaan, ja yli 60 prosentilla ihmisen geeneistä on ortologinsa C. elegansissa, mikä tekee siitä ihanteellisen molekyylibiologisten perusprosessien tutkimiseen.
C. elegans on myös varsin altis geneettiselle manipuloinnille. Siirtogeenisiä eläimiä voidaan tehdä yksinkertaisesti mikroinjektoimalla matoon DNA:ta, esimerkiksi eläimiä, jotka ilmentävät fluoresoivia merkkiaineita (Mello ym., 1991). Geenejä voidaan myös helposti tyrmätä RNA-interferenssin (RNAi) avulla syöttämällä madolle bakteereja, jotka ilmentävät erityisiä plasmideja (L4440), jotka sisältävät kiinnostavan geenin (Fire et al., 1998). RNAi:n löytäminen madossa itse asiassa palkitsi tallettajat Andrew Firen ja Craig Mellon Nobel-palkinnolla vuonna 2006.
Yksi C. elegansin suurista eduista on se, että ne ovat läpinäkyviä koko elämänsä ajan. Näin ollen mikä tahansa geneettinen muutos, kuten fluoresoivan proteiinin ilmentäminen tai geenin häirintä, voidaan helposti visualisoida elävässä organismissa alkionkehityksestä aikuisuuteen. Tämä kyky geneettisesti manipuloida ja visualisoida soluja ja kudoksia antaa tutkijoille mahdollisuuden tehdä in vivo -tutkimuksia, jotka voivat olla varsin vaikeita muilla malliorganismeilla. Matoilla on tutkittu monia biologisia järjestelmiä ja prosesseja, kuten hermostoa, kehitystä, solujen signalointia, ikääntymistä ja mekanotransduktiota. Esimerkiksi Andrew Leiferin laboratorio hyödynsi matoa tutkiessaan kalsiumsignalointia koko aikuisen aivoissa käyttäen plasmidia, joka ilmentää geneettisesti koodattua kalsiumanturia GCaMP6 (Nguyen et al., 2015). Jos olet kiinnostunut C. elegansin plasmideista ja resursseista, tutustu Addgenen Worm Expression -sivuun.
Etsitkö lisää malliorganismeja? Tutustu suosittujen malliorganismien sarjan toiseen osaan ja lue uusista järjestelmistä, joita kehitetään uusille malliorganismeille!
Brenner, Sydney. ”Caenorhabditis elegansin genetiikka”. Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. ”Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling.” Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. ”The zebrafish reference genome sequence and its relationship to the human genome”. Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. ”Drosophila-a versatile model in biology & medicine.” Materials today 14.5 (2011): 190-195.
Mello, Craig C., et al. ”Tehokas geeninsiirto C. elegansissa: ekstrakromosomaalinen ylläpito ja transformoivien sekvenssien integrointi”. The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. ”Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans.” Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan ja Charles D. Nichols. ”Ihmisen tautimallit Drosophila melanogasterissa ja kärpäsen rooli terapeuttisessa lääkekeksinnössä”. Pharmacological reviews 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.
.