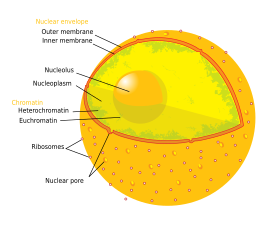
Tydin sisältää lähes koko solun DNA:n, jota ympäröi kuitumaisten välifilamenttien verkosto ja jota ympäröi kaksinkertainen kalvo, jota kutsutaan ”ydinkuoreksi”. Ydinkuori erottaa ytimen sisällä olevan nesteen, jota kutsutaan nukleoplasmaksi, muusta solusta. Ytimen koko riippuu sen sisältämän solun koosta, ja tyypillisesti ydin vie noin 8 % solun kokonaistilavuudesta. Tuma on eläinsolujen suurin organelli. 12 Nisäkässoluissa tuman keskimääräinen halkaisija on noin 6 mikrometriä (µm).
Tumakuori ja huokoset

Ydinkuori koostuu kahdesta kalvosta, sisäisestä ja ulommasta ydinkalvosta. 649 Yhdessä nämä kalvot palvelevat solun geneettisen materiaalin erottamista solun muusta sisällöstä ja mahdollistavat sen, että ydin voi ylläpitää muusta solusta erillisen ympäristön. Huolimatta siitä, että nämä kaksi kalvoa ovat tiiviisti kiinni suuressa osassa ydintä, ne eroavat toisistaan huomattavasti muodoltaan ja sisällöltään. Sisäkalvo ympäröi ytimen sisällön ja muodostaa sen määrittelevän reunan.:14 Sisäkalvoon sulautuneina erilaiset proteiinit sitovat välifilamentteja, jotka antavat ytimelle sen rakenteen.:649 Ulkokalvo sulkee sisäänsä sisäkalvon, ja se on jatkuva viereisen endoplasmisen retikulumin kalvon kanssa.:649 Osana endoplasmisen retikulumin kalvoa ulompi ydinkalvo on täynnä ribosomeja, jotka aktiivisesti kääntävät proteiineja kalvon yli.:649 Kahden kalvon välinen tila, jota kutsutaan ”perinukleaariseksi tilaksi”, on jatkuva endoplasmisen retikulumin luumenin kanssa.:649
Tydinhuokoset, jotka muodostavat vesikanavia kuoren läpi, koostuvat useista proteiineista, joita kutsutaan yhteisesti nukleoporiineiksi. Huokosten molekyylipaino on noin 60-80 miljoonaa daltonia, ja ne koostuvat noin 50:stä (hiivassa) useisiin satoihin proteiineihin (selkärankaisissa).:622-4 Huokosten kokonaishalkaisija on 100 nm, mutta aukko, jonka läpi molekyylit diffundoituvat vapaasti, on kuitenkin vain noin 9 nm leveä, mikä johtuu huokosen keskellä olevista säätelyjärjestelmistä. Tämä koko sallii valikoivasti pienten vesiliukoisten molekyylien kulun ja estää samalla suurempia molekyylejä, kuten nukleiinihappoja ja suurempia proteiineja, pääsemästä sopimattomasti tumaan tai poistumasta tumaan. Nämä suuret molekyylit on sen sijaan kuljetettava aktiivisesti tumaan. Tyypillisen nisäkässolun ytimessä on noin 3000-4000 huokosta, joista jokainen sisältää kahdeksankertaisen symmetrisen rengasmaisen rakenteen kohdassa, jossa sisä- ja ulkokalvo sulautuvat yhteen. Renkaaseen on kiinnittynyt ydinkoriksi kutsuttu rakenne, joka ulottuu ydinplasmaan, ja sarja säikeisiä ulokkeita, jotka ulottuvat sytoplasmaan. Molempien rakenteiden tehtävänä on välittää sitoutumista ydinkuljetusproteiineihin.:509-10
Useimmat proteiinit, ribosomaaliset alayksiköt ja jotkin RNA:t kulkeutuvat huokoskompleksien läpi karyopheriineiksi kutsutun kuljetustekijäperheen välittämässä prosessissa. Niitä karyopheriinejä, jotka välittävät siirtymistä tumaan, kutsutaan myös importiineiksi, kun taas niitä, jotka välittävät siirtymistä ulos tumista, kutsutaan exportiineiksi. Useimmat karyopheriinit ovat suoraan vuorovaikutuksessa lastinsa kanssa, vaikka jotkut käyttävät adaptoriproteiineja. Steroidihormonit, kuten kortisoli ja aldosteroni, sekä muut pienet lipidiliukoiset molekyylit, jotka osallistuvat solujen väliseen signalointiin, voivat diffundoitua solukalvon läpi sytoplasmaan, jossa ne sitoutuvat ydinreseptoriproteiineihin, jotka kulkeutuvat tumaan. Siellä ne toimivat ligandiinsa sitoutuneina transkriptiotekijöinä; ligandin puuttuessa monet tällaiset reseptorit toimivat histonideasetylaaseina, jotka tukahduttavat geeniekspressiota.:488
Ydinlamina
Eläinsoluissa kaksi intermediääristen filamenttien verkostoa antaa ytimelle mekaanista tukea: Ydinlamina muodostaa järjestäytyneen verkoston kuoren sisäpinnalla, kun taas vähemmän järjestäytynyt tuki on kuoren sytosolisella pinnalla. Molemmat järjestelmät tarjoavat rakenteellista tukea ydinkuorelle ja ankkurointipaikkoja kromosomeille ja ydinhuokosille.
Ydinlamina koostuu pääasiassa lamiiniproteiineista. Kuten kaikki proteiinit, lamiinit syntetisoidaan sytoplasmassa ja kuljetetaan myöhemmin tuman sisälle, jossa ne kootaan ennen kuin ne liitetään olemassa olevaan ydinlaminaattiverkostoon. Kalvon sytosolisella puolella olevat lamiinit, kuten emeriini ja nesprin, sitoutuvat sytoskelettiin tarjotakseen rakenteellista tukea. Lamiineja on myös nukleoplasman sisällä, jossa ne muodostavat toisen säännöllisen rakenteen, nukleoplasmahunnun, joka on nähtävissä fluoresenssimikroskopian avulla. Verhon varsinainen tehtävä ei ole selvillä, vaikka se ei kuulu nukleoliin ja on läsnä interfaasin aikana. Verhon muodostavat lamiinirakenteet, kuten LEM3, sitovat kromatiinia, ja niiden rakenteen häiritseminen estää proteiineja koodaavien geenien transkriptiota.
Kuten muidenkin intermediääristen filamenttien osat, lamiinimonomeeri sisältää alfa-helikaalisen domeenin, jota kaksi monomeeria käyttää kietoutuakseen toistensa ympärille muodostaen dimerirakenteen, jota kutsutaan kierteiseksi kelaksi. Kaksi tällaista dimeerirakennetta yhdistyy sitten rinnakkain antiparalleelisesti muodostaen protofilamentiksi kutsutun tetrameerin. Kahdeksan näistä protofilamenteista muodostaa sivuttaisen järjestelyn, joka on kierretty ja muodostaa köydenmuotoisen filamentin. Nämä filamentit voidaan koota tai purkaa dynaamisesti, mikä tarkoittaa, että filamentin pituuden muutokset riippuvat kilpailevista filamenttien lisäys- ja poistonopeuksista.
Mutaatiot lamiinigeeneissä, jotka johtavat filamenttien koontivirheisiin, aiheuttavat ryhmän harvinaisia geneettisiä sairauksia, jotka tunnetaan nimellä laminaattisairaudet. Merkittävin laminopatia on progeria-nimellä tunnettu tautiperhe, joka aiheuttaa sairastuneille ennenaikaisen ikääntymisen. Tarkkaa mekanismia, jolla siihen liittyvät biokemialliset muutokset aiheuttavat ikääntyneen fenotyypin, ei tunneta hyvin.
Kromosomit

Solun tuma sisältää suurimman osan solun perintöaineksesta useina lineaarisina DNA-molekyyleinä, jotka on järjestäytyneet rakenteisiin, joita kutsutaan nimellä kromosomi. Jokaisessa ihmisen solussa on noin kaksi metriä DNA:ta. 405 Suurimman osan solusykliä nämä ovat järjestäytyneet DNA-proteiinikompleksiksi, jota kutsutaan kromatiiniksi, ja solunjakautumisen aikana kromatiinin voidaan nähdä muodostavan karyotyypistä tutut tarkkaan rajatut kromosomit. Pieni osa solun geeneistä sijaitsee sen sijaan mitokondrioissa.:438
Kromatiinia on kahdenlaista. Eukromatiini on vähemmän tiivis DNA-muoto, ja se sisältää geenit, joita solu ilmentää usein. Toinen tyyppi, heterokromatiini, on tiiviimpi muoto, ja se sisältää harvoin transkriboituvaa DNA:ta. Tämä rakenne luokitellaan edelleen fakultatiiviseen heterokromatiiniin, joka koostuu geeneistä, jotka ovat järjestäytyneet heterokromatiiniksi vain tietyissä solutyypeissä tai tietyissä kehitysvaiheissa, ja konstitutiiviseen heterokromatiiniin, joka koostuu kromosomien rakenneosista, kuten telomeereistä ja sentromeereistä. Interfaasin aikana kromatiini järjestäytyy erillisiksi yksittäisiksi laikuiksi, joita kutsutaan kromosomialueiksi. Aktiiviset geenit, jotka sijaitsevat yleensä kromosomin euchromaattisella alueella, pyrkivät sijoittumaan kohti kromosomin reviirin rajaa.
Vasta-aineet tietyntyyppistä kromatiiniorganisaatiota, erityisesti nukleosomeja, vastaan on yhdistetty useisiin autoimmuunisairauksiin, kuten systeemiseen lupus erythematosukseen. Nämä tunnetaan nimellä ydinvasta-aineet (ANA), ja niitä on havaittu myös yhdessä multippeliskleroosin kanssa osana immuunijärjestelmän yleistä toimintahäiriötä.
Nucleolus

Nukleoli on suurin ytimessä esiintyvistä erillisistä tiheästi värjäytyneistä kalvottomista rakenteista, joita kutsutaan ytimen kappaleiksi. Se muodostuu ribosomaalista RNA:ta (rRNA) koodaavan DNA:n, rDNA:n, tandemtoistojen ympärille. Näitä alueita kutsutaan nukleolaarisiksi organisoitumisalueiksi (NOR). Nukleolien tärkeimmät tehtävät ovat rRNA:n syntetisointi ja ribosomien kokoaminen. Nukleoluksen rakenteellinen yhteenkuuluvuus riippuu sen aktiivisuudesta, sillä ribosomien kokoaminen nukleoluksessa johtaa nukleolaaristen komponenttien ohimenevään assosiaatioon, mikä helpottaa ribosomien jatkokokoontumista ja siten edelleen assosioitumista. Tätä mallia tukevat havainnot siitä, että rDNA:n inaktivointi johtaa nukleolaarirakenteiden sekoittumiseen toisiinsa.
Ribosomien kokoamisen ensimmäisessä vaiheessa RNA-polymeraasi I -niminen proteiini transkriboi rDNA:ta, josta muodostuu suuri pre-rRNA-esiaste. Tämä pilkotaan kahdeksi suureksi rRNA-alayksiköksi – 5.8S ja 28S – ja pieneksi rRNA-alayksiköksi 18S.:328 RRNA:n transkriptio, transkription jälkeinen prosessointi ja kokoaminen tapahtuvat nukleolissa pienten nukleolaaristen RNA (snoRNA) -molekyylien avustamana, joista osa on peräisin ribosomaaliseen toimintaan liittyviä geenejä koodaavien sanansaattajien RNA:iden pilkotuista introneista. Kootut ribosomaaliset alayksiköt ovat suurimpia rakenteita, jotka kulkevat ydinhuokosten läpi.:526
Elektronimikroskoopilla tarkasteltuna nukleoli voidaan nähdä koostuvan kolmesta toisistaan erottuvasta alueesta: sisimmistä fibrillaarisista keskuksista (FC), joita ympäröi tiheä fibrillaarinen komponentti (DFC) (joka sisältää fibrillariinia ja nukleoliinia), jota puolestaan rajaa granulaarinen komponentti (GC) (joka sisältää proteiinia nucleophosmin). RDNA:n transkriptio tapahtuu joko FC:ssä tai FC-DFC:n rajalla, ja siksi kun rDNA:n transkriptio solussa lisääntyy, FC:tä havaitaan enemmän. Suurin osa rRNA:n pilkkomisesta ja modifikaatiosta tapahtuu DFC:ssä, kun taas jälkimmäiset vaiheet, joihin liittyy proteiinien kokoaminen ribosomaalisiin alayksiköihin, tapahtuvat GC:ssä.
Muut ydinkappaleet
| Rakenteen nimi | Rakenteen halkaisija | Ref. |
|---|---|---|
| Cajal bodies | 0.2-2.0 µm | |
| Clastosomes | 0.2-0.5 µm | |
| PIKA | 5 µm | |
| PML-ruumiit | 0.2-1.0 µm | |
| Paraspeckles | 0.5-1.0 µm | |
| Speckles | 20-25 nm |
Tumakkeessa on tuman lisäksi useita muitakin tumakkeita. Näitä ovat Cajalin kappaleet, Cajalin gemini-kappaleet, polymorfinen interfaasikaryosomaalinen assosiaatio (PIKA), promyelosyyttisen leukemian (PML) kappaleet, paraspektaalit ja liitospektaalit. Vaikka useista näistä alueista tiedetään vain vähän, ne ovat merkittäviä siinä mielessä, että ne osoittavat, että nukleoplasma ei ole yhtenäinen sekoitus, vaan se sisältää järjestäytyneitä toiminnallisia osa-alueita.
Muita subnukleaarisia rakenteita esiintyy osana epänormaaleja sairausprosesseja. Esimerkiksi pienten intranukleaaristen sauvojen esiintymistä on raportoitu joissakin nemaliinimyopatian tapauksissa. Tämä tila on tyypillisesti seurausta aktiinin mutaatioista, ja itse sauvat koostuvat mutatoituneesta aktiinista sekä muista sytoskelettiproteiineista.
Cajalin kappaleet ja jalokivet
Tuma sisältää tyypillisesti yhdestä kymmeneen kompaktia rakennetta, joita kutsutaan nimellä Cajalin kappaleet tai kierteiset kappaleet (Cajal bodies, CB) ja joiden halkaisija on solutyypistä ja -lajeista riippuen 0,2 µm:n ja 2,0 µm:n välillä. Elektronimikroskoopilla tarkasteltuna ne muistuttavat kietoutuneen langan muodostamia palloja, ja ne ovat proteiini coilinin tiheitä levinneisyyspesäkkeitä. CB:t osallistuvat useisiin eri tehtäviin, jotka liittyvät RNA:n prosessointiin, erityisesti pienen nukleolaarisen RNA:n (snoRNA) ja pienen ydin-RNA:n (snRNA) kypsymiseen sekä histoni-mRNA:n modifikaatioon.
Cajalin kappaleiden kaltaisia ovat Gemini of Cajalin kappaleet eli jalokivet (Gemini of Cajal bodies, gems, gems), joiden nimitys juontuu Kaksoset-tähdistöstä viitaten niiden läheiseen ”kaksoissuhteeseen” CB:n kanssa. Jalokivet ovat kooltaan ja muodoltaan samankaltaisia kuin CB:t, ja itse asiassa ne ovat mikroskoopissa lähes erottamattomat. Toisin kuin CB:t, jalokivet eivät sisällä pieniä ydinribonukleoproteiineja (small nuclear ribonucleoproteins, snRNPs), mutta ne sisältävät proteiinia nimeltä survival of motor neuron (SMN), jonka tehtävä liittyy snRNP:n biogeneesiin. Jalokivien uskotaan avustavan CB:tä snRNP:n biogeneesissä, vaikka mikroskooppisten todisteiden perusteella on myös esitetty, että CB:t ja jalokivet ovat saman rakenteen eri ilmenemismuotoja. Myöhemmät ultrastruktuuritutkimukset ovat osoittaneet jalokivien olevan Cajal-kappaleiden kaksosia, joiden ero on coilin-komponentissa; Cajal-kappaleet ovat SMN-positiivisia ja coilin-positiivisia, ja jalokivet ovat SMN-positiivisia ja coilin-negatiivisia.
PIKA- ja PTF-domeenit
PIKA-domeenit eli polymorfiset interfaasiset karyosomiliitokset kuvattiin ensimmäisen kerran mikroskooppitutkimuksissa vuonna 1991. Niiden tehtävä on edelleen epäselvä, vaikka niiden ei uskottu liittyvän aktiiviseen DNA:n replikaatioon, transkriptioon tai RNA:n prosessointiin. Niiden on havaittu assosioituvan usein erillisiin domeeneihin, jotka on määritelty pienen ydin-RNA:n (snRNA) transkriptiota edistävän transkriptiotekijän PTF:n tiheällä lokalisaatiolla.
PML-ruumiit
Promyelosyyttiset leukemianruumiit (PML-ruumiit, PML-ruumiit) ovat pallomaisia ruumiita, joita esiintyy hajallaan koko nukleoplasmassa ja jotka ovat kooltaan n. 0,1 – 1,0 µm. Ne tunnetaan useilla muilla nimillä, kuten Nuclear Domain 10 (ND10), Kremerin kappaleet ja PML:n onkogeeniset domeenit. PML-kappaleet on nimetty yhden niiden pääkomponentin, promyelosyyttisen leukemian proteiinin (PML) mukaan. Niitä nähdään usein ytimessä yhdessä Cajalin kappaleiden ja pilkkoutumiskappaleiden kanssa. Pml-/-hiiret, jotka eivät kykene muodostamaan PML-ruumiita, kehittyvät normaalisti ilman ilmeisiä haittavaikutuksia, mikä osoittaa, että PML-ruumiita ei tarvita useimpiin keskeisiin biologisiin prosesseihin.
Splikointitäplät
Täplät ovat subnukleaarisia rakenteita, jotka ovat rikastuneet pre-messenger RNA:n splikointitekijöillä, ja ne sijaitsevat nisäkässolujen tumanukleoplasman interkromatiinialueilla. Fluoresenssimikroskooppitasolla ne näkyvät epäsäännöllisinä, pistemäisinä rakenteina, jotka vaihtelevat kooltaan ja muodoltaan, ja elektronimikroskooppisesti tutkittaessa ne näkyvät kromatiinien välisten rakeiden ryppäinä. Täplät ovat dynaamisia rakenteita, ja sekä niiden proteiini- että RNA-proteiinikomponentit voivat kiertää jatkuvasti täplien ja muiden ydinpaikkojen välillä, mukaan lukien aktiiviset transkriptiokohdat. Pilkkujen koostumusta, rakennetta ja käyttäytymistä koskevat tutkimukset ovat tarjonneet mallin, jonka avulla voidaan ymmärtää ytimen toiminnallista lokeroitumista ja geeniekspressiokoneiston organisoitumista, joka splikoi snRNP:tä ja muita pre-mRNA:n prosessoinnissa tarvittavia splikointiproteiineja. Solun muuttuvien vaatimusten vuoksi näiden kappaleiden koostumus ja sijainti muuttuvat mRNA:n transkription ja tiettyjen proteiinien fosforylaation kautta tapahtuvan säätelyn mukaan. Splikointitihentymät tunnetaan myös nimillä ydintihentymät (nuclear specks), splikointitekijäosastot (splicing factor compartments, SF compartments), interkromatiinigranulaariset klusterit (interchromatin granule clusters, IGCs) ja B-snurposomit (B snurposomes). b-snurposomeja tavataan sammakkoeläinten munasolujen tuma-ytimissä ja Drosophila melanogasterin alkiossa. B-snurposomit näkyvät sammakkoeläinten ytimistä otetuissa elektronimikroskooppikuvissa yksinään tai kiinnittyneinä Cajalin kappaleisiin. IGC:t toimivat liitostekijöiden varastointipaikkoina.
Paraspeckles
Fox et al. vuonna 2002 löytämät paraspecklet ovat epäsäännöllisen muotoisia lokeroita tuman interkromatiinitilassa. Ensimmäisenä ne dokumentoitiin HeLa-soluissa, joissa niitä on yleensä 10-30 kappaletta per tuma, mutta nykyään paraspecklejä tiedetään esiintyvän myös kaikissa ihmisen primaarisoluissa, transformoituneissa solulinjoissa ja kudosleikkeissä. Niiden nimi juontuu niiden jakautumisesta tumaan; ”para” on lyhenne sanoista parallel ja ”speckles” viittaa liitospesäkkeisiin, joiden läheisyydessä ne ovat aina.
Paraspeckles sitoo ydinproteiineja ja RNA:ta ja näyttää siten toimivan molekulaarisena pesusienenä, joka osallistuu geeniekspression säätelyyn. Lisäksi paraspeklit ovat dynaamisia rakenteita, jotka muuttuvat vastauksena solun metabolisen aktiivisuuden muutoksiin. Ne ovat transkriptiosta riippuvaisia, ja jos RNA Pol II -transkriptio puuttuu, paraspeckle katoaa ja kaikki siihen liittyvät proteiinikomponentit (PSP1, p54nrb, PSP2, CFI(m)68 ja PSF) muodostavat puolikuun muotoisen perinukleolaarisen korkin nukleoliin. Tämä ilmiö ilmenee solusyklin aikana. Solusyklin aikana paraspecklejä esiintyy interfaasin aikana ja koko mitoosin aikana lukuun ottamatta telofaasia. Telofaasin aikana, kun kaksi tytärydintä muodostuu, ei tapahdu RNA Pol II:n transkriptiota, joten proteiinikomponentit muodostavat sen sijaan perinukleolaarisen korkin.
Perikromatiinifibrillit
Perikromatiinifibrillit näkyvät vain elektronimikroskoopissa. Ne sijaitsevat transkriptiivisesti aktiivisen kromatiinin vieressä, ja niiden oletetaan olevan aktiivisen pre-mRNA-prosessoinnin paikkoja.
Klastosomit
Klastosomit ovat pieniä ydinkappaleita (0,2-0,5 µm), jotka kuvataan paksun rengasmaisiksi näiden kappaleiden ympärillä olevan perifeerisen kapselin vuoksi. Nimi on peräisin kreikan klastos, rikkinäinen ja soma, ruumis, sanoista. Klastosomeja ei tyypillisesti esiinny normaaleissa soluissa, joten niitä on vaikea havaita. Ne muodostuvat ytimen sisällä korkeissa proteolyyttisissä olosuhteissa ja hajoavat, kun aktiivisuus vähenee tai jos soluja hoidetaan proteasomin estäjillä. Klastosomien vähäisyys soluissa viittaa siihen, että niitä ei tarvita proteasomin toiminnassa. Osmoottisen stressin on myös osoitettu aiheuttavan klastosomien muodostumista. Nämä ydinkappaleet sisältävät proteasomin katalyyttisiä ja säätelyyn käytettäviä alayksiköitä ja sen substraatteja, mikä viittaa siihen, että klastosomit ovat proteiinien hajoamispaikkoja.